超高效液相色谱-串联质谱法鉴定和分析稻米中酚酸类化合物的组成及分布
2020-02-25赵珊仲伶俐周虹李曦雷欣宇黄世群郑幸果冯俊彦雷绍荣郭灵安
赵珊,仲伶俐,周虹,李曦,雷欣宇,黄世群,郑幸果,冯俊彦,雷绍荣,郭灵安
超高效液相色谱-串联质谱法鉴定和分析稻米中酚酸类化合物的组成及分布
赵珊1,仲伶俐1,周虹1,李曦1,雷欣宇1,黄世群1,郑幸果1,冯俊彦2,雷绍荣1,郭灵安1
(1四川省农业科学院分析测试中心/农业部农产品质量安全风险评估实验室(成都),成都 610066;2四川省农业科学院生物技术核技术研究所, 成都 610061)
【目的】水稻是世界上最重要的作物之一,也是人们饮食中酚酸类营养成分的重要来源。建立稻米中酚酸类化合物鉴定与分析的超高效液相色谱-串联质谱(UPLC-MS/MS)检测方法,以深入了解和挖掘稻米的功能性营养。【方法】采用UPLC-MS/MS法对四川收集的白米、红米、紫米和黑米等14份材料中的19种酚酸进行定性和定量分析。优化碱水解、酸水解和净化萃取方法等前处理条件,同时优化色谱柱、流动相条件和质谱条件,并采用电喷雾电离和多反应监测模式进行检测。最后利用优化的分析方法分别测定糙米样品中的游离型、可溶性酯型、可溶性糖苷型、不溶性结合型和不溶性糖苷型酚酸的含量。【结果】通过对前处理条件的比对优化,获得的最优条件为:在含1%抗坏血酸和10 mmol·L-1EDTA的2 mol·L-1NaOH浓度下碱水解4 h,在1 mol·L-1HCl溶液下酸水解1 h;所有净化萃取都使用含0.2% BHA的乙酸乙酯;采用HSS T3色谱柱,乙腈-0.01%甲酸水溶液为流动相进行梯度洗脱;除反式肉桂酸采用正离子模式,其余均为负离子模式,各化合物峰形好、分离度和灵敏度高。19种酚酸的线性范围良好(2≥0.9997),检出限在0.023—4.728 μg·L-1,定量限在0.076—15.759 μg·L-1。19种酚酸游离型酚酸提取回收率为55.3%—98.0%,18种酚酸(绿原酸除外)的碱水解和酸水解回收率分别为90.8%—103.1%、51.7%—100.3%。该方法测定的14份稻米中共鉴定出14种酚酸,定量的有12种,酚酸总含量范围为356.3—1 234.5 mg·kg-1,含量较高的有阿魏酸、原儿茶酸、香草酸、4-香豆酸、芥子酸和对羟基苯甲酸,其中原儿茶酸和香草酸主要存在于紫米和黑米中,主要为不溶性结合型、可溶性酯型和可溶性糖苷型酚酸。【结论】该方法准确且灵敏度高。在提取和测定过程中保护剂的加入能有效抑制酚酸的降解,增加游离型和糖苷型酚酸的鉴定与定量分析,能更精确、全面地呈现出稻米中酚酸的分布情况。
酚酸;超高效液相色谱;串联质谱;稻米
0 引言
【研究意义】水稻(L.)作为最重要的粮食作物之一,为世界上近一半的人口提供了口粮。随着社会的发展和生活水平的提高,消费者除了追求口感品质外,对功能性品质的需求也日益迫切。稻米中除富含淀粉、蛋白质、脂肪等大分子物质和各种氨基酸、维生素、矿物质、纤维素等外,还含有对人类健康非常重要的功能性营养成分,如谷维素、生育酚、花色苷、类黄酮、酚酸等,它们主要存在于种皮和胚中[1-2]。早在2000年,Hudson等[3]发现亚洲人群长期食用大米的方式与较低的癌症和冠心病发病率之间呈正相关关系,证明糙米和麸皮中含有预防癌症的成分。此后便掀起了水稻功能性成分研究的热潮,到目前为止,已发表的相关研究论文累计超过1 000篇[4],水稻也逐渐成为动物和人类临床试验和食品功能强化研究中最多的谷物之一[5]。酚酸是指结构中带有酚类基团和有机羧酸官能团的物质[6],多为C6-C1骨架的羟基苯甲酸衍生物和C6-C3骨架的羟基肉桂酸衍生物(表1)。它们中一小部分以“游离态”形式存在,大多数通过酯键、醚键或缩醛键与植物的结构组分(如纤维素、蛋白质、木质素),较大的多酚(类黄酮),有机小分子(如葡萄糖、奎尼酸、马来酸、酒石酸)或其他天然产物(萜烯)相连[7-9][7, 8]。酚酸广泛存在于水果、蔬菜、粮食、豆类等植物中,具有提高免疫力、预防疾病、辅助药物治疗等积极作用[10]。稻米中酚酸的含量与品种、环境和加工方式等存在一定关系,主要包括羟基苯甲酸类的对羟基苯甲酸、原儿茶酸、香草酸、丁香酸等,羟基肉桂酸类的咖啡酸、芥子酸、对香豆酸、阿魏酸等[11-20]。四川是水稻消费大省,90%以上的人口以大米为主食,常年消费量在1.4×107t以上[21],掌握稻米中酚酸的种类及分布,深入挖掘稻米的功能营养价值,对丰富我国食品营养数据库和育种资源提供依据。【前人研究进展】目前,酚酸的分析方法主要有分光光度法[22-24]、高效液相色谱法[25-27]、液相色谱-质谱联用法[28-29]、超高效液相色谱-串联质谱法(ultra-high performance liquid chromatography- tandem mass spectrometry,UPLC-MS/MS)[30-33]等。超高效液相色谱比高效液相色谱的分离效果和灵敏度有很大的提高,但是对分离化学分子质量、结构相近的化合物以及含量较低的游离酚酸分离效果和灵敏度还存在不足。采用UPLC-MS/MS的多重反应监测模式(multiple reaction monitoring,MRM)进行定性定量分析,具有分离效率高、分析速度快、结果准确等特点,更适用于多种酚酸的分离和测定。张娜等[34]通过超高效液相色谱法分析稻米中14种结合型酚酸化合物的组成及其含量,对比了糙米和精米中结合酚酸组成和含量,该方法简便、快速。Gruz等[30]采用UPLC-MS/MS法快速定量不同饮料中的17种酚酸,该方法不需要对样品进行浓缩/纯化,且色谱分离时间不超过12 min。马帅等[33]利用UPLC-MS/MS法同时测定了花椰菜和西兰花中的23种酚酸类化合物,采用MRM模式进行定性和定量,该方法分析时间短、灵敏度高且重复性好。【本研究切入点】目前,水稻籽粒酚酸化合物的分析主要集中在含量较高的结合型酚酸中,如阿魏酸、对香豆酸等,还没有系统地对游离型、酯型、结合型、糖苷型的酚酸进行鉴定和分析,特别是糖苷型酚酸,国内报道极少,植物中酚酸的复杂存在形式是对其难以深入研究的主要原因。此外,目前对四川主栽稻米品种酚酸的相关检测与鉴定研究也未见报道,虽然有色稻品种中黄酮类成分如花色苷、原花青素的报道较多,但是对其酚酸类成分的研究仍然较少。【拟解决的关键问题】本研究选取四川地区主栽优质稻、常规稻以及有色稻为材料,利用超高效液相色谱-串联质谱法建立稻米中19种酚酸类化合物的分析方法,探讨游离酚酸、可溶性酯型酚酸、不溶性结合酚酸、可溶和不溶性糖苷型酚酸在糙米中的存在形式、组成分布及含量,深入挖掘稻米产品营养功能优势,从品质角度为产业发展提供支持,为实现稻米产业的供给侧改革提供基础技术支撑。
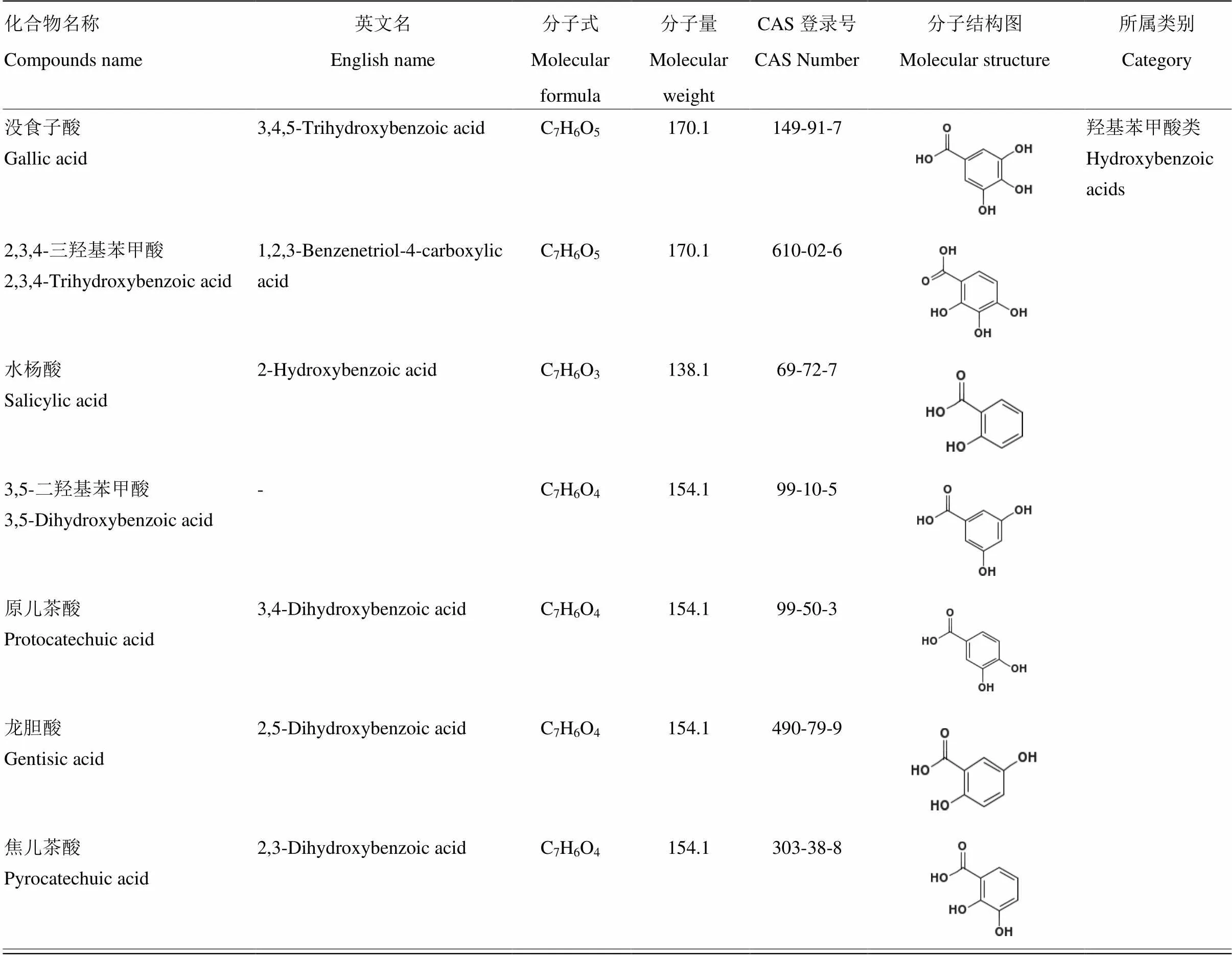
表1 酚酸类化合物基本信息汇总表[9]
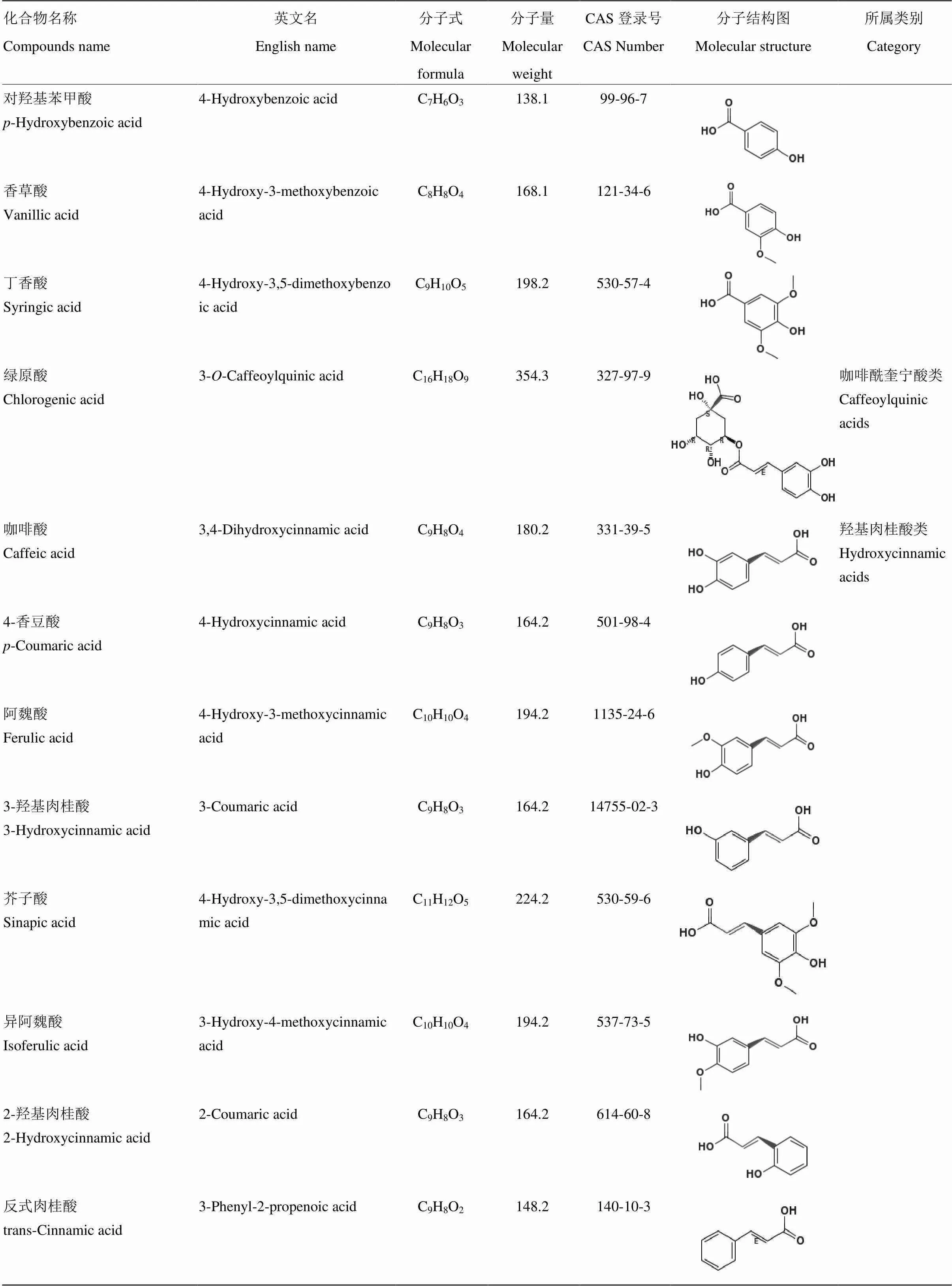
续表1 Continued table 1
1 材料与方法
1.1 材料
本研究14个样品材料收集于四川生产基地,均种植于2017年,采样于当年9—10月,其中包括籼稻、粳稻、黑米稻、红米稻以及紫米稻。材料具体信息见表2,脱壳后的糙米见图1。
1.2 仪器与试剂
ACQUITY UPLC I-Class/Xevo TQ-XS超高效液相色谱仪-串联三重四级杆质谱仪,配备电喷雾离子源(ESI),Masslynx 4.1工作站(美国Waters公司);AutoEVA-20Plus氮吹仪(厦门睿科仪器有限公司);D3204R高速离心机(北京大龙兴创实验仪器有限公司);FSJ-II型锤片式粮食粉粹机(中储粮成都粮食科学研究所);KQ5200DE超声波清洗机(昆明市超声仪器有限公司);ZD-85空气浴振荡器(常州国华电器有限公司);AUY220型电子天平(日本岛津公司);UPH-1-20L实验室超纯水仪(四川优普超纯科技有限公司);BLH3250实验砻谷机(浙江伯利恒仪器设备有限公司)。
酚酸标准品:没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、2-羟基肉桂酸、3-羟基肉桂酸、反式肉桂酸、水杨酸、3,5-二羟基苯甲酸、2,3,4-三羟基苯甲酸、龙胆酸、绿原酸、焦儿茶酸、咖啡酸、对香豆酸、阿魏酸、异阿魏酸、芥子酸,纯度均大于97%,购自美国Sigma-Aldrich公司;乙腈(色谱纯)、甲醇(色谱纯)、乙酸乙酯(色谱纯),购自美国Fisher Scientific公司;甲酸(色谱纯)、正己烷(色谱纯),上海安谱实验科技公司;Oasis HLB固相萃取柱(60 mg/3 cc),美国Waters公司;0.22 μm微孔过滤膜,天津市津腾实验设备有限公司;水为超纯水,氢氧化钠(优级纯)、盐酸(优级纯)、抗坏血酸(分析纯)、乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA,分析纯),购自广东西陇化工;叔丁基对羟基茴香醚(butylated hydroxy toluene,BHA,≥98%),购自上海阿拉丁生化科技公司。
1.3 样品制备
稻谷样品储存于装有生石灰的密封桶中,于2019年3月用砻谷机进行脱壳,分别将脱壳后的糙米用旋风磨粉机磨成粉并过80目筛,之后贮存于-20℃备用。

图1 不同稻米材料

表2 材料信息
1.4 前处理方法
1.4.1 游离型酚酸的提取 称取0.4 g(精确到0.0001 g)样品于10 mL离心管中加入5 mL正己烷超声30 min脱脂,弃去正己烷,溶剂挥发干后加入4 mL提取液(含有1%抗坏血酸的80%甲醇溶液),涡旋震荡混匀后室温超声30 min,5 000 r/min离心10 min后将上清液转移至20 mL试管中,重复上述提取步骤一次,合并上清液,于氮吹仪上浓缩至1.5 mL左右,调节溶液pH=2左右,即为溶液A。
乙酸乙酯萃取法:溶液A用2 mL乙酸乙酯(含0.2% BHA)涡旋萃取,重复一次,合并萃取液,氮气吹干后用50%甲醇溶液溶解并定容至2 mL,混匀后过0.22 μm滤膜,备用。
HLB固相萃取法:将固相萃取小柱依次用3 mL甲醇和3 mL含1%甲酸的水溶液预淋洗、活化,将溶液A加入到固相萃取小柱中,缓慢抽滤,弃去滤液,用5 mL甲醇清洗试管后加入到固相萃取小柱中,收集滤液,氮气吹干后用50%甲醇溶液溶解并定容至2 mL,混匀后过0.22 μm滤膜,备用。
1.4.2 可溶性酯型酚酸的提取(碱水解) 称取50 mg(精确到0.0001 g)样品于10 mL离心管中,加入2 mL提取液(80%甲醇溶液),涡旋震荡混匀后室温超声30 min,5 000 r/min离心10 min后将上清液转移至20 mL试管中,重复上述提取步骤一次,合并上清液(残渣留做结合型酚酸的提取),于氮吹仪上浓缩至0.8 mL以内,将浓缩液转移至10 mL离心管中,加入一定量的4 mol·L-1NaOH溶液(含1%抗坏血酸和10 mmol·L-1EDTA),使其浓度为2 mol·L-1,充入氮气密封。40℃气浴避光振荡水解4 h。然后用6 mol·L-1HCl溶液调节pH=2左右,加入2 mL乙酸乙酯(含0.2% BHA)涡旋萃取2—3次,合并萃取液于20 mL试管中,氮气吹干后用5 mL 50%甲醇溶液溶解,混匀后过0.22 μm滤膜,备用。萃取后的水相为溶液B。
试验中通过对比保护剂在碱水解过程中对不同酚酸的影响来优化其条件,分别使用4 mol·L-1NaOH溶液、4 mol·L-1NaOH溶液(含1%抗坏血酸)和4 mol·L-1NaOH溶液(含1%抗坏血酸和10 mmol·L-1EDTA)进行对比,通过比较不同酚酸的添加回收率来确定最优的碱水解条件。
1.4.3 可溶性糖苷型酚酸的提取(酸水解) 向溶液B中加入一定量的6 mol·L-1HCl溶液使其浓度为1 mol·L-1,85℃水浴水解1 h,再用4 mol·L-1NaOH溶液(含1%抗坏血酸和10 mmol·L-1EDTA)调pH=2左右,加入2 mL乙酸乙酯(含0.2% BHA)涡旋萃取2—3次,合并萃取液于20 mL试管中,氮气吹干后用5 mL 50%甲醇溶液溶解,混匀后过0.22 μm滤膜,备用。
参照文献[35-36],选择1 mol·L-1和2 mol·L-1的盐酸浓度来分别水解1 h和2 h。通过比较不同酚酸的添加回收率,了解不同酚酸在不同盐酸浓度和水解时间下的稳定性来确定较优的酸水解条件。
1.4.4 不溶性结合型酚酸的提取(碱水解) 向1.4.2步骤离心后的残渣中加入2 mL水和2 mL 4 mol·L-1NaOH溶液(含1%抗坏血酸和10 mmol·L-1EDTA)[37],立即涡旋混匀后充入氮气密封。40℃气浴避光振荡水解4 h。然后用6 mol·L-1HCl溶液调节pH=2左右,加入2 mL乙酸乙酯(含0.2% BHA)涡旋萃取2—3次,合并萃取液于20 mL试管中,氮气吹干后用5 mL 50%甲醇溶液溶解,混匀后过0.22 μm滤膜,备用。萃取后的水相为溶液C。
1.4.5 不溶性糖苷型酚酸的提取(酸水解) 向溶液C中加入一定量的6 mol·L-1HCl溶液使其浓度为1 mol·L-1,85℃水浴水解1 h,再用4 mol·L-1NaOH溶液(含1%抗坏血酸和10 mmol·L-1EDTA)调节pH=2左右,加入2 mL乙酸乙酯(含0.2% BHA)涡旋萃取2—3次,合并萃取液于20 mL试管中,氮吹干后用5 mL 50%甲醇溶液溶解,混匀后过0.22 μm滤膜,备用。
1.5 UPLC-MS/MS分析条件
1.5.1 标准溶液的配制 分别称取19种酚酸标准品各10 mg,用甲醇溶解并定容至10 mL,即为1 mg·mL-1的单标储备液,于-20℃下,贮存于密封的棕色玻璃瓶中。酚酸混合标准工作液采用梯度稀释法现配现用。
1.5.2 色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 µm);柱温:40℃;样品室温度10℃;进样量:2.0 μL;流动相A:0.01%甲酸水溶液,过0.2 μm有机相微孔过滤膜;流动相B:乙腈;流速:0.3 mL·min-1;梯度洗脱程序:0—0.5 min,5% B;0.5—3 min,5%—10% B;3—9 min,10%—13% B;9—12 min,13%—18% B;12—12.5 min,18% B;12.5—13.5 min,18%—50% B;13.5—14 min,50%— 90% B;14—14.5 min,90% B;14.5—15 min,90%—5% B;后运行2.5 min。
1.5.3 质谱条件 离子源:电喷雾电离源(ESI);扫描方式:正离子和负离子模式;监测模式:MRM;毛细管电压3.0 kV;离子源温度:150℃;脱溶剂气温度:500℃;脱溶剂气流量:1 000 L·h-1;碰撞气流速:0.15 mL·min-1;锥孔气流速:150 L·h-1。
2 结果
2.1 UPLC-MS/MS条件优化
2.1.1 色谱条件的优化 对酚酸类化合物进行分离的流动相体系主要有甲醇-水、乙腈-水。本研究考察不同流动相体系及在流动相中添加不同浓度的甲酸对酚酸类化合物分离效果的影响,结果发现,在流动相中加入一定浓度的酸可以改善峰形,提高分离效果。但是酸含量达到一定浓度后又会抑制负离子模式化合物的电离,降低灵敏度,如异阿魏酸。另外,考察不同色谱柱对19种酚酸的分离效果及峰形的影响,通过对比发现,HSS T3 C18色谱柱和BEH C18色谱柱均能实现19种酚酸的分离,但HSS T3 C18色谱柱在峰形、分离度上略优于BEH C18色谱柱。经过优化,本试验采用HSS T3 C18色谱柱,乙腈-0.01%甲酸水溶液作为流动相,进行梯度洗脱,19种酚酸化合物能得到较好的峰形、分离度和较高的响应值(图2)。
2.1.2 质谱条件的选择和优化 在正/负离子模式下分别对19种酚酸化合物进行扫描,确定准分子离子,优化毛细管电压、锥孔电压、碰撞能量、驻留时间等参数,使分子离子与特征碎片离子产生的离子对强度达到最大,确定丰度较高的两个分子离子作为定性离子,并选择其中丰度最高的作为定量离子,具体质谱参数见表3。
2.2 前处理条件优化
稻米中含有蛋白质、脂肪、淀粉、色素等干扰物质,目前去除这些干扰物质的方法主要有乙酸乙酯萃取法和固相萃取法。本研究通过比较发现,HLB固相萃取法对游离酚酸的净化效果和回收率略优于乙酸乙酯萃取法(表4),但在不溶性结合型酚酸的提取过程中,稻米残渣样品因含有大量淀粉经碱水解后发生糊化,不适合进行固相萃取,通过离心等途径又会使回收率降低。另外,本研究要经过多次水解和萃取,固相萃取法无法进行操作。因此,选择乙酸乙酯萃取法进行稻米中酚酸的提取,同时添加0.2% BHA防止萃取过程中酚酸类化合物发生降解。
本研究对比了不同酚酸在NaOH溶液中和在添加保护剂的NaOH溶液中进行水解后的回收情况。结果发现,部分酚酸在2 mol·L-1NaOH溶液中水解4 h后发生不同程度的降解,其中没食子酸、原儿茶酸、2,3,4-三羟基苯甲酸、龙胆酸、咖啡酸、焦儿茶酸和芥子酸降解最明显,回收率低于6.9%;绿原酸除外,绿原酸在碱性条件下水解成咖啡酸和奎宁酸。而在相同条件下,含有1%抗坏血酸的NaOH溶液和含有1%抗坏血酸和10 mmol·L-1EDTA的NaOH溶液中19种酚酸的回收率较好,范围分别为85.5%—110.5%、92.1%— 104.8%,RSD分别为0.12%—5.88%、0.24%—4.20%(表4)。可见,抗坏血酸和EDTA能有效防止酚酸在碱溶液中发生降解。综合考虑,选择NaOH溶液中添加1%抗坏血酸和10 mmol·L-1EDTA作为碱水解条件。
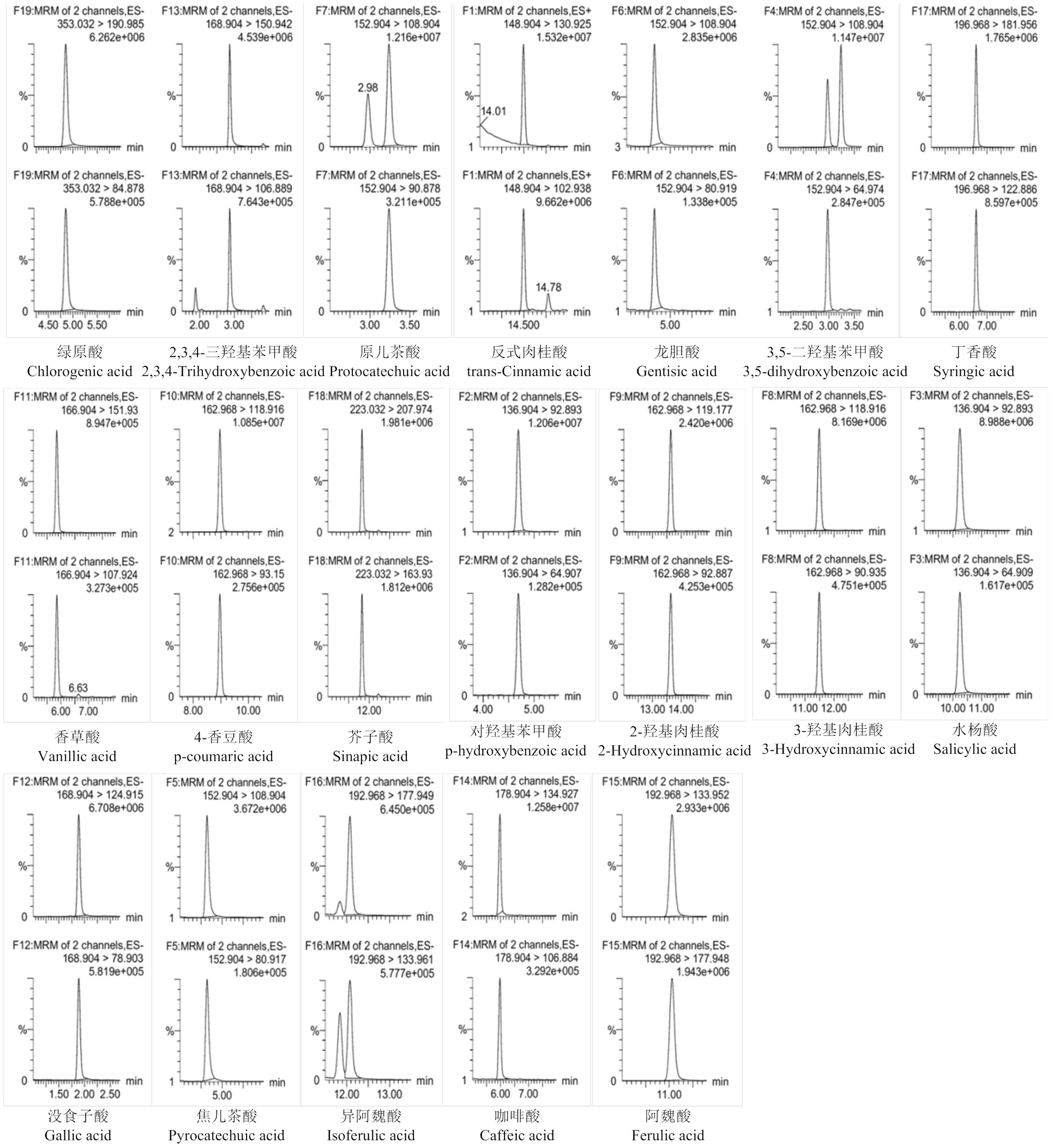
图2 19种酚酸的离子色谱图
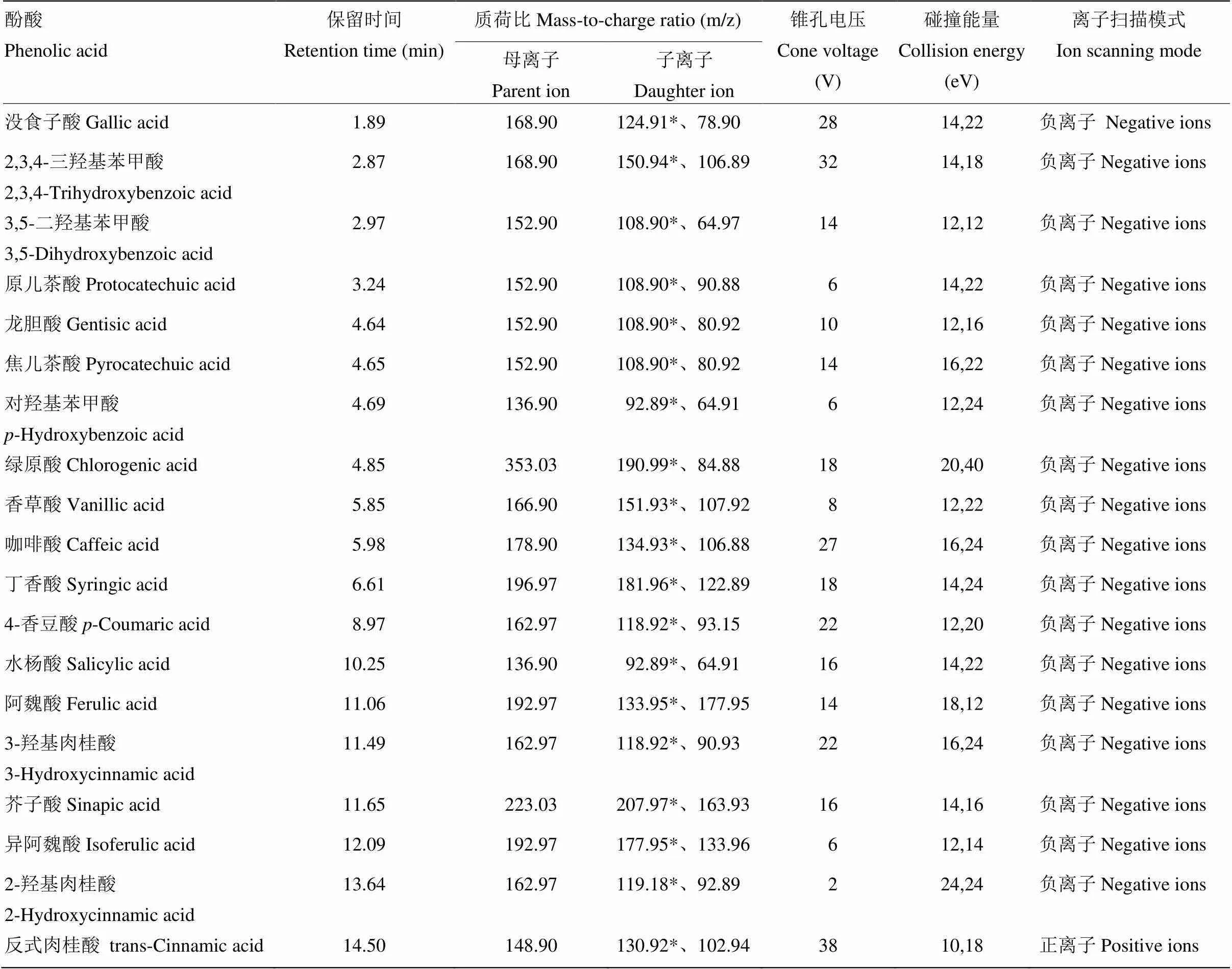
表3 目标化合物的质谱分析参数
*为定量离子*Represents quantitative ions in the table
大部分羟基肉桂酸类酚酸在酸水解条件下不稳定,如4-香豆酸、芥子酸、咖啡酸、阿魏酸和反式肉桂酸等。随着酸浓度的增加和水解时间的增加,2,3,4-三羟基苯甲酸、没食子酸、4-香豆酸、芥子酸、咖啡酸、阿魏酸、异阿魏酸和反式肉桂酸降解越来越严重,相反的是,龙胆酸和焦儿茶酸呈上升的趋势(图3)。尝试添加不同的抗氧化剂,如抗坏血酸、BHA、亚硫酸氢钠等都没有明显的改善。综合考虑,本研究酸水解条件选择1 mol·L-1HCl溶液水解1 h。
2.3 方法学考察
2.3.1 方法的线性、检出限、定量限、精密度、稳定性 配制不同浓度梯度的酚酸标准溶液,按照已建立的方法进样分析,以质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,计算标准曲线的回归方程和相关系数。结果表明,19种酚酸在一定浓度范围内线性良好,相关系数(2)在0.99973—0.99999,可以满足定量分析的要求。以3倍信噪比(RS/N)计算,19种酚酸的检出限(LOD)浓度范围为0.023—4.728 μg·L-1;以10倍信噪比(RS/N)计算,19种酚酸的的定量限(LOQ)浓度范围为0.076—15.759 μg·L-1,具体结果见表5。
取100 μg·L-1的混合标准溶液连续进样6次,计算19种目标成分峰面积的相对偏差(relative standard deviation,RSD),考察其精密度。取同一样品供试品溶液,分别在0、2、4、8、12和24 h进样6次,测定目标化合物峰面积的RSD,考察其稳定性。结果表明,19种酚酸精密度的RSD范围为0.20%— 4.10%,稳定性的RSD范围为0.68%—9.21%,其中焦儿茶酸、龙胆酸、反式肉桂酸稳定性的RSD高于5%。
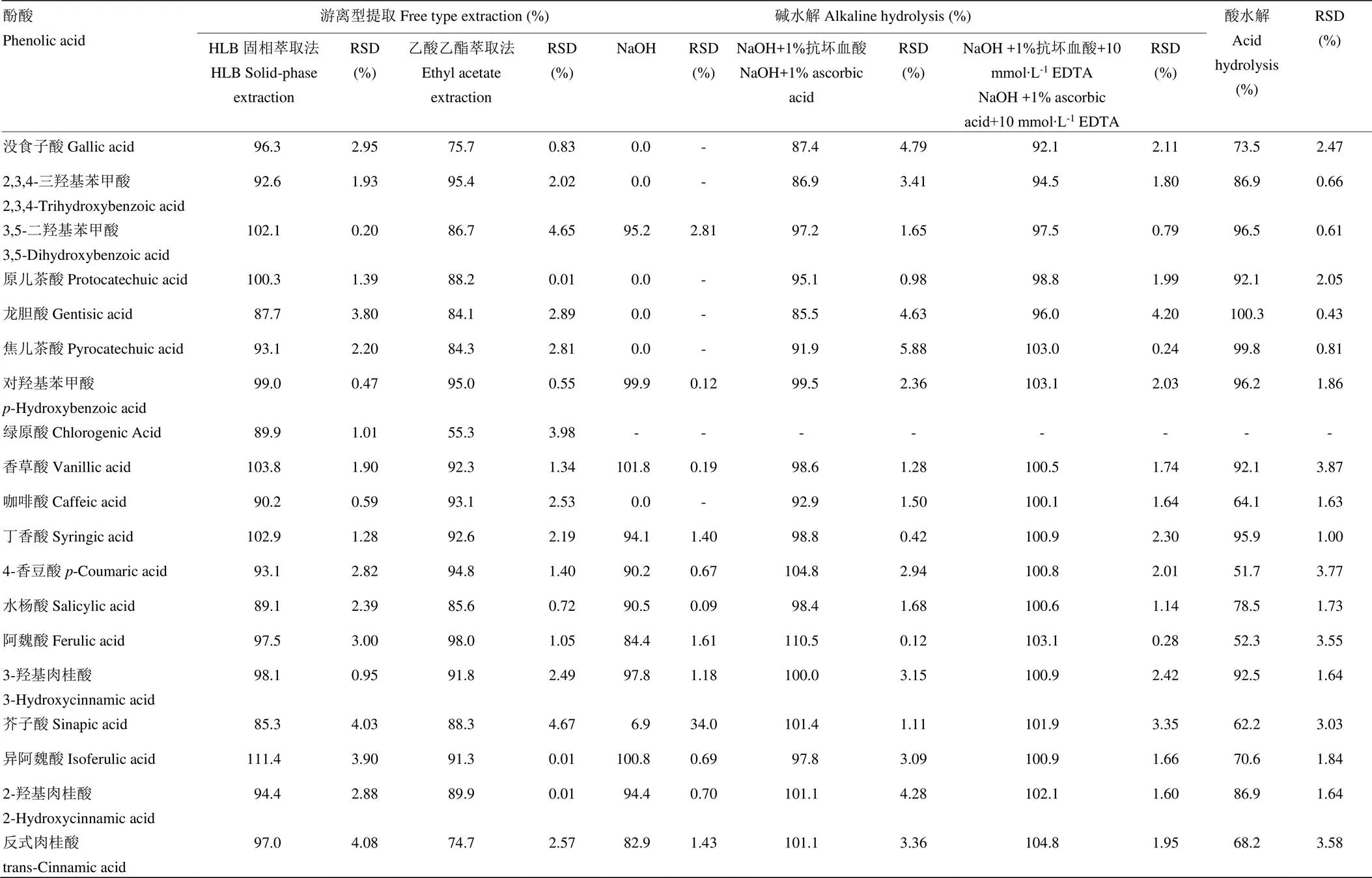
表4 稻米样品在不同试验方法中添加酚酸的回收率结果(n=6)
“-”:无数据No data
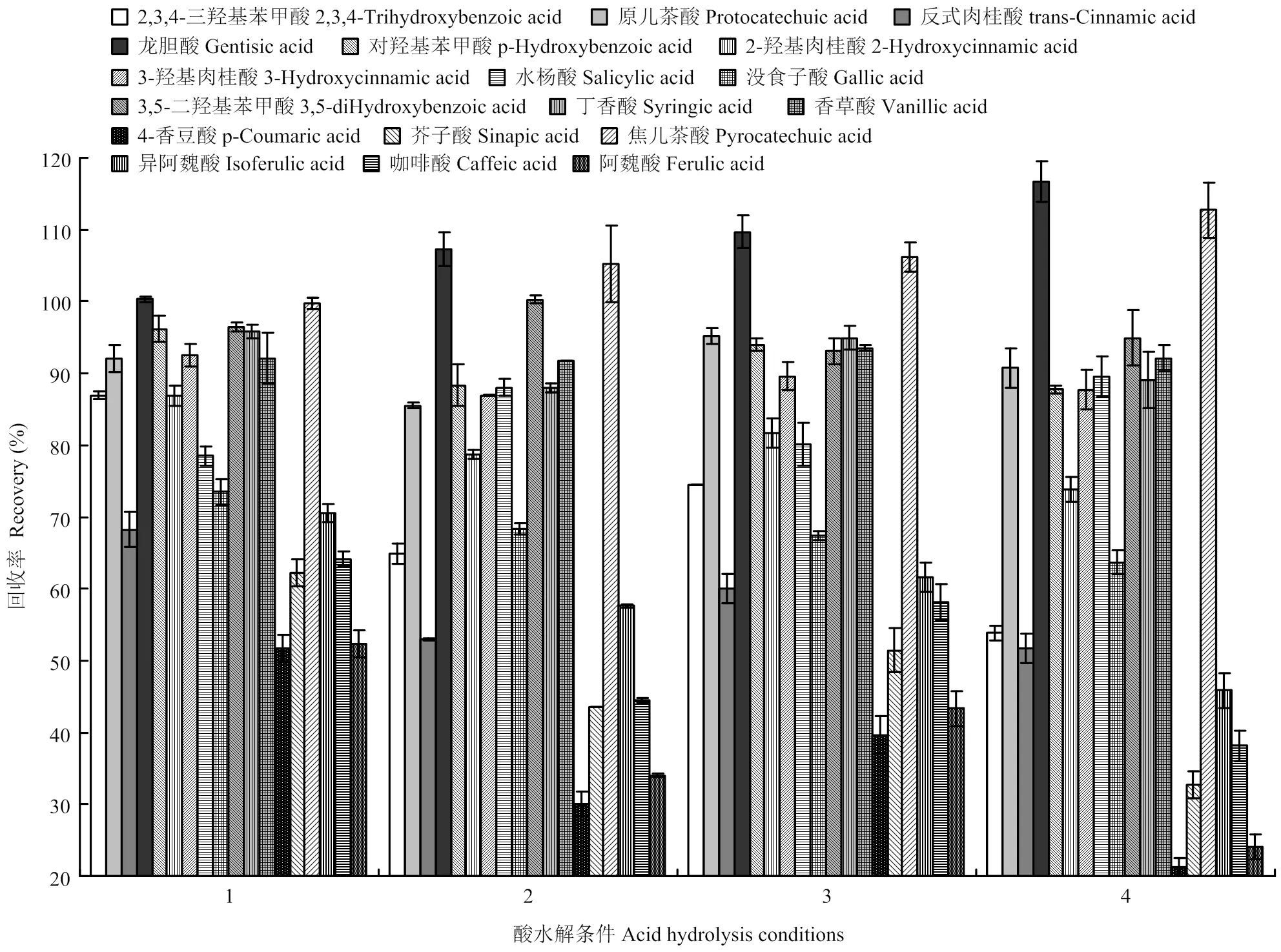
1:1 mol·L-1 HCl溶液水解1 h;2:1 mol·L-1 HCl溶液水解2 h;3:2 mol·L-1 HCl溶液水解1 h;4:2 mol·L-1 HCl溶液水解2 h
2.3.2 准确度试验结果 按照1.4.1的试验方法称取试样并进行样品制备,添加1.25 μg·g-1的19种酚酸混合标准溶液到已知含量的样品中;按照1.4.2的试验方法称取试样和样品制备,添加10 μg·g-1的18种酚酸混合标准溶液(绿原酸除外)到已知含量的样品中;按照1.4.2方法制备完后向溶液B中加入10 μg·g-1的18种酚酸混合标准溶液(绿原酸除外),再按照1.4.3进行样品制备,所有样品均按照1.5方法进行测定并计算目标化合物的回收率及RSD,结果见表4。从结果中可以看出,19种酚酸类化合物在游离型酚酸的提取中,HLB固相萃取法的回收率范围为85.3%—111.4%,RSD为0.20%—4.08%;乙酸乙酯萃取法为55.3%—98.0%,RSD为0.01%—4.67%。18种酚酸类化合物在优化后的碱水解处理中的回收率为92.1%—104.8%,RSD为0.24%—4.20%;优化后的酸水解回收率为51.7%—100.3%,RSD为0.43% —3.87%。
2.4 稻米样品中酚酸的测定结果
2.4.1 不同稻米在5种类型酚酸的分布情况 14个稻米共鉴定出14种酚酸化合物,其中12种能够进行定量(表6)。绿原酸在部分材料的游离型中检出微量,焦儿茶酸在有色米的游离型和可溶性糖苷型中微量检出,其他酚酸的情况如下:
游离型酚酸:白米材料中检测到的主要酚酸种类和含量高低依次为阿魏酸>4-香豆酸>咖啡酸>香草酸>对羟基苯甲酸>芥子酸;红米中为原儿茶酸>阿魏酸>4-香豆酸>咖啡酸>香草酸>水杨酸;紫米和黑米中为原儿茶酸>香草酸>阿魏酸>2,3,4-三羟基苯甲酸。其中所有材料的原儿茶酸的含量范围为0.05—27.37 mg·kg-1,香草酸为0.27—19.63 mg·kg-1,阿魏酸1.81—7.31 mg·kg-1,4-香豆酸为0.30—2.95 mg·kg-1。
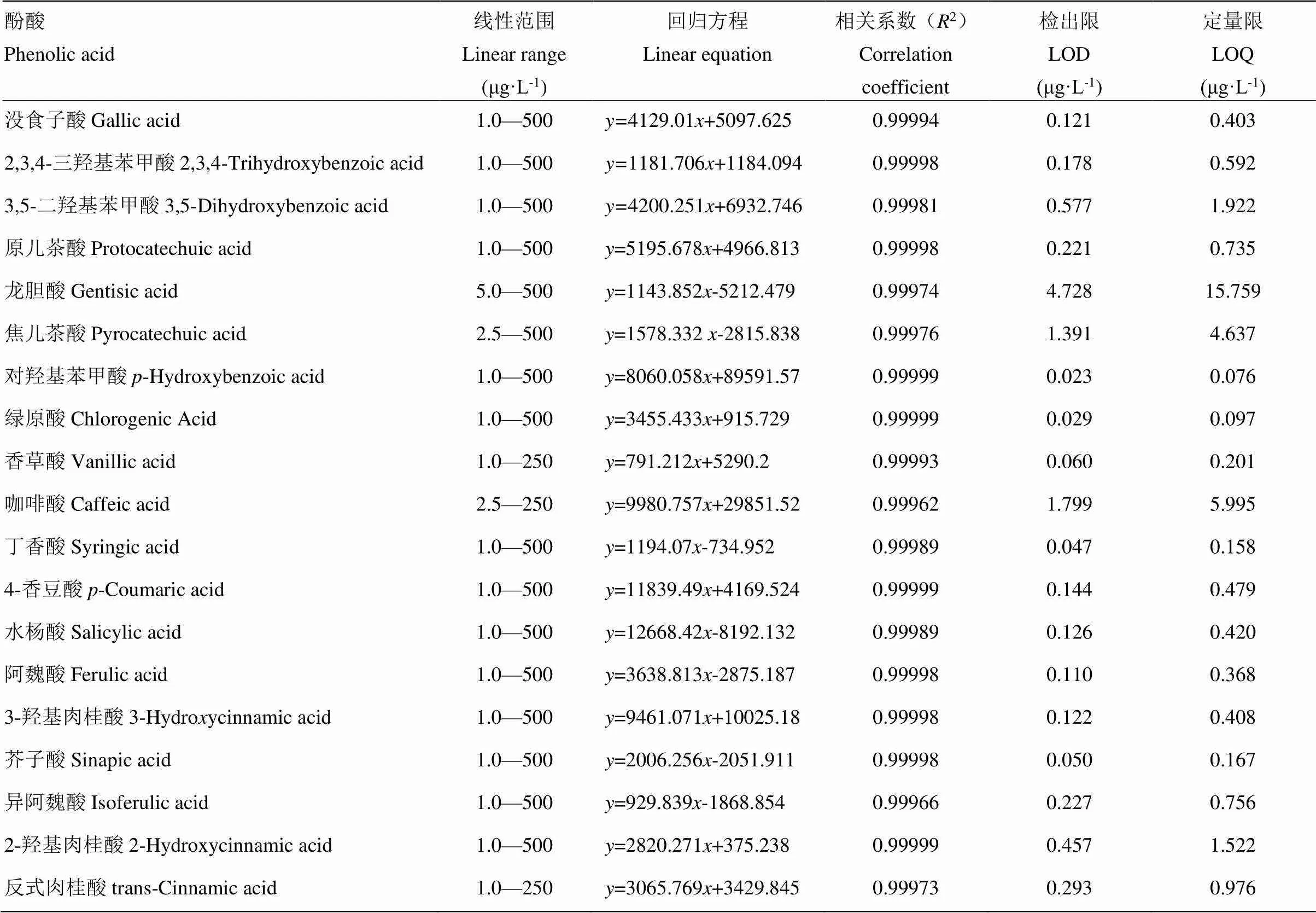
表5 19种酚酸的线性方程、相关系数、检出限和定量限
可溶性酯型酚酸:白米材料中检测到的主要酚酸种类和含量高低依次为芥子酸>阿魏酸>对羟基苯甲酸>4-香豆酸>咖啡酸>香草酸>丁香酸;红米中为芥子酸>阿魏酸>原儿茶酸>4-香豆酸>对羟基苯甲酸>咖啡酸;紫米和黑米中为原儿茶酸>香草酸>芥子酸>阿魏酸>咖啡酸>4-香豆酸>对羟基苯甲酸>丁香酸。其中所有材料的原儿茶酸的含量范围为0.00—168.73 mg·kg-1,香草酸为1.37— 107.81 mg·kg-1,芥子酸为28.22—71.36 mg·kg-1,阿魏酸17.59—49.66 mg·kg-1,对羟基苯甲酸为2.52—23.36 mg·kg-1,咖啡酸为3.27—13.08 mg·kg-1,4-香豆酸为3.51—13.01 mg·kg-1。
可溶性糖苷型酚酸:白米材料中检测到的主要酚酸种类和含量高低依次为对羟基苯甲酸>阿魏酸>水杨酸>芥子酸>香草酸>咖啡酸>4-香豆酸;红米中为对羟基苯甲酸>阿魏酸>水杨酸>香草酸>芥子酸>咖啡酸>原儿茶酸;紫米和黑米中为香草酸>原儿茶酸>对羟基苯甲酸>阿魏酸>水杨酸>咖啡酸。所有材料中对羟基苯甲酸的含量范围为5.72—52.23 mg·kg-1,香草酸为2.52—23.96 mg·kg-1,原儿茶酸为0.00—23.08 mg·kg-1,阿魏酸4.78—12.95 mg·kg-1。
不溶性结合型酚酸:白米材料中检测到的主要酚酸种类和含量高低依次为阿魏酸>4-香豆酸>咖啡酸>芥子酸>对羟基苯甲酸;红米中为阿魏酸>4-香豆酸>原儿茶酸>芥子酸>咖啡酸;紫米和黑米中为阿魏酸>原儿茶酸>香草酸>4-香豆酸>咖啡酸>芥子酸>对羟基苯甲酸。所有材料中原儿茶酸的含量范围为0.00—280.32 mg·kg-1,阿魏酸152.52—274.44 mg·kg-1,香草酸为0.69—139.94 mg·kg-1,4-香豆酸为17.71—91.74 mg·kg-1。
不溶性糖苷型酚酸:白米材料中检测到的主要酚酸种类和含量高低依次为阿魏酸>对羟基苯甲酸>香草酸>4-香豆酸>水杨酸>芥子酸;红米中为阿魏酸>对羟基苯甲酸>原儿茶酸>4-香豆酸>香草酸;紫米和黑米中为原儿茶酸>香草酸>阿魏酸>对羟基苯甲酸。其中所有材料的原儿茶酸的含量范围为0.00—24.32 mg·kg-1,香草酸为0.81—10.72 mg·kg-1,对羟基苯甲酸为0.99—6.10 mg·kg-1,阿魏酸3.16—5.21 mg·kg-1。
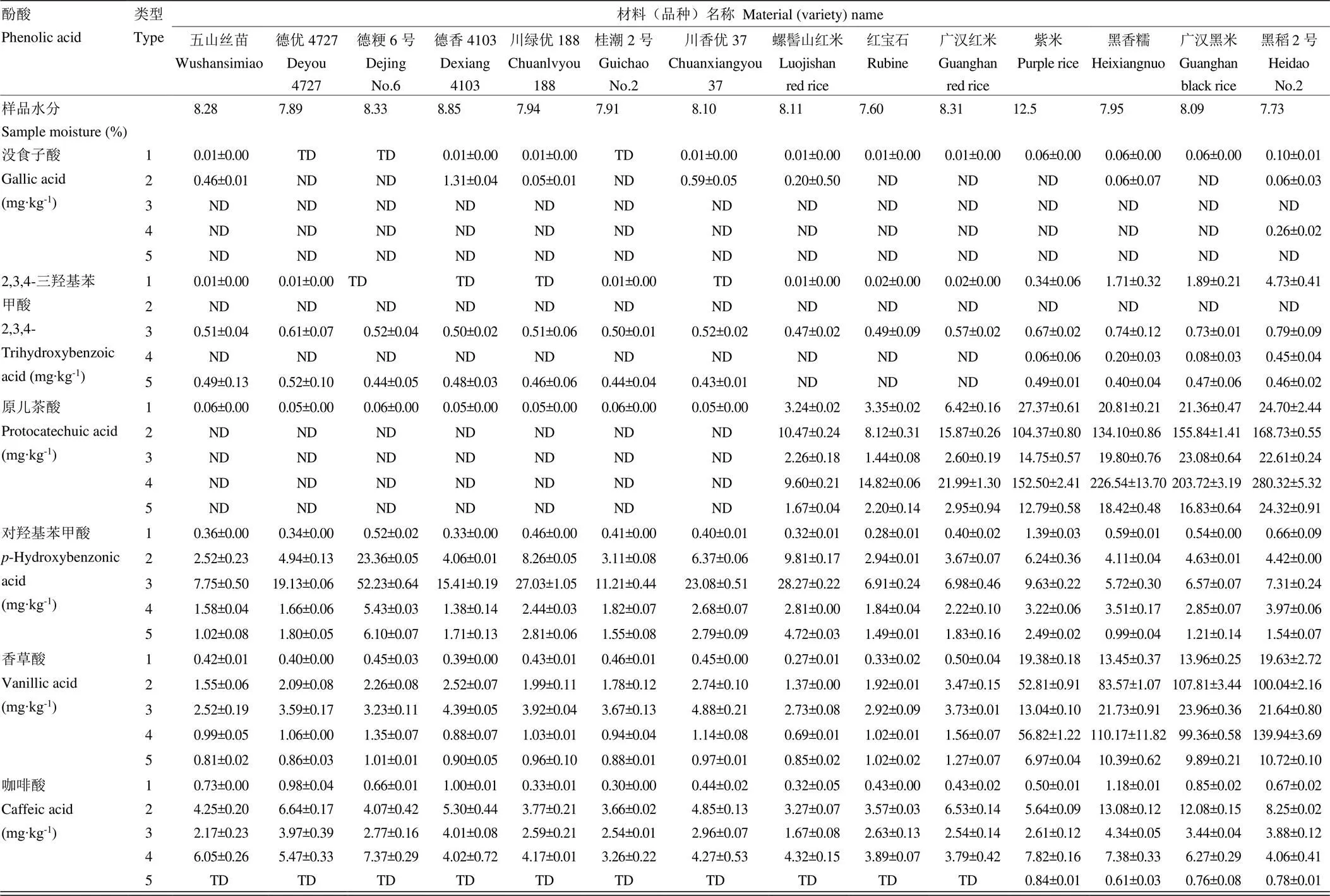
表6 四川稻米样品中不同类型酚酸的含量及分布情况(n=3)
续表6 Continued table 6
TD:有检出,但低于定量限;ND:未检出;1:游离型;2:可溶性酯型;3:可溶性糖苷型;4:不溶性结合型;5:不溶性糖苷型
TD: it is detected but below the LOQ; ND: not detected; 1: free type; 2: soluble esters; 3: soluble glycosides; 4: insoluble bound complexes; 5: insoluble glycosides
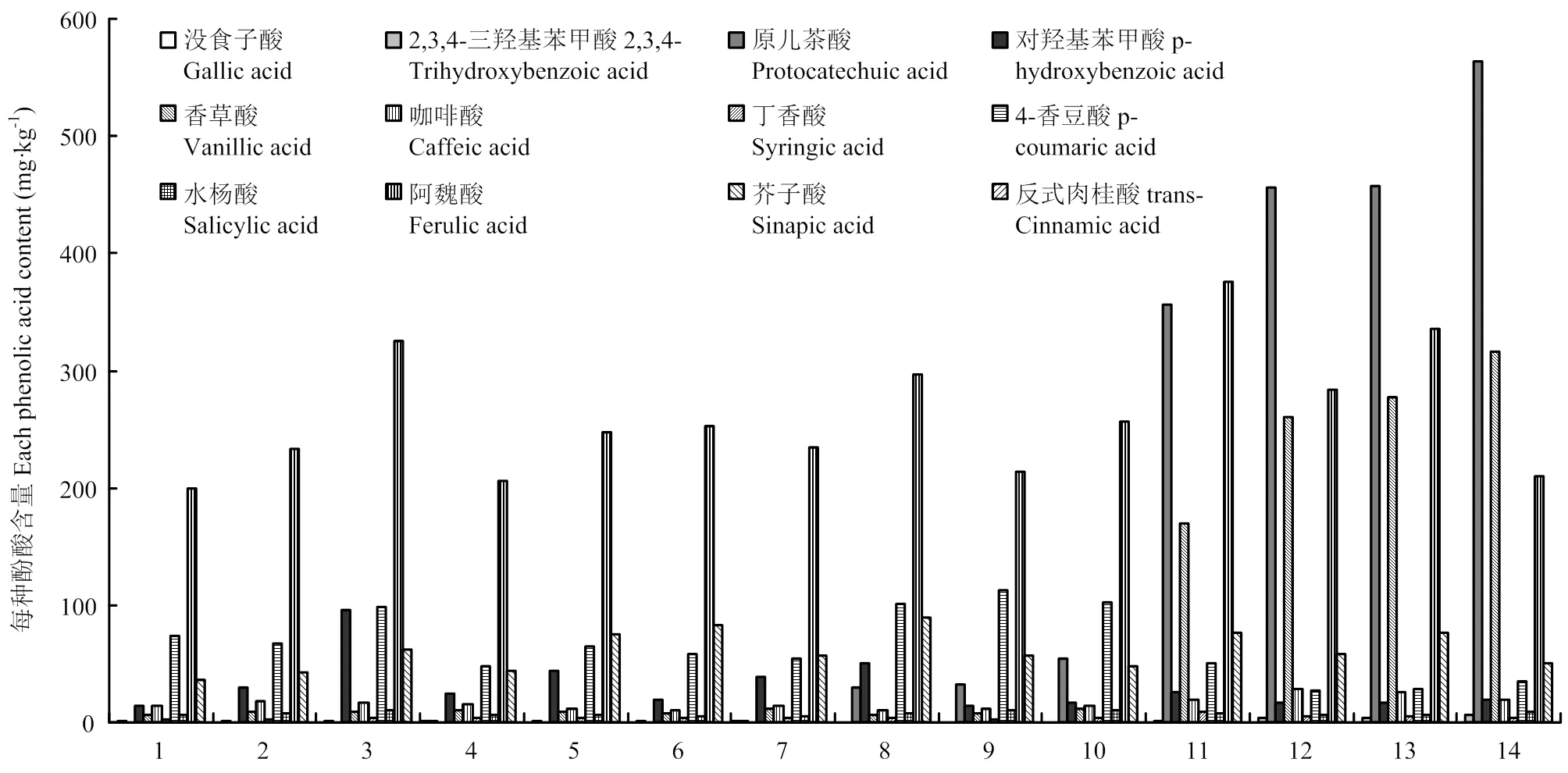
2.4.2不同酚酸在四川稻米材料中的分布情况 通过分析发现,四川稻米中存在含量较高的酚酸有阿魏酸、原儿茶酸、香草酸、4-香豆酸、芥子酸、对羟基苯甲酸和咖啡酸,其中原儿茶酸和香草酸主要存在于有色稻米中,特别是在紫米和黑米中含量最高(图4)。
在白米材料中,阿魏酸的总含量(以干基计)为200.2—325.0 mg·kg-1,占该材料酚酸总含量的52.4%— 57.1%;4-香豆酸总含量为48.4—98.0 mg·kg-1,占12.9%—20.6%;芥子酸总含量为36.3—83.3 mg·kg-1,占9.9%—18.8%;对羟基苯甲酸总含量为14.4—95.6 mg·kg-1,占4.0%—15.4%。在红米材料中,阿魏酸的总含量为213.2—296.7 mg·kg-1,占总量的百分比为46.1%—49.8%;4-香豆酸总含量为100.7—112.4 mg·kg-1,占16.9%—24.3%;芥子酸总含量为48.2—89.1 mg·kg-1,占9.3%—15.0%;原儿茶酸总含量为29.6—54.3 mg·kg-1,占5.0%—10.5%。在紫米和黑米材料中,原儿茶酸总含量为356.3—564.3 mg·kg-1,占总量的百分比为32.6%—45.7%;阿魏酸的总含量为209.7—376.0 mg·kg-1,占17.0%—34.4%;香草酸总含量为170.3—316.4 mg·kg-1,占15.6%—25.6%;芥子酸总含量为50.3—76.4 mg·kg-1,占4.1%—7.0%。
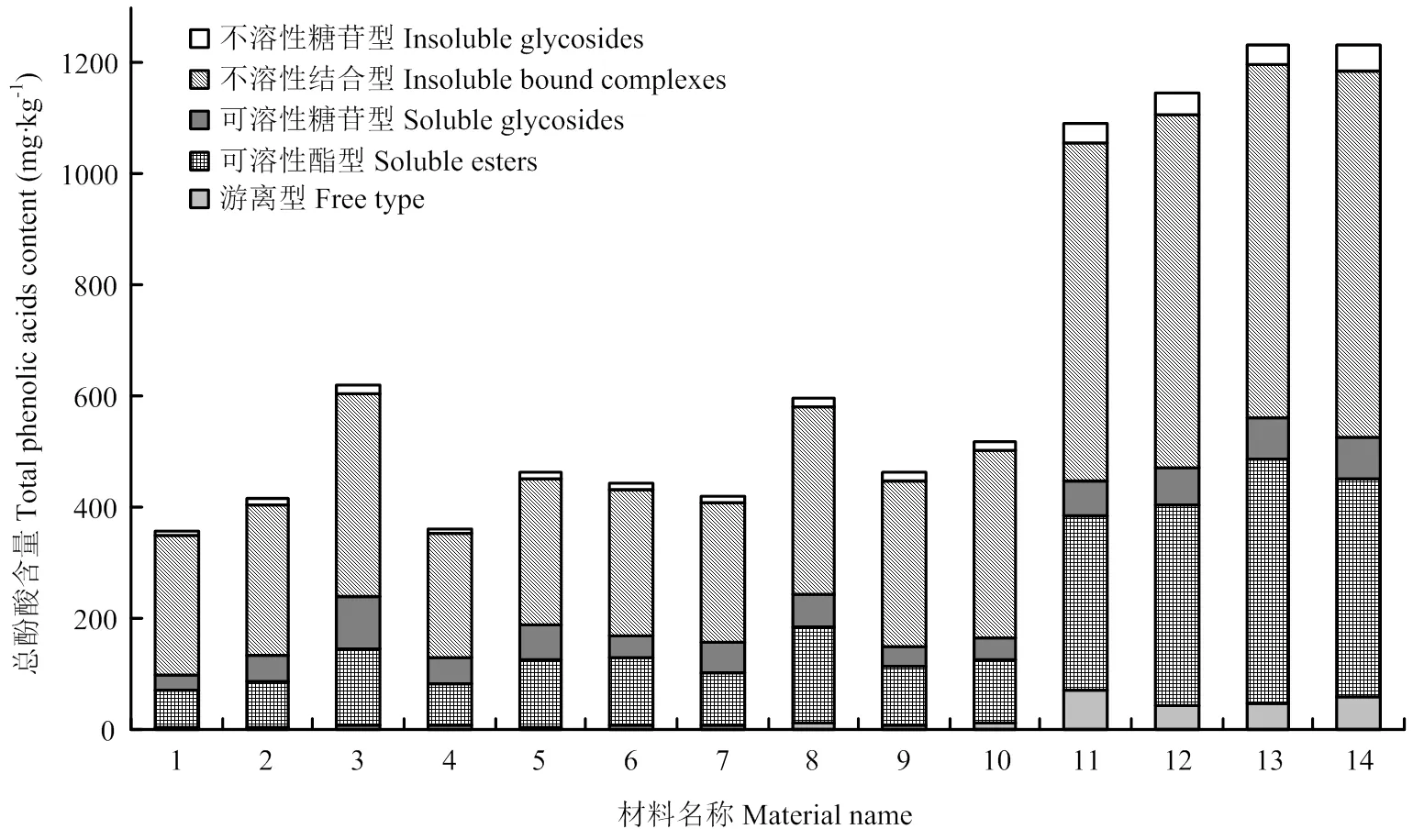
2.4.3 稻米材料中不同类型酚酸的含量及分布情况 从不同材料的所有酚酸总量来看(以干基计,图5),含量由高到低依次是:黑米>红米>白米,白米的酚酸总含量为356.3—620.6 mg·kg-1,含量最高的材料是德粳6号;红米的酚酸总含量为462.4— 595.6 mg·kg-1,含量最高的材料是螺髻山红米;紫米、黑米的范围为1 093.5—1 234.5 mg·kg-1,含量最高的材料是广汉黑米。从总量组成来看(图5),白米和红米的5种类型酚酸含量高低依次为:不溶性结合型>可溶性酯型>可溶性糖苷型>不溶性糖苷型>游离型;紫米和黑米酚酸含量由高到低依次为:不溶性结合型>可溶性酯型>可溶性糖苷型>游离型>不溶性糖苷型。所有材料中,不溶性结合型酚酸的总含量为222.2—662.3 mg·kg-1,占其酚酸总含量的百分比为51.4%—69.7%;可溶性酯型为66.0—440.1 mg·kg-1,占19.2%—35.6%;可溶性糖苷型为28.6—95.1 mg·kg-1,占5.7%—15.3%;游离型为5.1—72.3 mg·kg-1,占1.2%—6.6%;不溶性糖苷为8.3—46.3 mg·kg-1,占2.1%—3.7%。
1:五山丝苗,2:德优4727,3:德粳6号,4:德香4103,5:川绿优188,6:桂潮2号,7:川香优37,8:螺髻山红米,9:红宝石,10:广汉红米,11:紫米,12:黑香糯,13:广汉黑米,14:黑稻2号
1:五山丝苗,2:德优4727,3:德粳6号,4:德香4103,5:川绿优188,6:桂潮2号,7:川香优37,8:螺髻山红米,9:红宝石,10:广汉红米,11:紫米,12:黑香糯,13:广汉黑米,14:黑稻2号
3 讨论
3.1 稻米中酚酸提取方法及其优化
酚酸在植物中以不同形式存在,如游离酚酸、酯型、糖苷型和结合型。这些复杂的存在形式导致酚酸类化合物的含量在不同提取条件和不同降解敏感性下产生不同的结果[25]。因此,为了在植物酚酸测定中找到有效产生和不断降解之间相对折衷的方法,主要通过设计提取过程,有序地、系统地释放酚酸各种存在形式来实现。目前典型的提取步骤是首先使用含水有机溶剂萃取可溶性或可萃取的酚酸(游离、可溶性酯和可溶性糖苷),再使用碱水解、酸水解或两者同时进行来释放结合的酚酸[25,38-39]。另外,酶水解如-淀粉酶和纤维素酶也被用于酚酸的水解[40]。本研究选择先进行碱水解,再进行酸水解的方法来测定稻米样品中的酚酸,可溶性和不可溶性酚酸分别进行水解,能更全面、准确地获得稻米中酚酸的组成和分布情况。鉴于糙米中酯型和结合型酚酸的含量较高,以及UPLC-MS/MS高灵敏度的特点,使用较小的样品量进行分析有助于准确定量,同时节约试剂且环保。以往研究表明[37,41-42],酚酸水解过程会产生不同程度的损失。本研究通过对比不同碱水解条件,发现在未加保护剂的情况下,没食子酸、原儿茶酸、2,3,4-三羟基苯甲酸、龙胆酸、咖啡酸和芥子酸降解明显,而在提取过程中加入抗坏血酸和EDTA能有效防止酚酸的降解,这一结果与NARDINI等[37]的研究一致。目前国内报道的酚酸类化合物的碱水解大部分都是采用2—4 mol·L-1NaOH溶液充氮水解[33-34,43],其中张娜等[34]和邵雅芳[43]在稻米结合型酚酸的测定结果中都未检测到咖啡酸,可能与咖啡酸在水解过程中的降解有关。本方法中有多步去溶剂的过程,旋转蒸发仪和氮吹是最常用的去溶剂方法,糙米样品含有大量的干扰物质,使用旋转蒸发仪去溶剂时样品溶液容易发生爆沸,特别是在有色米样品中,因此在稻米酚酸样品的制备中最好使用氮吹仪。马帅等[33]分离了23种酚酸类化合物的梯度洗脱时间不到10 min,本研究中的梯度洗脱时间为15 min,这是由于测定时发现异阿魏酸的离子色谱峰处存在干扰峰,且响应较高,影响目标化合物的定性与定量,因此调整了梯度洗脱条件,使异阿魏酸分离度达到了要求(图2)。
3.2 稻米中酚酸分布与影响因素
本研究测定的14个稻米中酚酸的含量范围为356.3—1 234.5 mg·kg-1,不同材料间差异明显,其中紫米和黑米中酚酸总量最高,比红米和白米高近1—1.5倍,高出的部分主要是原儿茶酸和香草酸;从酚酸组成来看,白米和红米中主要为阿魏酸、4-香豆酸和芥子酸,紫米和黑米中主要为原儿茶酸、阿魏酸和香草酸;所有种类稻米的酚酸类型主要是不溶性结合型和可溶性酯型。稻米中存在不同形式的酚酸,其含量也各不相同,不同形式酚酸的生物利用度及对健康的影响有较大的差异。BOURNE等[44-45]发现当阿魏酸以游离形式存在于番茄或啤酒中时,它会被有效地吸收。MANACH等[46]比较了几种羟基苯甲酸类酚酸在人体的生物利用度,得出没食子酸的吸收利用率较好。此外,相关研究[47-49]得出游离酚酸的吸收利用率最高,而酯型、糖苷型和结合型等形式的酚酸必须经胃肠道中的酶和大肠菌群水解后才能被吸收,吸收效率降低。因此,稻米中的酚酸不能完全被生物吸收利用,它们对健康的影响取决于各自的摄入量及生物利用度。DING等[20]认为忽略种植环境的影响,粳稻的酚酸含量显著高于籼稻。
本研究中只有一个粳稻品种即德粳6号,但在所有白米材料中其酚酸总含量最高,这与DING等[20]的结果一致,得出有可能粳稻的酚酸普遍高于籼稻。本研究发现白米、红米和黑米材料中酚酸的组成和含量都存在差异。GOUFO等[4]通过总结316篇文章,综述了水稻抗氧化物质相关的研究内容,并构建了相关成分数据库,酚酸部分列出水稻中鉴定的12种酚酸,包括没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、对香豆酸、绿原酸、咖啡酸、芥子酸、阿魏酸、肉桂酸、鞣花酸(只在稻壳中存在),并提出其含量取决于米粒的颜色;SHAO等[19]研究了15种不同颜色的全谷粒中酚酸类物质,通过相关性分析发现,可溶性共轭酚酸与颜色参数相关,并认为米粒的着色可能与可溶性共轭酚类物质相关;SUMCZYNSKI等[50]分析了黑米和红米中游离型和结合型的酚类组分,发现黑米中的主要游离酚类物质是阿魏酸、原儿茶酸和反式香豆酸,而红米中的主要游离酚类是儿茶素、原儿茶酸和咖啡酸。黑米中的主要结合酚类是阿魏酸、香草酸和槲皮素,红米中主要是阿魏酸、丁香酸、反式香豆酸和槲皮素。综上,推测水稻中酚类物质的含量与品种和籽粒颜色有关。另外,研究证实精米中的酚酸类物质含量明显低于糙米[16,34]。LIU等[51]对粳稻和籼稻碾磨度与其游离和结合酚类含量之间的关系进行了研究,发现随着碾磨度的增加,9种酚类化合物的含量显著降低,包括槲皮素、阿魏酸和香豆酸。BUTSAT等[52]分析了泰国水稻品种中米糠、稻壳、糙米及精米中的酚酸组成,发现酚酸在水稻的不同部位分布不同,稻壳中的酚酸含量最高,阿魏酸在米糠中最高,而香草酸和对香豆酸主要存在于稻壳中。ZHOU等[16]发现储藏会导致糙米和精米中的总酚酸和结合酚酸的降低,且下降程度与储藏温度有关。因此,水稻中的酚酸含量与取材部位、加工程度及储藏方式等息息相关。此外,谷物中的酚类物质水平可能还取决于诸如栽培技术、水稻育种、生长条件(例如海拔和施肥)以及成熟过程等因素[53-54]。
4 结论
本研究建立了超高效液相色谱-串联质谱测定稻米中19种酚酸的方法,该方法具有准确、灵敏度高和节省溶剂的特点。在提取、净化过程中加入保护剂,大大提高了回收率。另外,在测定中增加了游离型和糖苷型酚酸的鉴定与分析,使稻米中酚酸的鉴定更加全面。
通过方法学验证,证明采用该方法测定稻米19种酚酸线性关系良好,检出限、定量限低,精密度较高,稳定性较好,方法准确度符合要求,适用于稻米中酚酸类化合物的鉴定和定量分析,同时可为其他作物该类化合物的测定提供有价值的参考。
本研究发现稻米中的酚酸组成主要有阿魏酸、原儿茶酸、香草酸、4-香豆酸、芥子酸、对羟基苯甲酸和咖啡酸,总含量范围为356.3—1 234.5 mg·kg-1,白米、红米和黑米中酚酸的组成和含量上都存在明显的差异,其中原儿茶酸和香草酸主要存在于紫米和黑米中。这些酚酸从类型划分,主要包括不溶性结合型、可溶性酯型和可溶性糖苷型酚酸等。
[1] DENG G F, XU X R, ZHANG Y, LI D, GAN R Y, LI H B. Phenolic compounds and bioactivities of pigmented rice, 2013, 53(3): 296-306.
[2] MIN B, MCCLUNG A M, CHEN M H. Phytochemicals and antioxidant capacities in rice brans of different color, 2011, 76(1): C117- C126.
[3] HUDSON E A, DINH P A, KOKUBUN T, SIMMONDS M S, GESCHER A. Characterization of potentially chemopreventive phenols in extracts of brown rice that inhibit the growth of human breast and colon cancer cells, 2000, 9(11): 1163-1170.
[4] GOUFO P, TRINDADE H. Rice antioxidants: Phenolic acids, flavonoids, anthocyanins, proanthocyanidins, tocopherols, tocotrienols, gamma-oryzanol, and phytic acid, 2014, 2(2): 75-104.
[5] FARDET A, ROCK E, RÉMÉSY C. Is theantioxidant potential of whole-grain cereals and cereal products well reflected in vivo?, 2008, 48(2): 258-276.
[6] GOUFO P, PEREIRA J, MOUTINHO PEREIRA J, CORREIA C M, FIGUEIREDO N, CARRANCA C, ROSA E A S, TRINDADE H. Rice (L.) phenolic compounds under elevated carbon dioxide (CO2) concentration, 2014, 99: 28-37.
[7] KLICK S, HERRMANN K. Glucosides and glucose esters of hydroxybenzoic acids in plants, 1988, 27(7): 2177-2180.
[8] WINTER M, HERRMANN K. Esters and glucosides of hydroxycinnamic acids in vegetables, 1986, 34(4): 616-620.
[9] ROBBINS R J. Phenolic acids in foods: An overview of analytical methodology, 2003, 51(10): 2866-2887.
[10] MORTON L W, ABU-AMSHA CACCETTA R, PUDDEY I B, CROFT K D. Chemistry and biological effects of dietary phenolic compounds: relevance to cardiovascular disease, 2000, 27(3): 152-159.
[11] GOUFO P, PEREIRA J, FIGUEIREDO N, OLIVEIRA M B P, CARRANCA C, ROSA E A, TRINDADE H. Effect of elevated carbon dioxide (CO2) on phenolic acids, flavonoids, tocopherols, tocotrienols, γ-oryzanol and antioxidant capacities of rice (L.), 2014, 59(1): 15-24.
[12] DENG G F, XU X R, GUO Y J, XIA E Q, LI S, WU S, CHEN F, LING W H, LI H B. Determination of antioxidant property and their lipophilic and hydrophilic phenolic contents in cereal grains, 2012, 4(4): 906-914.
[13] IRAKLI M N, SAMANIDOU V F, BILIADERIS C G, PAPADOYANNIS I N. Simultaneous determination of phenolic acids and flavonoids in rice using solid-phase extraction and RP-HPLC with photodiode array detection, 2012, 35(13): 1603-1611.
[14] SOMPONG R, SIEBENHANDL-EHN S, LINSBERGER-MARTIN G, BERGHOFER E. Physicochemical and antioxidative properties of red and black rice varieties from Thailand, China and Sri Lanka, 2011, 124(1): 132-140.
[15] VICHAPONG J, SOOKSERM M, SRIJESDARUK V, SWATSITANG P, SRIJARANAI S. High performance liquid chromatographic analysis of phenolic compounds and their antioxidant activities in rice varieties, 2010, 43(9): 1325-1330.
[16] ZHOU Z K, ROBARDS K, HELLIWELL S, BLANCHARD C. The distribution of phenolic acids in rice, 2004, 87(3): 401-406.
[17] TIAN S, NAKAMURA K, KAYAHARA H. Analysis of phenolic compounds in white rice, brown rice, and germinated brown rice, 2004, 52(15): 4808-4813.
[18] HARUKAZE A, MURATA M, HOMMA S. Analyses of free and bound phenolics in rice, 1999, 5(1): 74-79.
[19] SHAO Y F, HU Z Q, YU Y H, MOU R X, ZHU Z W, BETA T. Phenolic acids, anthocyanins, proanthocyanidins, antioxidant activity, minerals and their correlations in non-pigmented, red, and black rice, 2018, 239: 733-741.
[20] DING C, LIU Q, LI P, PEI Y S, TAO T T, WANG Y, YAN W, YANG G F, SHAO X L. Distribution and quantitative analysis of phenolic compounds in fractions ofandrice, 2019, 274: 384-391.
[21] 周虹. 四川省水稻产业现状及发展对策. 四川农业科技, 2015(9): 46-48.
ZHOU H. Current status and development countermeasures of rice industry in sichuan province., 2015(9): 46-48. (in chinese)
[22] BUNEA A, ANDJELKOVIC M, SOCACIU C, BOBIS O, NEACSU M, VERH R, VAN CAMP J. Total and individual carotenoids and phenolic acids content in fresh, refrigerated and processed spinach (L.), 2008, 108(2): 649-656.
[23] ESCARPA A, GONZÁLEZ M C. Approach to the content of total extractable phenolic compounds from different food samples by comparison of chromatographic and spectrophotometric methods, 2001, 427(1): 119-127.
[24] GRANATO D, SHAHIDI F, WROLSTAD R, KILMARTIN P, MELTON L D, HIDALGO F J, MIYASHITA K, VAN CAMP J, ALASALVAR C, ISMAIL A B, ELMORE S, BIRCH G G, CHARALAMPOPOULOS D, ASTLEY S B, PEGG R, ZHOU P, FINGLAS P. Antioxidant activity, total phenolics and flavonoids contents: Should we banscreening methods?, 2018, 264: 471-475.
[25] MATTILA P, KUMPULAINEN J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection, 2002, 50(13): 3660-3667.
[26] DA SILVA PADILHA C V, MISKINIS G A, DE SOUZA M E A O, PEREIRA G E, DE OLIVEIRA D, BORDIGNON-LUIZ M T, DOS SANTOS LIMA M. Rapid determination of flavonoids and phenolic acids in grape juices and wines by RP-HPLC/DAD: Method validation and characterization of commercial products of the new Brazilian varieties of grape, 2017, 228: 106-115.
[27] JIAO Y, KILMARTIN P A, FAN M T, QUEK S Y. Assessment of phenolic contributors to antioxidant activity of new kiwifruit cultivars using cyclic voltammetry combined with HPLC, 2018, 268: 77-85.
[28] ZHANG L Q, LI Y, LIANG Y, LIANG K H, ZHANG F, XU T, WANG M M, SONG H X, LIU X J, LU B Y. Determination of phenolic acid profiles by HPLC-MS in vegetables commonly consumed in China, 2019, 276: 538-546.
[29] PÉREZ-NAVARRO J, IZQUIERDO-CAÑAS P M, MENA-MORALES A, MARTÍNEZ-GASCUEÑA J, CHACÓN-VOZMEDIANO J L, GARCÍA-ROMERO E, HERMOSÍN-GUTIÉRREZ I, GÓMEZ- ALONSO S. Phenolic compounds profile of different berry parts from novelL. red grape genotypes and Tempranillo using HPLC-DAD-ESI-MS/MS: A varietal differentiation tool, 2019, 295: 350-360.
[30] GRUZ J, NOVÁK O, STRNAD M. Rapid analysis of phenolic acids in beverages by UPLC-MS/MS, 2008, 111(3): 789-794.
[31] THOMAS M, BADR A, DESJARDINS Y, GOSSELIN A, ANGERS P. Characterization of industrial broccoli discards (var.) for their glucosinolate, polyphenol and flavonoid contents using UPLC MS/MS and spectrophotometric methods, 2018, 245: 1204-1211.
[32] GAO Y, WANG M, JIANG N, WANG Y, FENG X Y. Use of ultra-performance liquid chromatography–tandem mass spectrometry on sweet cherries to determine phenolic compounds in peel and flesh, 2019,99(7): 3555-3562.
[33] 马帅, 王纪华, 高媛, 王蒙, 冯晓元. 超高效液相色谱-串联质谱法同时测定5个产地花椰菜和西兰花中的23种酚酸类化合物食品科学, 2018, 39(4): 176-187.
MA S, WANG J H, GAO Y, WANG M, FENG X Y. Simultaneous determination of twenty-three phenolic acids in cauliflower (L. var.L.) and broccoli (L. var.) from five producing places by ultra performance liquid chromatography- tandem mass spectrometry., 2018, 39(4): 176-187. (in Chinese)
[34] 张娜, 王国祥, Abacar Jose Daniel, 刘正辉, 丁承强, 唐设, 李刚华, 王绍华, 丁艳锋. 超高效液相色谱法分析稻米酚酸化合物组分及其含量. 中国农业科学, 2015, 48(9): 1718-1726.
ZHANG N, WANG G X, Abacar J D, LIU Z H, DING C Q,TANG S, LI G H, WANG S H, DING Y F. Determination of phenolic acids in rice by ultra-high performance liquid chromatography., 2015, 48(9): 1718-1726. (in chinese)
[35] AYAZ F A, HAYIRLIOGLU-AYAZ S, GRUZ J, NOVAK O, STRNAD M. Separation, characterization, and quantitation of phenolic acids in a little-known blueberry (L.) fruit by HPLC-MS, 2005, 53(21): 8116-8122.
[36] XU G H, YE X Q, LIU D H, MA Y Q, CHEN J C. Composition and distribution of phenolic acids in Ponkan (Hort. ex Tanaka) and Huyou (Macf. Changshanhuyou) during maturity, 2008, 21(5): 382-389.
[37] NARDINI M, CIRILLO E, NATELLA F, MENCARELLI D, COMISSO A, SCACCINI C. Detection of bound phenolic acids: Prevention by ascorbic acid and ethylenediaminetetraacetic acid of degradation of phenolic acids during alkaline hydrolysis, 2002, 79(1): 119-124.
[38] ESCARPA A, GONZÁLEZ M C. Total extractable phenolic chromatographic index: An overview of the phenolic class contents from different sources of foods, 2001, 212(4): 439-444.
[39] JULKUNEN-TIITTO R. Phenolic constituents in the leaves of northern willows: Methods for the analysis of certain phenolics, 1985, 33(2): 213-217.
[40] YU J, VASANTHAN T, TEMELLI F. Analysis of phenolic acids in barley by high-performance liquid chromatography, 2001, 49(9): 4352-4358.
[41] KRYGIER K, SOSULSKI F, HOGGE L. Free, esterified, and insoluble-bound phenolic acids. 1. Extraction and purification procedure, 1982, 30(2): 330-334.
[42] MAILLARD M N, BERSET C. Evolution of antioxidant activity during kilning: role of insoluble bound phenolic acids of barley and malt, 1995, 43(7): 1789-1793.
[43] 邵雅芳. 稻米酚类化合物的鉴定、分布、遗传与相关基因的表达研究[D]. 杭州: 浙江大学, 2014.
Shao Y F. Polyphenols in rice (L.): Identification, distribution, genetics and gene expression [D]. Hangzhou: Zhejiang University, 2014. (in chinese)
[44] BOURNE L C, RICE-EVANS C. Bioavailability of ferulic acid., 1998, 253(2): 222-227.
[45] BOURNE L, PAGANGA G, BAXTER D, HUGHES P, RICE-EVANs C. Absorption of ferulic acid from low-alcohol beer., 2000, 32(3): 273-280.
[46] MANACH C, WILLIAMSON G, MORAND C, SCALBERT A, RÉMÉSY C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies., 2005, 81(1): 230S-242S.
[47] MANACH C, SCALBERT A, MORAND C, RÉMÉSY C, JIMENEZ L. Polyphenols: Food sources and bioavailability., 2004, 79(5): 727-747.
[48] ZHAO Z H, EGASHIRA Y, SANADA H. Ferulic acid sugar esters are recovered in rat plasma and urine mainly as the sulfoglucuronide of ferulic acid., 2003, 133(5): 1355-1361.
[49] ADAM A, CRESPY V, LEVRAT-VERNY M A, LEENHARDT F, LEUILLET M, DEMIGNÉ C, RÉMÉSY C. The bioavailability of ferulic acid is governed primarily by the food matrix rather than its metabolism in intestine and liver in rats., 2002, 132(7): 1962-1968.
[50] SUMCZYNSKI D, KOTÁSKOVÁ E, DRUŽBÍKOVÁ H, MLČEK J. Determination of contents and antioxidant activity of free and bound phenolics compounds and in vitro digestibility of commercial black and red rice (L.) varieties, 2016, 211: 339-346.
[51] LIU L, GUO J J, ZHANG R F, WEI Z C, DENG Y Y, GUO J X, ZHANG M W. Effect of degree of milling on phenolic profiles and cellular antioxidant activity of whole brown rice, 2015, 185: 318-325.
[52] BUTSAT S, SIRIAMORNPUN S. Antioxidant capacities and phenolic compounds of the husk, bran and endosperm of Thai rice, 2010, 119(2): 606-613.
[53] MIN B, GU L W, MCCLUNG A M, BERGMAN C J, CHEN M H. Free and bound total phenolic concentrations, antioxidant capacities, and profiles of proanthocyanidins and anthocyanins in whole grain rice (L.) of different bran colours, 2012, 133(3): 715-722.
[54] NACZK M, SHAHIDI F. Phenolics in cereals, fruits and vegetables: Occurrence, extraction and analysis, 2006, 41(5): 1523-1542.
Identification and Analysis of Phenolic Acids in Rice Using Ultra-High Performance Liquid Chromatography-Tandem Mass Spectrometry
ZHAO Shan1, ZHONG LingLi1, ZHOU Hong1, LI Xi1, LEI XinYu1, HUANG ShiQun1, ZHENG XingGuo1, FENG JunYan2, LEI ShaoRong1, GUO LingAn1
(1Center of Analysis and Testing, Sichuan Academy of Agricultural Sciences/Risk Assessment Laboratory of Agricultural Products Quality and Safety (Chengdu), Ministry of Agriculture, Chengdu 610066;2Institute of Biotechnology and Nuclear Technology, Sichuan Academy of Agricultural Sciences, Chengdu 610061)
【Objective】 Rice is one of the most important crops in the world, and it is also an important source of phenolic acids in people’s diet. To further understand and explore the functional nutrition of rice, an ultra-high performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS) method was established for identification and analysis of rice phenolic acids in the present study. 【Method】The qualitative and quantitative analysis of 19 phenolic acids in 14 samples of white rice, red rice, purple rice and black rice from Sichuan province, was carried out by UPLC-MS/MS. The pretreatment conditions, including alkali hydrolysis, acid hydrolysis and purification extraction, were optimized, besides, the chromatographic column, mobile phase condition and mass spectrometry conditions were optimized too. Furthermore, all detection was carried out by electrospray ionization and multi reaction monitoring mode. Finally, the content of free ester, soluble ester, soluble glycoside, insoluble binding andinsoluble glycoside phenolic acid in brown rice samples was determined by using the optimized analytical method.【Result】The optimal conditions were obtained through the comparison and optimization of the pre-treatment conditions. It was as follows: alkaline hydrolysis was 4 hours at the concentration of 1% ascorbic acid and 10 mmol·L-1EDTA, and acid hydrolysis was 1 hour at the concentration of 1 mol·L-1HCl; all purification and extraction were carried out with ethylacetate containing 0.2% BHA; HSS T3 column was used, acetonitrile-0.01% formic acid aqueous solution was used as mobile phase for gradient elution; except trans-cinnamic acid adopts positive ion mode, the rest were negative ion mode. The compounds had good peak shape, high resolution and sensitivity. The linear range of 19 phenolic acids was good (2≥0.9997), the detection limit was 0.023-4.728 μg·L-1, and the quantitative limit was 0.076-15.759 μg·L-1. Recoveries of 19 phenolic acids in direct extraction were 55.3%-98.0%. Recoveries of 18 phenolic acids (except chlorogenic acid) in alkali hydrolysis and acid hydrolysis were 90.8%-103.1% and 51.7%-100.3%, respectively. In total, there were 14 phenolic acids in 14 rice samples determined using this method, 12 of which were quantitative. The total content range of phenolic acids was 356.3-1 234.5 mg·kg-1. Ferulic acid, protocatechuic acid, vanillic acid,-coumaric acid, sinapic acid and-hydroxybenzoic acid had higher content. Protocatechuic acid and vanillic acid could be mainly found in purple rice and black rice, most of which were insoluble binding type, soluble ester type and soluble glycosidic phenolic acid. 【Conclusion】 The method obtained in this study was accurate and sensitive. The addition of protectors effectively inhibited the degradation of phenolic acid and increased the identification and quantitative analysis of free and glycosidic phenolic acid during extraction and determination. Therefore, distribution of phenolic acid could be presented more accurately and comprehensively in rice.
phenolic acids; ultra-high performance liquid chromatography; tandem mass spectrometry; rice
2019-06-27;
2019-11-20
国家农产品质量安全风险评估重大专项(GJFP201701502)、四川省财政创新工程(2017QNJJ-021,2017QNJJ-001)
赵珊,Tel:028-84504142;E-mail:zhaoshan11@126.com。通信作者郭灵安,Tel:028-84504149;E-mail:gla028@163.com
(责任编辑 赵伶俐)
