禽呼吸道7种病毒多重连接探针扩增检测技术的建立与应用
2020-02-24周莹珊王雨萌邵春艳杨永春黄保续王晓杜宋厚辉
周莹珊,陈 琳,周 柯,王雨萌,邵春艳,杨永春,黄保续,王晓杜*,宋厚辉*
(1.浙江农林大学 动物科技学院/动物医学学院 浙江省畜禽绿色生态健康养殖应用技术研究重点实验室/动物健康互联网检测技术浙江省工程实验室,浙江 杭州 311300;2.中国动物卫生与流行病学中心,山东 青岛 266032)
我国是畜禽养殖大国,禽类养殖量位居世界前列,养殖量约为120亿只[1]。H9、H5、H7亚型禽流感及新城疫、禽偏肺病毒病、传染性支气管炎和传染性喉气管炎是严重危害我国禽业发展的7种最重要的禽病毒性呼吸道疾病[2]。这7种病原多呈现混合感染的态势,给我国的养禽业造成了较大的经济损失,并且混合感染也很难通过临床症状和病理变化对致病原因进行确诊。目前尚没有一种方法可以一次性对引起禽呼吸道疾病的这7种病毒进行鉴别检测。因此建立一种能精准快速区分不同病毒的检测方法,对于禽呼吸道疾病的预防和早期干预至关重要。
多重连接探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)最早是由SCHOUTEN等[3]于2002年首次报道,是一种结合核酸杂交和PCR扩增的高通量多重核酸检测技术。该技术在同一反应管中可对多达40个不同的靶基因进行检测分析。MLPA的基本程序包括左右探针分别与靶序列DNA杂交,连接酶连接左右探针,生成一条两端分别含有通用引物的长度唯一的全长探针,PCR扩增全长探针并对扩增产物毛细管电泳后得到数据进行分析[4]。
本研究旨在建立一种同时检测引起禽呼吸道感染的7种病毒的MLPA检测技术,为禽呼吸道病毒的鉴别诊断和应急检测提供技术储备。
1 材料与方法
1.1 临床样品和感染阳性组织122份禽鼻腔拭子样品来自浙江农林大学动物健康检测中心和中国科学院流感研究与预警中心监测网点。禽流感H9、H5、H7亚型病毒阳性组织及新城疫病毒阳性组织、禽偏肺病毒阳性组织、传染性支气管炎病毒阳性组织和传染性喉气管炎病毒阳性组织均由本实验室保存。
1.2 主要试剂MEGAscript T7试剂盒购自Ambion公司;反转录试剂盒购自TOYOBO(上海东洋纺);One Step Ahead RT-PCR Kit购自QIAGEN公司;DNA/RNA共提取试剂盒购自Tiangen生物技术有限公司;pGEM-5zf载体购自Promega公司;SALSA MLPA EK1 Reagent Kit(MRC Holland)购自厦门致善生物科技有限公司。
1.3 引物、探针的设计与合成根据GenBank收录的病毒全基因组序列,利用Geneious 8.1.4软件进行序列比对寻找高度保守区域的基因。用Primer3进行引物设计(表1),用于特异性反转录和预扩增,这些引物扩增的片段包含MLPA探针结合的区域。探针设计参照Designing synthetic MLPA probes,Version 15(www.mlpa.com)。探针分别结合AIV H9、H5、H7亚型的HA基因及NDV的M基因、aMPV的N基因、IBV的M基因中、ILTV的糖蛋白C(Glycoprotein C)基因高度保守区域(表2)。左侧探针(left probe,LP)由两段核苷酸组成,一段是用于PCR扩增的通用序列,另一段是病毒特异性序列(left hybridising sequence,LHS);右侧探针(right probe,RP)由两段核苷酸组成,一段是病毒特异性序列(right hybridising sequence,RHS),另一段是用于PCR扩增的通用序列,右侧探针的5′端进行磷酸化处理。通过设计不同长度的探针区分不同病原。引物和探针均由金唯智(苏州)生物有限公司合成。

表1 反转录和预扩增引物名称和序列

表2 MLPA探针针对的靶基因及左侧探针和右侧探针序列
1.4 阳性质粒和体外转录RNA的制备将AIV H9、H5和H7亚型及NDV、aMPV、IBV、ILTV的靶基因经PCR扩增纯化回收后的目的片段克隆至pGEM-5zf载体,并转化DH5α感受态细胞得到重组菌,PCR鉴定阳性的菌液经测序正确后获得阳性重组质粒。将包含AIV H9、H5和H7亚型及NDV、aMPV、IBV核酸的重组质粒线性化之后,用Ambion公司的MEGAscript T7试剂盒进行体外转录。将体外转录产物用LiCl沉淀,70%乙醇洗涤后溶于无RNase的ddH2O中,核酸电泳检测RNA合成的完整性和正确性,并测定RNA浓度。
1.5 样品核酸的提取和cDNA的制备用DNA/RNA共提取试剂盒提取样品中的DNA和RNA,得到100 μL样品。按照One Step Ahead RT-PCR Kit说明书进行一步法反转录RT-PCR反应。反应条件:50℃ 10 min;95℃ 5 min;95℃ 15 s,57℃ 20 s,72℃ 20 s,30个循环;72℃ 2 min。
1.6 MLPA反应MLPA反应程序严格按照SALSA MLPA EK1 Reagent试剂盒说明书进行。每管加入1.5提取中DNA 1 μL和4 μL TE溶液,98℃变性5 min,降至室温25℃。再加入1.5 μL MLPA缓冲液和1.5 μL探针混合液(每条探针终浓度为1.33 nmol/L),95℃温育1 min,60℃杂交1 h,54℃温育。加入32 μL连接酶混合物,54℃温育15 min,98℃加热5 min灭活连接酶,20℃温育。室温下加入10 μL PCR混合物。进行PCR反应,反应条件:95℃ 30 s,60℃ 30 s,72℃ 60 s,35个循环;72℃孵育20 min,降至15℃。PCR扩增产物用全自动核酸分析仪(Qsep100 DNA Analyzer,BIOptic)进行分析。
1.7 特异性测试
1.7.1单一探针特异性测试 分别以AIV H9,H5和H7亚型及NDV、aMPV、IBV、ILTV病毒核酸和无病毒对照为模板进行MLPA扩增,对每种病毒探针和对应的反应体系进行特异性试验,验证不同病毒之间是否会发生交叉反应。
1.7.2混合探针特异性测试 用针对7种病毒混合的探针分别对AIV H9、H5和H7亚型及NDV、aMPV、IBV、ILTV的病毒核酸和无病毒对照为模板进行MLPA扩增。测试混合探针能否从各自的病毒核酸中扩增出单一的特异性扩增峰,验证探针混合之后是否会引起非特异性交叉反应。
1.8 灵敏度测试将上述已知浓度的AIV H9、H5和H7亚型及NDV、aMPV、IBV的RNA和ILTV的DNA溶液各进行10倍梯度稀释进行MLPA反应,分别确定其检测极限,按以下公式计算拷贝数:(Copies/μL)=(6.02×1023Copies/mol)×质量浓度(g·L-1)/MW(g·mol-1)。
1.9 临床样品的检测临床样品按照前述方法提取样品总核酸,用本研究建立的MLPA检测方法进行检测。AVI H9、H5和H7亚型及NDV、aMPV、IBV、ILTV分别用相应的国家或行业标准进行PCR检测,验证MLPA方法与现有核酸检测方法的符合率。
2 结果
2.1 探针特异性测试结果分别以AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV、ILTV的病毒核酸和无病毒对照为模板,利用相应的特异性探针进行MLPA扩增。结果显示,单一探针只能从对应病毒核酸中扩增得到特异性条带,条带大小分别为92,97,102,120,127,134,142 bp,均与预期一致(图1),表明本研究所设计的7种病毒MLPA探针及对应的反应体系特异性良好,都只能检测出对应的目的病毒核酸,与其他病毒核酸无交叉反应。

图1 单一探针特异性MLPA扩增结果 A.H9探针;B.H5探针;C.H7探针;D.NDV探针;E.aMPV探针;F.IBV探针;G.ILTV探针。1~7.H9、H5、H7、NDV、aMPV、IBV和ILTV模板;M.DNA标准相对分子质量;NC.阴性对照。
分别以AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV、ILTV的病毒核酸和无病毒对照为模板,用7种病毒的混合探针进行MLPA扩增。结果显示,AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV和ILTV分别在约92,97,102,120,127,134,142 bp处有特异性扩增峰,与预期相符(图2),表明7种探针混合后其特异性没有受到影响,检测某一种病毒核酸时只能扩增出单一的特异性扩增峰,无病毒对照无扩增峰。
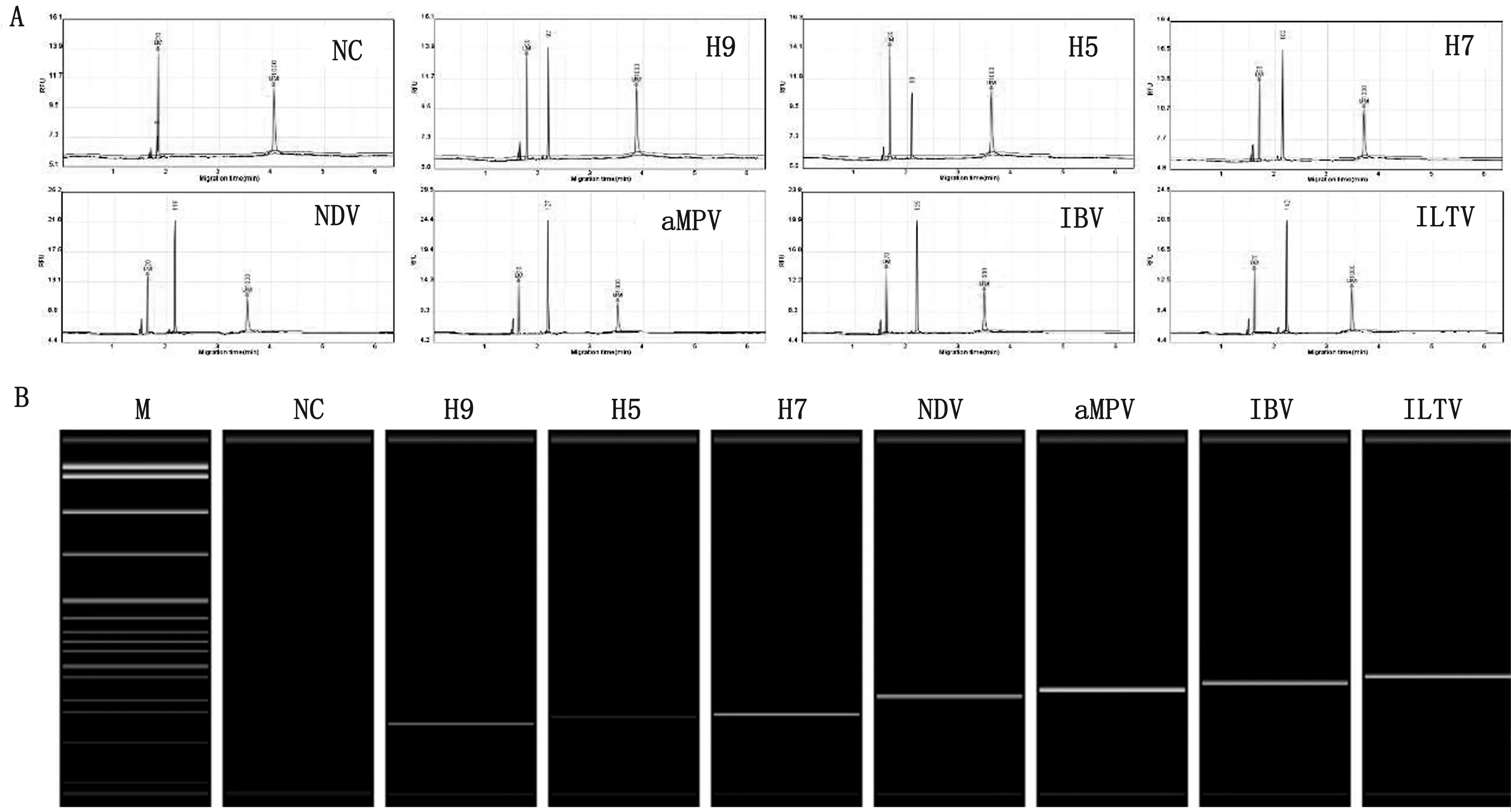
图2 混合探针特异性扩增结果 A.峰图;B.胶图
2.2 7种病毒核酸混合物的MLPA扩增结果以7种病毒混合核酸为模板进行MLPA扩增,结果显示,1个MLPA反应同时扩增出了大小约92,97,102,120,127,134,142 bp的7条特异性条带,分别对应于AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV、ILTV的基因片段,与预期扩增大小相符合(图3),表明建立的MLPA可以同时检测到模板中的这7种病毒核酸。

图3 7种病毒核酸混合物的MLPA扩增结果
2.3 灵敏度测试结果以不同稀释度的核酸作为模板进行MLPA扩增。结果显示,该方法最低检测到的AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV、ILTV 7种病毒核酸的拷贝数分别约为1.4×102,1.4×102,1.4×102,1.33×101,1.42×101,1.25×102,5.3×100拷贝/反应,表明该方法对7种病毒核酸检测灵敏度均较高。
2.4 临床样品检测结果对122份临床样品进行反转录和预扩增后进行7重MLPA扩增,结果显示,AIV H7核酸阳性检测数为2份,NDV阳性样本12份,aMPV阳性样本36份,IBV阳性样本8份,ILTV阳性样本17份,未检出H5或H9阳性样本(表3)。MLPA检测结果与国家标准检测结果一致,表明MLPA方法的特异性、敏感性较好(表4)。AIV H5和H9由于缺乏阳性样品,无法计算敏感性。
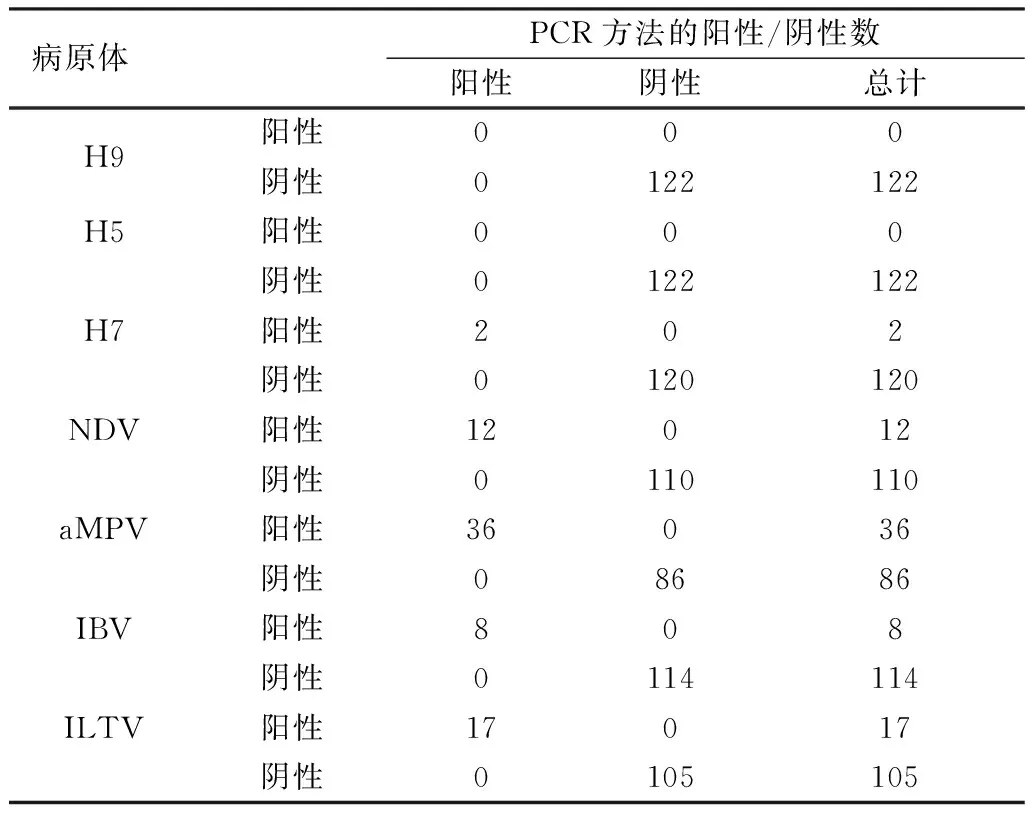
表3 122份临床病料中MLPA检测方法与 PCR检测方法的结果分析
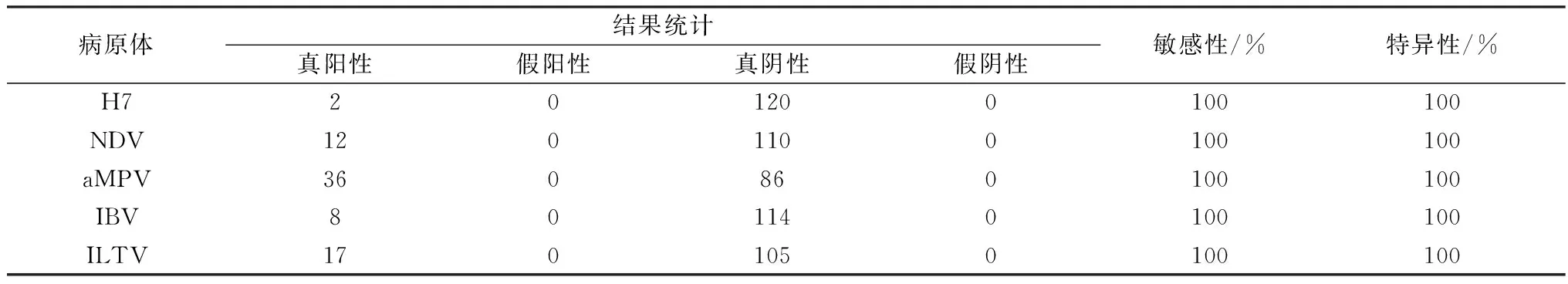
表4 与国家标准相比MLPA检测方法敏感性与特异性结果分析
3 讨 论
动物疾病多重检测技术的研究近年来已经成为动物病原学诊断、疫情监测、疫病控制领域关注的焦点。多重连接探针扩增技术已经在人类基因或基因片段的缺失或重复,染色体重排,单核苷酸多态性和点突变,基因乙酰化定量中得到广泛应用[5-6],但是在病毒检测尤其是动物病毒的高通量检测中应用较少[7]。
为了提高MLPA检测的灵敏度,本研究增加了反转录和预扩增过程,使得原本需要杂交16 h缩短为杂交1 h即可,极大地缩短了反应时间[8]。MLPA技术的关键是引物的设计[9]。本研究针对病毒高度保守的基因设计了7对探针,每种探针只能扩增对应的病毒片段,特异性好,不同探针之间没有交叉反应。为了易于区分不同病毒,每个病毒的核酸片段大小区分至少在5 bp以上。由于MLPA扩增的目的片段长度差距比较小,一般凝胶电泳无法区分,检测结果需要进行毛细管电泳才能分离。通过设立阳性质粒对照,可以通过读取扩增片段的碱基数直接进行结果的判定[10]。
综上所述,本研究建立了一种鉴别检测AIV H9、AIV H5、AIV H7、NDV、aMPV、IBV和ILTV共7种病毒的高通量检测技术。该方法特异性强,敏感性高,具有一定的临床应用价值,可以为禽呼吸道病毒性疾病的鉴别诊断和流行病学监测提供技术支持。
