转染沉默IGFBP-2基因抑制食管癌细胞系TE-1增殖、转移的影响
2020-02-24李雪曼陈天佑
张 倬,熊 飞,李雪曼,陈天佑
(武汉市第三医院胸外科,湖北 武汉 430000)
胰岛素样生长因子结合蛋白2(IGFBP-2,insulin-like growth factor binding protein-2)是胰岛素样生长因子家族中非常重要的一员[1]。在已知研究成果中,IGFBP-2在多种常见恶性肿瘤细胞中有一定水平的表达,可以调控染色质结构和转录序列,影响与肿瘤发生、侵袭、转移相关的基因转录,进而促进肿瘤的转移[2-3]。关于IGFBP-2基因的表达变化对食管癌的发生发展是否具有一定的影响及其具体作用机制,目前国内外文献尚无报道。目前,RNA干扰(RNAi)技术已经被证实为是一种非常有效的基因治疗手段,其主要是通过特异性的沉默目的基因而发挥一定的作用[3]。研究主要应用RNAi技术将食管癌TE-1细胞株中IGFBP-2基因沉默,观察IGFBP-2蛋白表达变化与食管癌细胞增殖侵袭及凋亡的关系,探索IGFBP-2基因在食管癌中的作用,为日后寻找治疗食管癌新药物提供新的干预靶点和理论依据。
1 材料与方法
1.1 实验材料
食管癌TE-1细胞株购买于上海生命科学研究院细胞资源中心。重组质粒来源于上海闪晶生物技术有限公司,其携带有绿色荧光蛋白的标记基因,由上海闪晶生物技术有限公司进行引物设计、合成以及测序。主要试剂:RPMI-1640培养基、FBS、0.25%胰蛋白酶均为Hyclone公司,鼠抗人IGFBP-2抗体,羊抗鼠抗体(二抗)购于Santa cruz 公司,lipofect2000购于美国invitrogen公司。
1.2 转染并在荧光显微镜下观察
实验分为4组,分别为A组(转染IGFBP-2-SiRNA-1组)、B组(转染IGFBP-2-SiRNA-2组)、C组(转染空质粒组)以及D组(空白对照组)。在转染前24 h,先用0.25%胰蛋白酶将培养皿中处于对数生长期的TE-1细胞消化成细胞悬液,以每孔2×105接种于6孔板,待细胞长满至90%时开始转染。转染时,加入250 μL RPMI-1640培养基稀释IGFBP-2-SiRNA 质粒。与此同时,用250 μL RPMI-1640培养基稀释10 μL Lipofectamine 2000脂质体,轻轻吹打混匀,室温下静置5 min。混合IGFBP-2-SiRNA 质粒稀释液和转染试剂Lipofectamine 2000脂质体,轻轻吹打混匀。室温下静置20 min后将孵育好的混合物加入到不含血清的6孔板中,前后轻摇6孔板混匀。将6孔板置于37 ℃、5% CO2的培养箱中培养,转染4~6 h后可更换含血清的新鲜培养基,分别在荧光显微镜下观察各组在不同时间点(12 h、24 h、36 h、72 h)转染效率。
1.3 Western blot法鉴定沉默效果
将转染后的细胞裂解并提取蛋白,测定蛋白含量,确定上样体积,根据IGFBP-2分子量大小确定制定10%聚丙烯酰胺凝胶,无水乙醇封闭分离胶,40 min后倒掉无水乙醇,超纯水清洗3次,配浓缩胶插梳子,聚合30 min后开始电泳。电泳完成后,取出凝胶浸入转膜液,PVDF膜转膜,封闭1 h后,加入稀释的一抗(1∶800),置于摇床上4 ℃孵育过夜。第二天取出条带,TBST洗涤3遍,置于离心管中与二抗常温孵育1 h,TBST洗涤3遍。配好ECL检测试剂,滴于PVDF膜上,反应1~2 min,上机检测并分析结果。
1.4 CCK-8法检测细胞增殖能力
将4组细胞制成单细胞混悬液,并计数统计。吹打均匀后接种于96孔板中,每孔约2×103个细胞,每孔体积为100 μL,共铺4个板,每板4组(分别为A、B、C、D组),每组5个孔,待细胞贴壁后,分别取出每个培养板并加入10 μL的CCK8试剂,分别检测每组不同时间点(24 h、48 h、72 h、96 h)吸光度,每孔加入10 μL试剂盒内检测液,包裹锡纸避光,常温反应2 h,测量每孔在酶标仪450 nm波长处吸光度(A)值,重复测量3次求平均值,根据检测结果绘制折线图。
1.5 Transwell检测细胞侵袭能力
转染细胞48 h,将各组细胞培养液更换为无血清的培养基,8 h后消化细胞制备成含5%血清的混悬液,密度为1×104个/mL。用50 mg/L Matrigel稀释液包被滤膜,4 ℃风干后于紫外灯下照射2 h,加入培养液,水化。将小室放入24孔培养板,小室外加15%血清1640培养液500 μL,小室内加细胞悬液200 μL,培养72 h后取出小室,用棉签擦去上层细胞,染色,荧光显微镜下观察并计数。
1.6 流式细胞仪检测细胞凋亡率
用PBS冲洗转染细胞,制备好细胞悬液离心,根据PE Annexin V Apoptosis Detection Kit Ⅰ试剂盒相关说明进行实验:用1×binding buffer重悬细胞,浓度为1×106个/mL。各组吸取100 μL,加5 μL的PE Annexin V和5 μL 7-AAD。常温避光漩涡孵化细胞15 min,每组加入400 μL的1×binding buffer,1 h内上机检测。
1.7 统计学方法
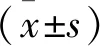
2 结果
2.1 转染结果判定
因构建的SiRNA载体含有绿色荧光蛋白,转染IGFBP-2-SiRNA-1、IGFBP-2-SiRNA-2、IGFBP-2-SiRNA-N后,若质粒成功转入TE-1细胞,则荧光显微镜可在细胞核膜及胞浆内观察到绿色荧光。转染IGFBP-2-SiRNA-1、IGFBP-2-SiRNA-2后细胞的数量明显少于转染IGFBP-2-SiRNA-N和空白对照组,这也提示我们IGFBP-2参与了细胞的分化、增殖(见图1)。
2.2 IGFBP-2-SiRNA对SATB1蛋白表达的影响
Western blot检测IGFBP-2蛋白表达水平,凝胶成像系统灰度扫描IGFBP-2条带。1为转染SiRNA-1组,2为空白对照组,3为转染SiRNA-N组,4为转染SiRNA-2组。转染IGFBP-2-SiRNA-1和IGFBP-2-SiRNA-2组与转染IGFBP-2-SiRNA-N和空白对照组相比,IGFBP-2蛋白表达量明显下降(见图2)。转染IGFBP-2-SiRNA-1和IGFBP-2-SiRNA-2组IGFBP-2/β-actin灰度值与转染IGFBP-2-SiRNA-N和空白对照组相比均降低,P<0.01(见表1)。IGFBP-2蛋白表达量明显下降,表明IGFBP-2-SiRNA-1和IGFBP-2-SiRNA-2成功转染入食管癌细胞,转染IGFBP-2-SiRNA-1和IGFBP-2-SiRNA-2能够抑制食管癌细胞IGFBP-2基因表达。
2.3 转染前后细胞增殖能力的改变
CCK8实验结果显示(见图3)转染IGFBP-2-SiRNA-1、IGFBP-2-SiRNA-2细胞的生长情况与转染IGFBP-2-SiRNA-N和空白对照组细胞相比较明显受到抑制。但转染IGFBP-2-SiRNA-N和空白对照组细胞之间以及转染IGFBP-2-SiRNA-1和IGFBP-2-SiRNA-2组细胞没有显著的区别。

图1 转染后48 h TE-1细胞绿色荧光蛋白的表达 (100×)Fig.1 Expression of green fluorescent protein of TE-1 cell after 48 h of transfection
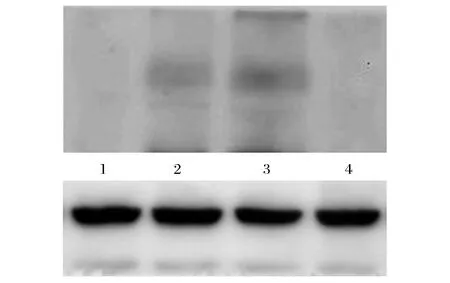
图2 Western blot测定各组细胞IGFBP-2蛋白结果Fig.2 IGFBP-2 protein in each groups of cells tested by means of Western blot
2.4 转染前后细胞侵袭能力的改变
IGFBP-2-SiRNA转染TE-1细胞后,进行基质胶涂层膜HE染色。结果表明,转染IGFBP-2-SiRNA-1组、IGFBP-2-SiRNA-2组在膜上的细胞数量少于转染IGFBP-2-SiRNA-N组和空白对照组细胞数量,差异有统计学意义(P<0.01),但转染IGFBP-2-SiRNA-N组与空白对照组细胞之间、转染IGFBP-2-SiRNA-1组与IGFBP-2-SiRNA-2组之间穿膜细胞数没有统计学差异(P>0.05),详见表2。

表1 Western blot灰度值比较
注:a表示P<0.01,与C组相比较;b表示P<0.01,与D组相比较。

图3 各组TE-1细胞的生长曲线Fig.3 Growth curves for each group of TE-1 cells
2.5 转染前后细胞凋亡改变
转染后48 h,AnnexinV 与7-AAD 双染法表示,转染IGFBP-2-SiRNA-1组、转染IGFBP-2-SiRNA-2组早期凋亡的细胞数较空白对照组、转染空质粒组细胞多(见图4)。
与空白对照组细胞相比较,转染空质粒组的细胞凋亡改变,无统计学差异(P>0.05),而转染IGFBP-2-SiRNA-1组、转染IGFBP-2-SiRNA-2组早期凋亡的细胞数较多,有统计学差异(P<0.01),详见表3。实验结果表明IGFBP-2基因对TE-1细胞的凋亡具有一定的抑制作用。

表2 各组细胞穿膜细胞数
注:a表示P<0.01,与C组相比较;b表示P<0.01,与D组相比较。
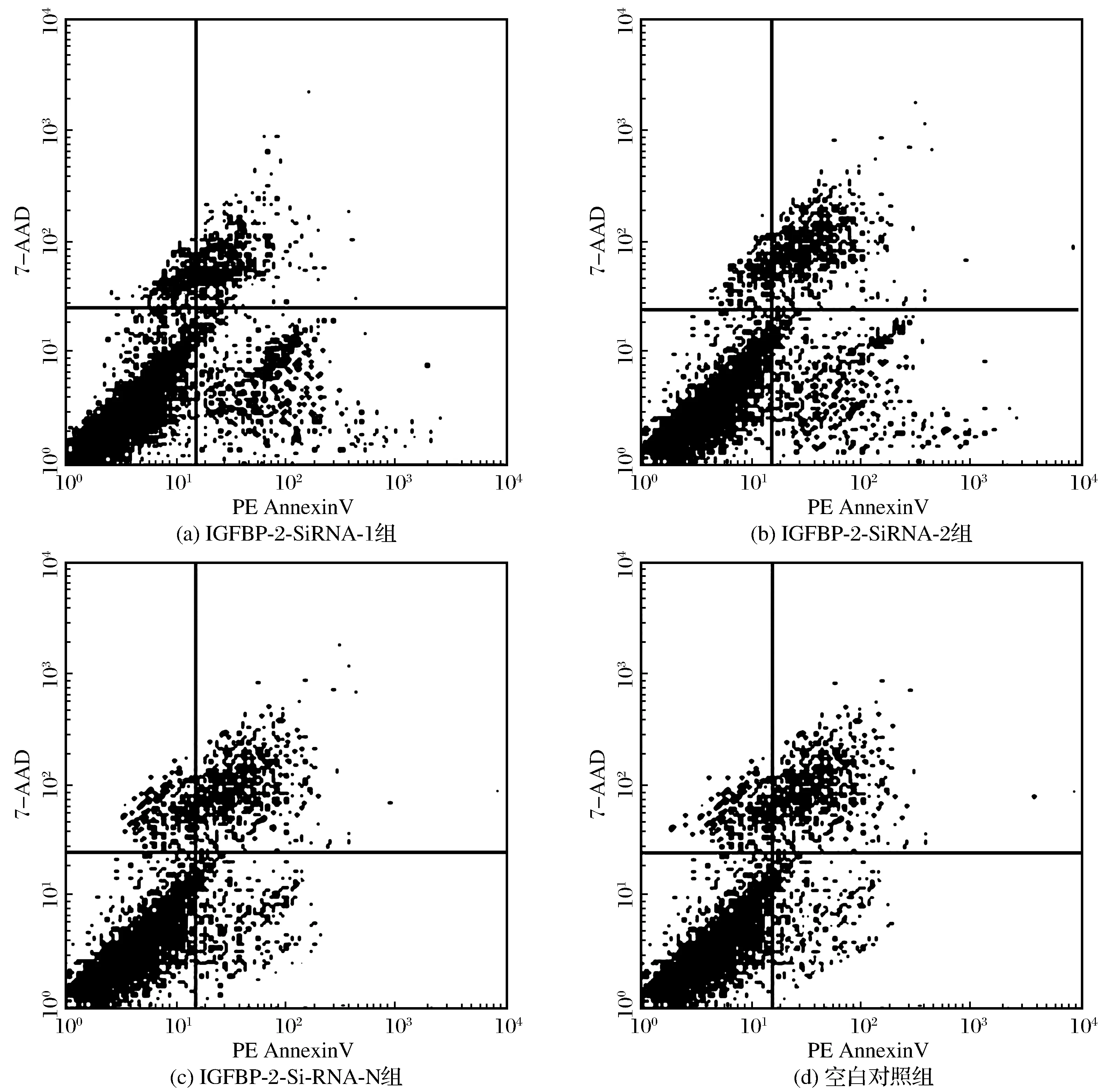
图4 流式细胞术检测各组细胞凋亡Fig.4 Apoptosis of cells in each group tested by flow cytometry

表3 各组细胞凋亡率分析
注:a表示P<0.01,与C组相比较;b表示P<0.01,与D组相比较。
3 讨论
食管癌是目前世界上最常见的消化系统恶性肿瘤之一,我国食管癌的发病率、死亡率亦位居世界前列,年平均死亡人数约15万人,占全国肿瘤死亡率21.8%,每年的发病人数占全世界的一半以上[4]。其中,食管鳞状细胞癌是食管癌主要病理类型,大约占所有食管癌的90%[5]。食管鳞状细胞癌侵袭性极强、且预后极差[6]。在我国北部地区,尤其是靠近太行山一带,食管鳞状细胞癌在食管癌所有病理类型致死率中位于首位[7]。但是迄今为止,食管癌的发病机制仍不明确,食管癌仍缺乏早期诊断及预后评估的敏感标志物[8-9]。大量研究表明,食管癌发生及侵袭转移的过程涉及多个相关基因结构及其表达调控的变化[5-7],其中关键癌基因的活化和抑癌基因的失活起着至关重要的作用。相关研究发现了许多与食管癌发生、转移相关的癌基因,如c-myc、EGFR、ras 和p16 等,针对这些基因的基因治疗也取得了一定的进展,但是治疗效果并不乐观[6-9],因此,深入研究食管癌发生发展及侵袭转移的分子机制,寻找新的干预靶点对于食管癌的预防和治疗具有重要意义。
IGFBP超家族包括:IGFBP- 1、IGFBP-2、IGFBP-3、IGFBP-4、IGFBP-5 和IGFBP-6,它们与胰岛素样生长因子IGF-1和IGF-2有很高的亲和力[10]。IGFBP-2 与其他IGFBP 家族成员有着相似的氨基端和羧基端,但是它具有独特的中间区域,全部的氨基酸序列中相似的序列近60%,氨基端序列被认为在结合IGF-1和IGF-2中有着重大作用[11]。研究表明IGFBP-2是抑制神经胶质瘤[12]和前列腺癌[13]发展的关键因素。IGFBP-2能调节IGF及其整合蛋白的通路,IGFBP-2也是一种调节细胞生长、增殖、抵抗各种肿瘤的细胞因子[14]。但是,IGFBP-2对食管癌的发生、发展及转移侵袭的作用研究却很少。
在这项研究中,我们成功的构建了IGFBP-2-SiRNA表达载体,在此基础上将IGFBP-2-SiRNA-1或IGFBP-2-SiRNA-2转染入食管癌细胞TE-1,能抑制细胞增殖和侵袭。此外,IGFBP-2-SiRNA可诱导在体外食管癌细胞的凋亡的发生。这些结果均提示IGFBP-2可能会成为治疗食管癌的一个理想靶基因。研究结果表明,转染IGFBP-2-SiRNA后,食管癌细胞的增殖能力明显下降。
研究在细胞层面对IGFBP-2和食管癌的关系进行了探索,首先是对针对IGFBP-2构建出了与之结合的载体,转染后发现在4组细胞中,A组(SiRNA-1)和B组(SiRNA-2)可见明显绿色荧光,但在48 h后,细胞逐渐死亡,同样在C组(SiRNA-N)也可见绿色荧光,但该组细胞在48 h后仍能继续生长,与未转染的D组相差无异,研究初步猜测IGFBP-2可能会影响食管癌细胞TE-1增殖、凋亡。为此,我们进一步在增殖、侵袭和凋亡方面分别做了CCK8、Transwell、流式实验,并对实验进行了验证。在此之前研究还通过对转染前后细胞进行了Western的检测,Western的结果支持了我们的有关猜想,IGFBP-2引导合成的蛋白在转染前后细胞中的表达明显不同,在用构建载体沉默了IGFBP-2的表达后,该蛋白表达明显减少,这也与之前的免疫组化结果一致。
在CCK8的试验中,研究发现从48 h后开始,A组(SiRNA-1)、B组(SiRNA-2)与C组(SiRNA-N)、D组(未转染)比较后,在450 nm处的吸光度明显不同,并且随着时间的推移,这种区别越发明显,A组、B组2组的细胞增殖速度明显慢于C组、D组,可见沉默SATB1对TE-1的增殖有明显的抑制作用。而在验证细胞侵袭性的Transwell实验中,我们统计不同组细胞的穿膜数量,发现A组、B组穿膜的数量明显少于C组、D组,可见TE-1的细胞侵袭性在沉默IGFBP-2后有了明显的下降。在最后的流式检测中,转染的A组、B组细胞的凋亡率明显高于C组、D组,尤其是在细胞生长早期,这也提示IGFBP-2基因对食管癌细胞的作用可能发生在细胞周期的较早阶段,也为后期研究IGFBP-2与食管癌细胞周期的关系打下了基础。在细胞实验方面我们得出了一定的研究成果,以此为基础,在以后的研究中进行其他层面的探索,比如在组织层面进行免疫组化、免疫荧光、Western blot的实验,将食管癌组织与癌旁组织及正常组织进行对比,为研究长链非编码RNA与食管癌的关系进行RT-PCR的实验等,并评估食管癌的预后,进一步为证明IGFBP-2与食管癌的相关作用提供充分理论依据。另外,目前研究已经发现的IGFBP家族包含15个成员,其中高亲和力组包括IGFBP1-6,剩下的IGFBP家族高亲和力蛋白与食管癌乃至其他相关恶性肿瘤的关系也值得我们进一步探讨并研究。
