水稻P型ATP酶基因OsHMA功能分析与RNA干涉载体构建
2020-02-24王莹莹冯国栋牛向丽
王 洋, 王莹莹, 张 政, 冯国栋, 周 宇, 牛向丽
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
0 引 言
水稻(Oryzasativa)作为当今世界主要粮食作物之一,其产量会受到包括植物病虫害、高低温、旱涝、盐碱及土壤重金属等各种生物、非生物逆境胁迫的影响[1]。土壤作为植物赖以生存的根基,环境污染会引起土壤中某些重金属离子的增加。伴随着我国工业、城市污染的加剧以及农用化合物种类、数量的增加,土壤重金属污染程度、污染面积也不断加剧。土壤中长期积累存在的锌、铜、钴、镉、铬等金属离子会对植物造成不同程度的损伤,致使植物代谢失衡,生物量、产量下降[2]。
P型ATP酶是一类广泛存在于生物体内、通过ATP的降解而驱动的阳离子泵[3]。在植物体内,它们主要分布于质膜上。P1B-ATPase(P1B型 ATPase)作为其中的一个亚族,具有高亲和性吸收和泵出重金属的功能。P1B-ATPase除了选择性运输必需的金属离子(Cu+、Cu2+、Zn2+、Co2+)外,还能转运一些重金属离子(Cu2+、Cd2+和 Pb2+),因此 P1B-ATPase 又称为重金属 ATP 酶(heavy metal transporting ATPase,HMA)[4]。在拟南芥中有多个HMA基因,与锌、铜离子的转运有关,该类基因的一些单基因突变体不会致死,但双突变体则可能致死[5]。拟南芥基因组中有8个P1B亚族ATPase成员[6-7],其中AtHMA5在根和花中表达量明显增高,负责将Cu+运至胞外或特定器官[8]。
AtHMA7/RAN1可能位于高尔基膜泡上,将Cu+运至乙烯受体ETR1,激活乙烯受体而产生乙烯响应,以及维持幼苗铜离子的平衡[9];AtHMA6/PAA1、AtHMA8/PAA2则被认为分别位于根、叶的叶绿体外膜和类囊体膜上,负责将Cu+转运至叶绿体基质和类囊体腔[10-11]。水稻基因组中也有多个序列被推断为HMA基因[12],但其具体功能尚未完全解析。有研究表明,OsHMA2参与Zn、Cd由根向地上部分的转运[13];OsHMA3定位于水稻根细胞的液泡膜上,参与转移Cd到液泡中[14];OsHMA9主要在水稻维管组织中表达,包括木质部、韧皮部,其基因敲除型突变体积累了更多的金属离子,表明该基因对于这些金属离子细胞外排起到了重要作用[15-16]。本研究对水稻2号染色体HMA基因(命名为OsHMA,基因登录号AK107997)进行了初步的功能分析以及RNA干涉载体构建,为进一步分析OsHMA基因在水稻金属离子转运及抗土壤金属离子胁迫中的功能提供基础。
1 材料与方法
1.1 实验材料
水稻粳稻品种日本晴(OryzasativaL. ssp.japonicacv. Nipponbare)由本实验室保存。
1.2 质粒和试剂
植物表达载体pHB由复旦大学杨洪全教授惠赠;pSK载体、大肠杆菌(Escherichiacoli)菌株DH5α、根癌农杆菌(Agrobacteriumtumefaciens)菌株EHA105由本实验室保存;DNA聚合酶、限制性内切酶购于TaKaRa公司;质粒提取试剂盒、胶回收试剂盒、RNA提取试剂盒及反转录试剂盒购于TransGen公司;其余试剂均为进口分装或国产分析纯;引物合成和测序由生工生物工程有限公司完成。
1.3 试验方法
1.3.1OsHMA基因生物信息学分析
通过SMART在线程序 (http://smart.embl-heidelberg.de/) 对OsHMA编码蛋白的功能结构域进行预测分析;通过亚细胞器蛋白定位软件TargetP v1.01 (http://www.cbs.dtu.dk/services/TargetP/)分析OsHMA编码蛋白的定位;利用植物调控元件数据库PLACE (http://www.dna.affrc.go.jp/PLACE/index.html)对OsHMA基因上游序列进行分析。
1.3.2OsHMA基因表达模式分析
(1)OsHMA基因在水稻不同组织中的表达。取野生型日本晴幼苗(生长21 d,28 ℃,12 h光/12 h暗)的根、茎、叶和田间成熟日本晴植株的根、茎、叶和颖花,加入液氮研磨后分别提取RNA,反转录合成cDNA。以水稻ACTIN为内参基因(登录号X16280),利用逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)分析OsHMA基因的表达情况。
OsHMA引物为:
5’-CTCGAGGATCCAGGCGGCTTGGTCTACCCCT-3’;
5’-AAGCTTAACTGCCAGCCGAATACGAT-3’。
ACTIN引物为:
5’-AAGATCCTGACGGAGCGTGGTTAC-3’;
5’-CTTCCTAATATCCACGTCGCACTTC-3’。
RT-PCR反应条件为:95 ℃ 5 min;95 ℃30 s,57 ℃ 30 s,72 ℃ 30 s,28个循环;72 ℃ 5 min。
(2)OsHMA基因在金属离子诱导水稻中的表达。野生型日本晴幼苗在光照培养箱中(28 ℃,12h光/12 h暗)生长14 d后,以不同浓度金属离子(1 mmol/L FeSO4、10 mmol/L FeSO4、1 μmol/L CuSO4、10 μmol/L CuSO4、7.5 mmol/L MgSO4、75 mmol/L MgSO4、1 μmol/L CoCl2、10 μmol/L CoCl2)分别诱导处理48 h。以蒸馏水处理组为对照,取各金属离子处理组水稻幼叶,进行RT-PCR,分析OsHMA基因的表达情况。具体实验方法、引物以及RT-PCR反应条件如上所述。
1.3.3OsHMA基因RNA干涉载体构建
从野生型日本晴水稻根中提取总RNA,然后进行反转录获得cDNA。按照OsHMA基因序列(登录号AK107997),选取OsHMA 3’端及非翻译区,利用Primer Premier 5.0软件设计引物。以上述反转录cDNA做为模板进行RNA干涉正向、反向片段的扩增。
正向片段引物为:
CTCGAGGATCCAGGCGGCTTGGTCTACCCCT;
AAGCTTAACTGCCAGCCGAATACGAT。
两端分别引入XhoⅠ、BamH Ⅰ与HindⅢ限制性核酸内切酶位点。
反向片段引物为:
GAGCTCAGGCGGCTTGGTCTACCCCT;
GAATTCAACTGCCAGCCGAATACGAT。
两端分别引入SacⅠ与EcoR Ⅰ限制性核酸内切酶位点。
将正向片段经XhoⅠ、HindⅢ酶切回收后连接于pSK质粒,连接产物转化大肠杆菌DH5α感受态,对重组质粒进行测序。反向片段经SacⅠ与EcoR Ⅰ酶切回收,连接于上述已连接正向片段的pSK质粒,从而形成正、反向重复基因片段。然后利用BamH Ⅰ与SacⅠ内切酶将OsHMA正、反向重复基因片段插入植物表达载体pHB,构建CaMV35S-OsHMARHAi载体,命名为pHB-HMARi。通过冻融法转化农杆菌EHA105,获得带有pHB-HMARi质粒的阳性农杆菌克隆,保存备用。
2 结果与分析
2.1 OsHMA基因生物信息学分析
通过SMART在线程序对OsHMA基因编码蛋白功能结构域预测,结果表明,OsHMA有1个金属结合结构域。这一结构域与玉米金属结合蛋白、拟南芥铜分子伴侣约有30%的相似性。通过亚细胞器蛋白定位软件TargetP v1.01 分析,显示OsHMA编码蛋白具有跨膜结构,可能定位于根的成熟区。利用植物调控元件数据库PLACE对OsHMA基因上游序列的分析结果表明,编码区上游2 000 bp有多种元件:7个铜应答诱导序列元件GTAC(分别位于基因上游88、152、584、591、915、1 358、1 385 bp),2个钙调蛋白结合位点VCGCGB(基因上游10、167 bp)、1个乙烯应答元件AWTTCAAA(基因上游513 bp)以及7个黄化诱导表达元件ACGT,如图1所示。
2.2 OsHMA基因表达模式
对OsHMA在水稻不同组织下的表达分析显示:OsHMA在日本晴幼苗的根、茎中有表达,在成熟植株根、茎、叶、颖花组织中均可以检测到OsHMA基因的表达。但无论是在幼苗期还是在成熟期中,OsHMA基因在根中的表达水平明显高于其他组织,如图2所示。图2中,1~7泳道分别为日本晴幼苗根、茎、叶和日本晴成熟植株根、茎、叶、颖花中OsHMA基因表达水平;ACTIN为内参基因。
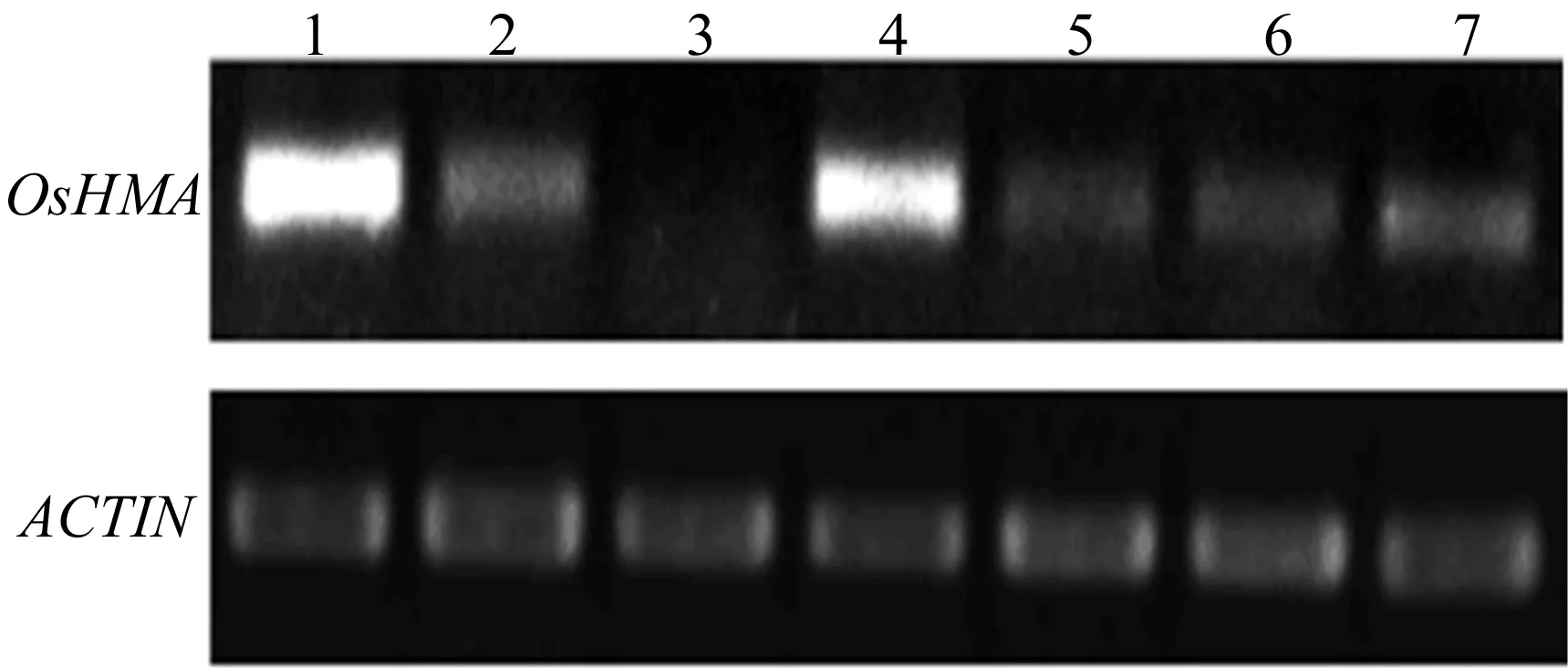
图2 OsHMA基因在水稻不同组织中的表达
在日本晴幼苗叶片中未检测到OsHMA基因的表达,但经过不同浓度金属离子处理48 h后,RT-PCR分析结果表明,OsHMA可以受10 μmol/L Cu2+诱导表达,如图3所示。OsHMA基因的表达模式提示,它可能在水稻的铜离子转运中发挥功能。

图3 OsHMA基因在不同金属离子诱导条件下的表达
图3中,1~9泳道分别为对照、1 mmol/L Fe2+、10 mmol/L Fe2+、1 μmol/L Cu2+、10 μmol/L Cu2+、7.5 mmol/L Mg2+、75 mmol/L Mg2+、1 μmol/L Co2+、10 μmol/L Co2+处理48 h水稻幼叶中OsHMA基因表达水平;ACTIN为内参基因。
2.3 OsHMA基因RNA干涉载体构建
带有OsHMA基因正、反向重复基因片段RNA干涉载体pHB-HMARi的结构如图4所示。OsHMA基因RNA干涉片段RT-PCR扩增产物电泳图如图5a所示,从左至右依次为DNA Marker、正向基因片段扩增产物、反向基因片段扩增产物。OsHMA基因RNA干涉载体pHB-HMARi酶切电泳图如图5b所示,从左至右依次为:DNA Marker、正向片段BamH Ⅰ、HindⅢ酶切鉴定、反向片段SacⅠ 、EcoR Ⅰ酶切鉴定,及正、反向重复片段BamH Ⅰ、SacⅠ酶切鉴定。
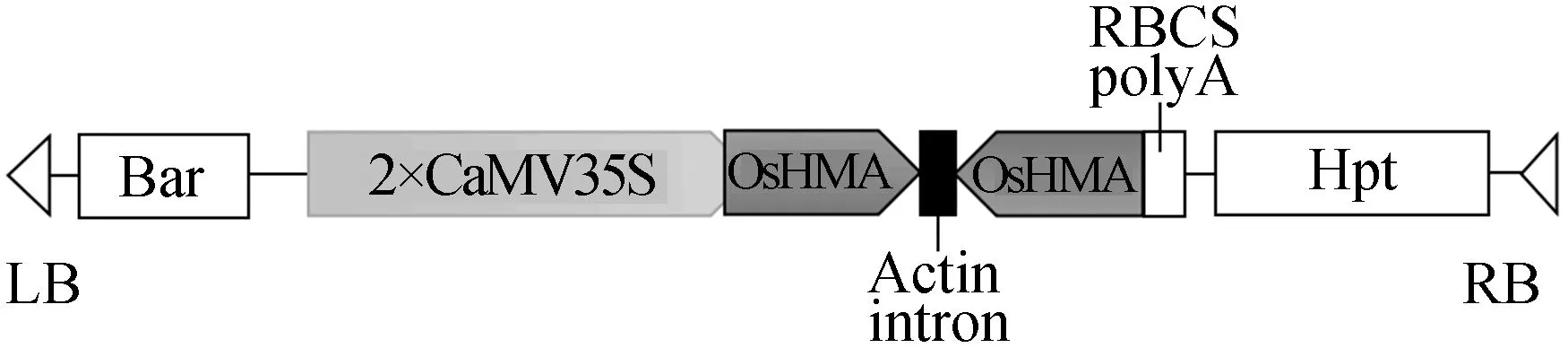
图4 pHB-HARi的结构
从野生型日本晴根中提取总RNA,进行反转录获得cDNA做为模板,进行OsHMA基因 RNA干涉正向、反向片段的扩增,如图5a所示。将OsHMA基因正、反向重复基因片段经中间载体pSK最终插入植物表达载体pHB,构建RNA干涉载体pHB-HMARi,经测序和酶切鉴定,表明RNA干涉载体构建完成,可用于后续水稻遗传转化,如图5b所示。

图5 OsHMA基因RNA干渗载体的构建
3 讨 论
植物的生长除了碳、氢、氧等大量元素外,也需要微量的金属元素,但随着工矿业的迅速发展,以及化肥、农药的大量使用,导致土壤中金属含量不断累积,土壤金属污染目前已经成为全球性问题,我国做为工业迅速发展的发展中国家尤为严重。土壤中长期积累存在的高浓度的锌、铜、钴等金属离子会对作物造成不同程度损伤,致使其代谢紊乱,产量及品质下降[17]。植物中存在的重金属ATP酶(HMA)是一类与抗逆有关的重要蛋白,目前已被证明参与植物体内金属离子转运[18]。水稻中也存在P型ATP酶[19],但其功能仍待系统研究。本工作对水稻的P型ATP酶基因OsHMA进行了生物信息学分析,发现OsHMA含有金属结合结构域,并且含有跨膜结构,表明OsHMA可分布于生物膜,通过分解ATP提供能量,结合、转运金属离子。通过对OsHMA基因的组织表达、诱导表达模式分析,也证实OsHMA基因在水稻根系中表达最高,并受铜离子诱导,可能在水稻根系土壤中铜离子的转运,以及抗铜离子胁迫中具有作用。
为深入探究水稻中OsHMA基因的功能,本研究进一步选取OsHMA基因3’端及非翻译区特异、低同源基因序列片段,构建了RNA干涉载体,并将用于水稻遗传转化与功能表型分析[20]。本工作对水稻OsHMA基因功能的探讨,不仅有利于植物胁迫应答分子机制的研究,也可进一步将其作为目标基因应用于作物,提高作物的抗逆性和胁迫生长环境中的产量,具有理论和应用意义。
