血必净注射液抑制eNOS脱耦联减轻脓毒症血管内皮细胞氧化应激
2020-02-22张晓菲刘英王丽纯曹黛茵王建华陈雷
张晓菲,刘英,王丽纯,曹黛茵,王建华,陈雷
(中山大学第六附属医院ICU,广东 广州 510655)
脓毒症是指由感染引起的宿主反应失调所导致的致命性器官功能障碍[1]。有统计显示,ICU病房中脓毒症和脓毒症休克的病死率分别为30%和60%[2,3]。目前的研究表明,血管内皮细胞(vascular endothelial cells,VECs)氧化应激处于脓毒症发病机制的核心位置,内皮源性一氧化氮合成酶(endothelial nitric-oxide synthase,eNOS)脱偶联则是脓毒症VECs氧化应激的主要原因,而VECs氧化应激又进一步促进了eNOS脱偶联[4]。血必净注射液具有对抗内毒素、抑制炎症反应、保护血管内皮细胞等作用,已经在脓毒症的救治中得到了广泛应用。研究结果表明,血必净注射液能够降低脓毒症患者血中的丙二醛(malondialdehyde,MDA)水平,增加总超氧化物歧化酶(total suPeroxide dismutase,T-SOD)活性和一氧化氮(nitric oxide,NO)浓度,减轻脓毒症VECs的氧化应激水平[5-7]。本研究拟通过建立细胞模型,探讨血必净注射液减轻脓毒症VECs氧化应激具体机制。
1 材料与方法
1.1 实验材料与试剂
EA.hy926细胞株(人脐静脉细胞融合细胞)购买自中国科学院上海细胞库(目录号:GNHu39)。MDA、NO、T-SOD和一氧化氮合酶 (nitric oxide synthase,NOS)活性试剂盒购自南京建成生物工程研究所;eNOS ELISA检测试剂盒购自南京凯基生物发展有限公司;eNOS荧光探针检测试剂盒购自江苏碧云天生物技术研究所;血必净注射液?购自天津红日药业股份有限公司。气相色谱-质谱联用仪(Q1000 型)由日本电子公司生产。
1.2 实验方法
EA.hy926细胞株同步化培养生长至60%~70%,吸除培养液,加入单纯DMEM培养液去血清化培养12 h,弃DMEM培养液,PBS洗1~2次,按表1分组,加入各组处理因素孵育细胞12 h。显微镜下观察细胞形态变化,按照MTT试剂盒说明书检测各组细胞活力。裂解细胞后,取裂解液依次检测以下指标:
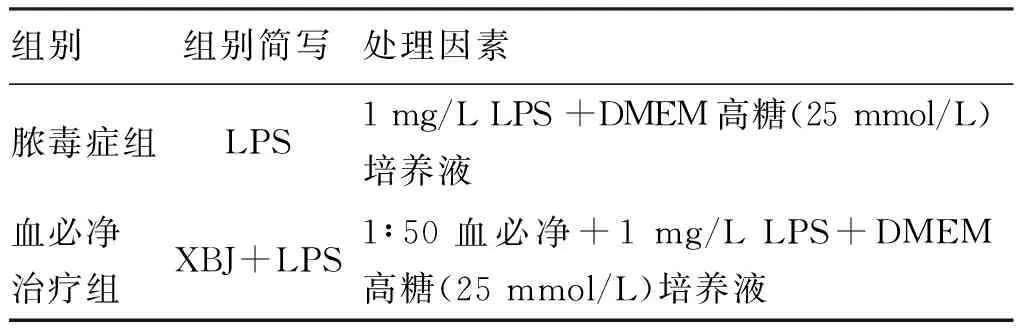
表1 实验分组及处理因素
(1)氧化应激因子检测:用检测试剂盒分别检测T-SOD活性、MDA浓度、NO浓度及NOS活性。(2)四氢生物蝶呤(tetrahydrobioPterin,BH4)和左旋精氨酸(L- arginine,L-Arg)含量检测:采用质谱分析的方法,检测细胞裂解液的BH4和L-Arg浓度。(3)脱耦联的eNOS活性检测:荧光探针法检测正常功能的eNOS活性。按照试剂盒说明书用ELISA法检测总的eNOS浓度。用总的eNOS的浓度减去正常功能的eNOS的活性即为脱偶联的eNOS的水平。
1.3 统计学分析
应用SPSS 13.0统计学软件进行分析,计量资料以均数±标准差表示,多组比较采用单因素方差分析,组间两两比较采用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞形态和细胞活力情况
XBJ组单层EA.hy926细胞株呈“铺路石”状排列,细胞呈成梭形或多边形,边界清晰,细胞核比较突出;LPS组细胞基质内颗粒明显增多,少数出现细胞边界不清,细胞核模糊不清,甚至消失;XBJ+LPS组细胞出现皱缩,少部分细胞基质内颗粒增多,细胞核更为突出。MTT法检测各组细胞活力结果显示,各组细胞活力比较,差异无统计学意义(P>0.05),见图1。
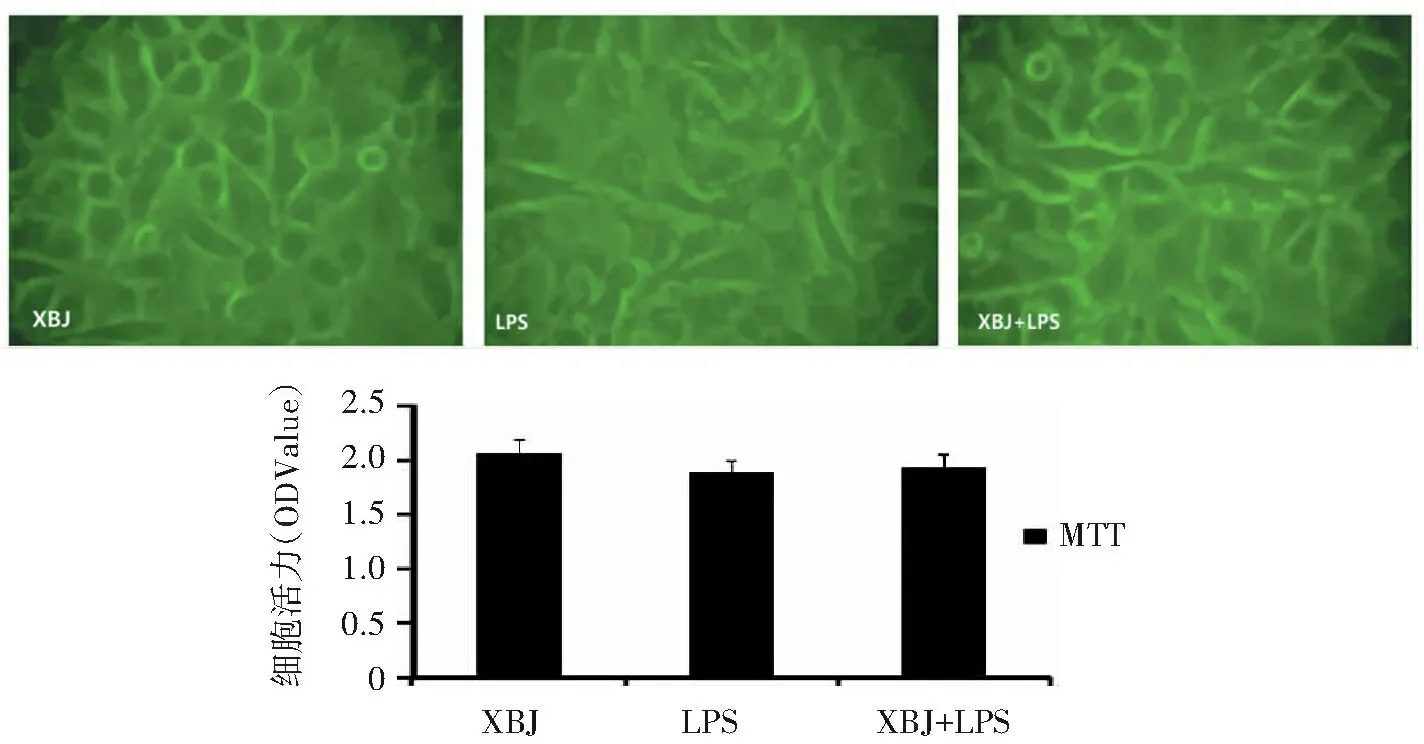
注:LPS:脂多糖;XBJ:血必净注射液分别以LPS(1 mg/L)培养液、BCNU(5 mg/L)培养液、LPS(1 mg/L)+DTT(2 mmol/L)培养液和DMEM培养液刺激EA.hy926细胞株12 h,观察细胞形态并采用MTT法检测细胞活力,实验重复3次。
2.2 脓毒症血管内皮细胞氧化应激模型
与XBJ组相比,LPS组培养液中的MDA水平均明显升高(P<0.05),NO的含量均明显降低(P<0.05),T-SOD的活性没有明显差别(P>0.05);而XBJ+LPS组培养液中的MDA水平和T-SOD活性均没有明显变化(P>0.05),仅有NO水平明显升高(P<0.05)。与LPS组相比,XBJ+LPS组的MDA水平明显降低、NO浓度显著增加(P<0.05),T-SOD的活性也没有明显差别(P>0.05)。见表2。提示LPS刺激EA.hy926细胞建立的脓毒症血管内皮细胞氧化应激模型成功,而且在血必净注射液联合LPS刺激下,细胞的氧化应激得到改善,VECs功能障碍可以恢复,甚至NO产量有所增加。

表2 各组氧化应激指标情况
2.3 血必净注射液降低脓毒症血管内皮细胞氧化应激的机制
如表3所示,各组EA.hy269细胞孵育12 h后,细胞内BH4和L-Arg含量基本保持稳定。提示在脓毒症导致的eNOS脱偶联的机制与细胞内的BH4和L-Arg含量基本无关。然而,与XBJ组相比,LPS组细胞内的总eNOS并未明显变化(P>0.05),正常功能性eNOS下降,脱偶联的eNOS相应增加(P<0.05)。XBJ+LPS组与LPS组比较,正常功能性eNOS升高,脱偶联的eNOS相应减少(P<0.05);而与XBJ组相比,总的eNOS、正常功能性eNOS和脱偶联的eNOS都没有变化(P>0.05)。

表3 各组eNOS脱偶联机制指标情况
3 讨论
本研究利用EA.hy926细胞建立脓毒症VECs氧化应激模型及血必净注射液干预模型,明确了血必净注射液能够减轻脓毒症VECs氧化应激,并探索了血必净注射液减轻脓毒症VECs氧化应激的可能机制是降低了eNOS脱偶联。
血必净注射液不仅可以抑制炎症反应,而且可以减少内毒素对血管内皮细胞的影响[8],从而减少降低细胞外超氧阴离子的产生,降低细胞内的氧化应激。有研究显示,血必净注射液对于脓毒症血管内皮细胞具有保护作用,能够显著降低脓毒症患者MDA水平,增加T-SOD和NO水平,即具有减轻脓毒症VECs的氧化应激水平[5-7]。本研究中治疗组MDA、NO和SOD检测结果也得到了相似结论。
慢性炎症导致氧化应激时存在着eNOS脱偶联,其主要机制包括[9,10]:①BH4含量不足是eNOS脱耦联最主要原因;②L-Arg含量不足引起eNOS脱耦联;③eNOS谷胱甘肽化可导致eNOS脱耦联。然而,在脓毒症导致的氧化应激中,模型细胞中的BH4含量和L-Arg含量并没有明显降低,其主要机制是eNOS脱偶联,而eNOS脱偶联的机制主要是eNOS谷胱甘肽化,而eNOS的活化也参与其中,并且两者相互作用,互为转化,共同加重脓毒症的VECs氧化应激[4]。目前,血必净注射液对于减轻血管内皮细胞氧化应激的作用机制研究尚不太多,本研究通过检测血管内皮细胞BH4含量、L-Arg含量和脱偶联的eNOS水平,明确了在脓毒症时,BH4含量和L-Arg含量并不是血必净注射液?降低血管内皮细胞氧化应激的主要机制,而eNOS脱偶联才是这一保护作用的关键机制。
事实上,在脓毒症时血管内皮细胞发生氧化应激的主要机制除了eNOS脱偶联以外,还包括以下几个途径生成:磷酸酰胺腺嘌呤二核苷酸氧化酶(nicotinamide adenine dinucleotide PhosPhate oxidase,NOX)、环氧化酶-2(cyclooxygenase-2,COX-2)、黄嘌呤氧化酶和线粒体电子传递链[11]。且与超氧化物岐化酶(suPeroxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione Peroxidase,GPX)、过氧化氢酶(catalase,CAT)等抗氧化酶的活性降低有关[12,13]。本研究尚没有关注上述几个造成氧化应激的途径,存在一定的局限性,在以后的研究中需要进一步关注。
