术前MRI预测对改善关节镜治疗慢性髌腱末端病变临床疗效的价值
2020-02-22沈耀汪裕聪李盛朱峰方超华
沈耀,汪裕聪,李盛,朱峰,方超华
(1.宁波市鄞州人民医院 放射科,浙江 宁波 315040;2.宁波市鄞州人民医院 骨科,浙江 宁波 315040;3.宁波市第六医院 关节外科,浙江 宁波 315040)
膝前痛与髌腱压痛是髌腱末端病变(patellar tendinopathy,PT)的常见症状,由于PT 好发于跳跃运动员,又称为“跳跃者膝”。职业运动员PT 发病率为14.0%,篮球、排球等高风险运动PT 发病率高达30.0%[1]。PT 多见于老年肥胖患者和股内侧肌增大者[2]。有研究[3]认为,髌骨下极在屈膝时有撞击近端髌腱深面的倾向,非关节面区髌骨下极延长是PT发病的危险因素。CULVENOR等[4]证实,髌下脂肪垫(infrapatellar fat pad,IFP)增厚是PT的发病机制。除病史和临床表现外,超声检查、常规X 线片和磁共振成像(magnetic resonance imaging,MRI)均可常规用于诊断PT。PT的典型MRI表现包括:髌骨下极骨髓水肿(bone marrow edema,BME)、近端髌腱增厚、近端髌腱信号强度异常、髌下滑囊炎、肥厚和IFP水肿[5-6]。开放手术和关节镜手术可有效治疗非手术方法无效的慢性难治性PT[7]。关节镜手术由于侵袭性低且康复快,倍受临床医生和患者青睐。尽管PT的发病机制和危险因素已得到充分了解,但目前预测PT 患者术后临床疗效的因素较少。MRI 在PT 诊断和决定治疗方案过程中发挥着重要作用,较少有研究探讨术前MRI预测在关节镜治疗慢性PT 中的疗效及其预后价值,本研究拟对此进行初步探讨分析。
1 资料与方法
1.1 一般资料
选取2008年8月-2017年12月宁波市鄞州人民医院和宁波市第六医院因慢性难治性、症状性PT行关节镜下髌骨松解术(arthroscopic patellar release,APR)的患者进行前瞻性、预后队列研究。所有患者因保守治疗失败转行手术治疗,非手术治疗包括:心理治疗至少3个月,口服非甾体抗炎药,体外冲击波治疗,超声引导下腱周注射糖皮质激素3次。所有患者使用完全相同的手术方法和术后康复计划。共29例患者符合参与研究的条件,并且全部可以入组。纳入研究后,1例因同侧踝关节骨折导致功能永久受限而不得不被排除。28例(96.6%)完成随访检查,术前所有患者均无膝伤。
纳入标准:年龄18岁以上;行关节镜治疗;非手术治疗至少6个月,仍出现慢性难治性、症状性PT;术后随访2年以上。排除标准:MRI 信号强度异常,表现为近端髌腱部分断裂,并伴随膝关节内或膝关节外病理。本研究经医院伦理委员会批准,所有参与者均签署知情同意书。
1.2 术前诊断
术前由1名经验丰富的骨科医师获取病史,并对所有膝关节进行标准的临床检查。影像学诊断包括X线平片(膝关节正侧位和髌股关节轴位)、患膝关节超声检查和MRI检查。
1.3 术前MRI诊断
1.3.1 MRI检查参数 扫描序列:SE T1WI(TR 569 ms,TE 22 ms)、T2WI(TR 3 890 ms,TE 99 ms)、STIR(TR 4 710 ms,TE 79 ms)、PDWI(TR 2 000 ms,TE 17 ms),视野20 cm×20 cm,矩阵256×192,层厚4.0 mm,层间距0.8 mm。在不注射造影剂的情况下,获取质子密度加权自旋回波序列+光谱饱和脂肪抑制图像。
1.3.2 MRI诊断用T1、T2和质子密度加权序列进行术前髌腱和周围组织MRI诊断。为避免“魔角”伪影,回波时间范围为33~40 ms。膝关节MRI 由1名熟悉PT 相关MRI 变化的放射科医师进行评估。标准MRI诊断包括:①BME(图1A);②近端髌腱增厚(图1B);③IFP水肿(图1C和D);④髌下滑囊炎(图1C和D)。
髌骨下极BME 定义为较正常周围骨信号局部增强明显。IFP信号强度较脂肪组织明显增强时,可鉴定为IFP水肿。髌下滑囊炎定义为髌下囊内有病理性积液。如果髌腱近端部分较远端部分前后径超过7.0 mm,则可认为髌腱增厚。术中关节镜下典型截图见图2。
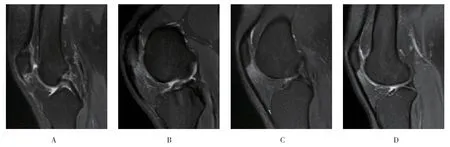
图1 慢性PT的MRI表现 Fig.1 MRI findings of chronic PT
图2 关节镜治疗慢性髌腱末端病变术中情况 (×40)Fig.2 Intraoperative treatment of chronic terminal patellar tendon lesions with arthroscopy (×40)
1.4 观察指标
标准化随访方案由骨科住院医师执行。采用维多利亚运动学院评分(Victorian Institute of Sport Assessment,VISA)(0~100分)和改良Blazina评分作为功能结局评分。改良Blazina评分是病理特异性观察指标,根据不同运动/活动水平包括5个阶段:0 =无疼痛,1 =剧烈体育活动后疼痛,2 =体育活动开始时或结束后疼痛,3 =在令人满意的水平下活动期间疼痛,4 =在不令人满意的水平下体育活动期间疼痛,5 =每日运动期间疼痛。采用膝关节功能评分(single assessment numeric evaluation,SANE)评估患者功能恢复情况,受试者对患膝主观功能进行评估,评分为0~100分,100分为正常。患者用视觉模拟评分(visual analogue scale,VAS)记录活动期间的最大疼痛程度。随访时,要求所有受试者评估目前症状,并与伤前运动水平进行比较。
1.5 统计学方法
采用SPSS 19.0软件进行统计分析。计量资料用均数±标准差(±s)表示。采用独立样本t检验分别比较MRI表现阳性和阴性患者的临床特征差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床转归
本组患者未发生围手术期并发症或手术并发症。出院前1 d 对所有受试者进行临床检查,受试者均自诉髌骨下极周围局部锐痛缓解,能够单足静立和浅蹲,未发生PT 特征性疼痛。
2.2 结局评分
术后随访时,所有观察指标较术前均有明显改善。VISA评分(95.4±8.1)分高于术前(55.6±12.4)分,差异有统计学意义(P<0.01)。其中,优21例(75.0%)(91~100)分,良6例(21.4%)(81~90分),不满意1例(3.6%)(70分)。
随访时,受试者改良Blazina评分(0.3±0.1)分低于术前(4.1±0.7)分,差异有统计学意义(P<0.01)。19例(67.9%)无疼痛(0分),7例(25.0%)剧烈体育活动后感觉轻中度疼痛(1分),2例(7.1%)体育活动开始时和结束后疼痛(2分)。
患者的主观膝关节功能明显改善,膝关节SANE评分由术前(45.2±17.5)分上升至末次随访时的(90.2±11.4)分,差异有统计学意义(P<0.01)。13例 (46.5%)主观膝关节功能评定为优(91~100分),11例(39.3%)为良(81~90分),2例(7.1%)满意(71~80分),2例(7.1%)不满意(70分),但2例对手术不满意的患者已恢复至伤前竞技水平。
末次随访时,疼痛VAS评分由术前(5.7± 1.3)分下降至(0.5±0.1)分,差异有统计学意义(P<0.01)。
2.3 运动恢复情况
所有患者运动恢复所需时间平均为(4.0±1.2)个月,均恢复至伤前运动水平。其中,23例(82.1%)患者体育活动期间或体育活动后无任何症状,5例(17.9%)患者剧烈运动后感觉轻中度疼痛。2例(7.1%)主观结果不满意的患者自诉体育竞赛开始时和/或结束后疼痛明显,但两者均能在之前的强度下参加体育运动,局部症状不明显。
2.4 MRI表现
2.4.1 BME 患者术前28例患者中,16例(57.1%)髌骨下极BME,12例(42.9%)无髌骨下极BME。BME 患者与末次随访时临床转归或功能恢复受损无关(P>0.05)。见表1。
2.4.2 IFP患者 28例患者中,术前MRI检出IFP水肿9例(32.1%)。术前IFP患者VISA评分和SANE评分均低于无IFP患者。末次随访时,改良Blazina评分、SANE和VAS评分显示,IFP水肿与临床结局差显著相关。此外,IFP患者运动恢复时间明显长于无IFP水肿患者。见表2。
2.4.3 BME和IFP患者 7例(25.0%)同时伴有BME和IFP水肿,11例(39.3%)单纯性BME或IFP水肿。同时伴有BME和IFP水肿患者术前和术后VISA评分明显低于单纯性BME或IFP水肿患者。术后48个月时,SANE和VAS评分显示,同时伴有BME和IFP水肿患者临床结局比单纯性BME或IFP水肿患者差。但两组患者运动恢复所需时间差异无统计学意义。见表3。
表1 有BME和无BME 患者临床参数比较 (±s)Table1 Comparison of the clinical parameters of patients with and without BME (±s)
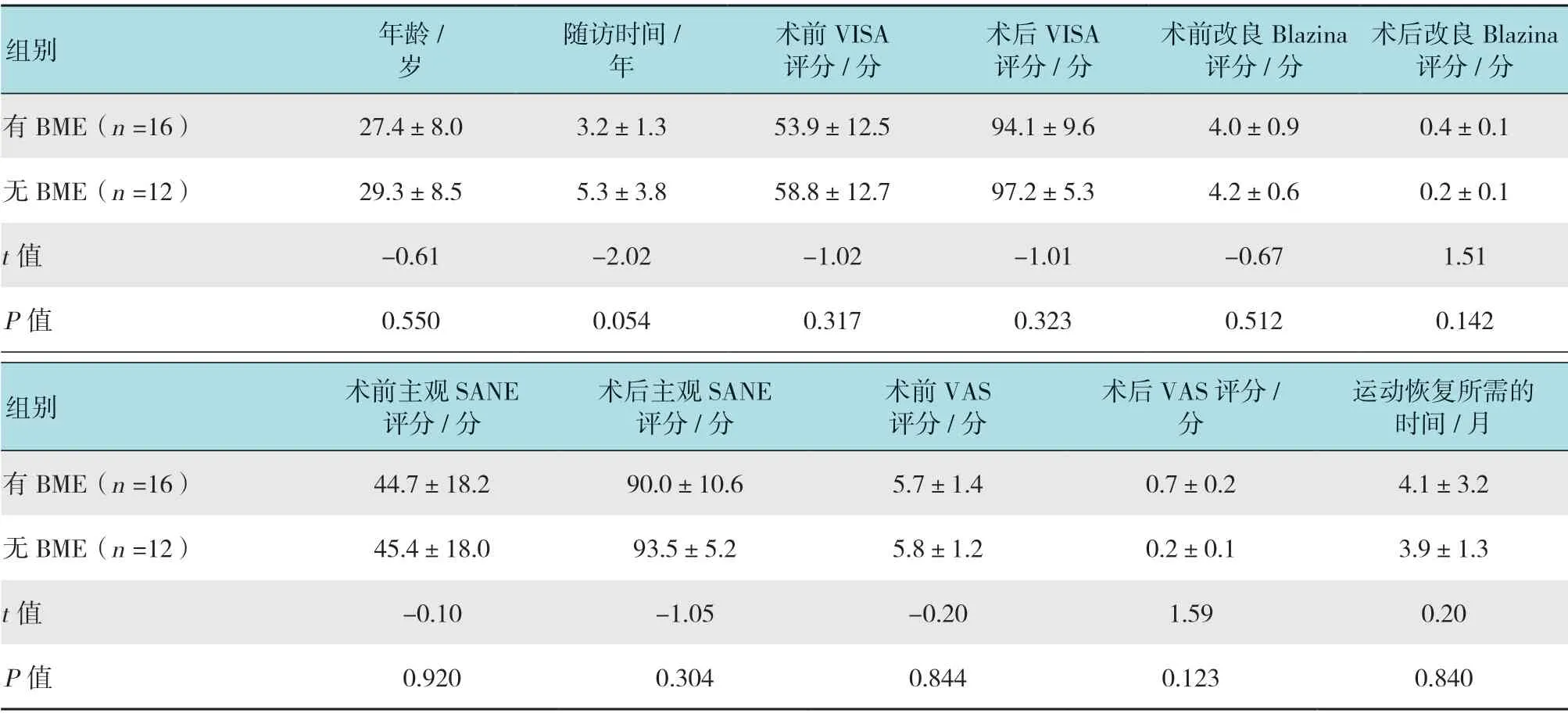
表1 有BME和无BME 患者临床参数比较 (±s)Table1 Comparison of the clinical parameters of patients with and without BME (±s)
组别年龄/岁随访时间/年术前VISA评分/分术后VISA评分/分术前改良Blazina评分/分术后改良Blazina评分/分有BME(n =16) 27.4±8.0 3.2±1.3 53.9±12.5 94.1±9.6 4.0±0.9 0.4±0.1无BME(n =12) 29.3±8.5 5.3±3.8 58.8±12.7 97.2±5.3 4.2±0.6 0.2±0.1 t值-0.61 -2.02 -1.02 -1.01 -0.67 1.51 P值0.550 0.054 0.317 0.323 0.512 0.142组别术前主观SANE评分/分术后主观SANE评分/分术前VAS评分/分术后VAS评分/分运动恢复所需的时间/月有BME(n =16) 44.7±18.2 90.0±10.6 5.7±1.4 0.7±0.2 4.1±3.2无BME(n =12) 45.4±18.0 93.5±5.2 5.8±1.2 0.2±0.1 3.9±1.3 t值-0.10 -1.05 -0.20 1.59 0.20 P值0.920 0.304 0.844 0.123 0.840
表2 有IFP水肿与无IFP水肿患者临床参数比较 (±s)Table2 Comparison of the clinical parameters of patients with and without IFPedema (±s)
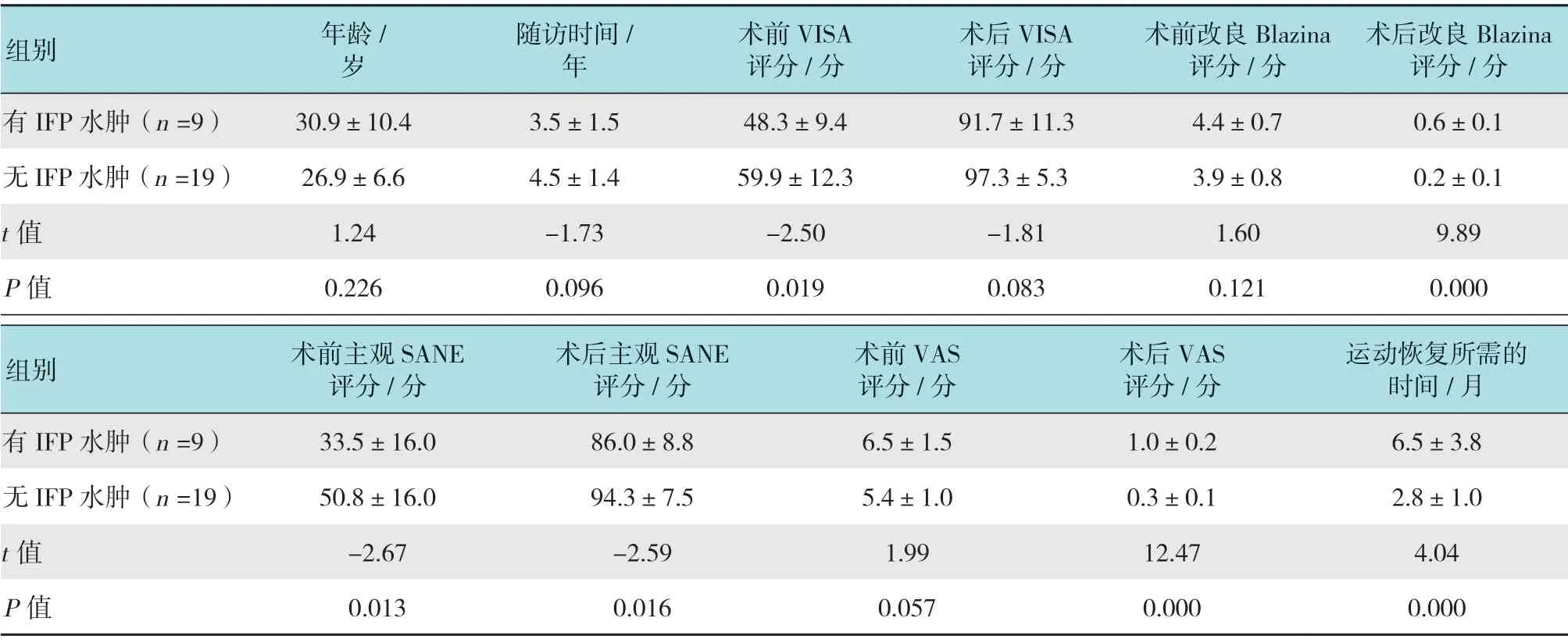
表2 有IFP水肿与无IFP水肿患者临床参数比较 (±s)Table2 Comparison of the clinical parameters of patients with and without IFPedema (±s)
组别年龄/岁随访时间/年术前VISA评分/分术后VISA评分/分术前改良Blazina评分/分术后改良Blazina评分/分有IFP水肿(n =9) 30.9±10.4 3.5±1.5 48.3±9.4 91.7±11.3 4.4±0.7 0.6±0.1无IFP水肿(n =19) 26.9±6.6 4.5±1.4 59.9±12.3 97.3±5.3 3.9±0.8 0.2±0.1 t值1.24 -1.73 -2.50 -1.81 1.60 9.89 P值0.226 0.096 0.019 0.083 0.121 0.000组别术前主观SANE评分/分术后主观SANE评分/分术前VAS评分/分术后VAS评分/分运动恢复所需的时间/月有IFP水肿(n =9) 33.5±16.0 86.0±8.8 6.5±1.5 1.0±0.2 6.5±3.8无IFP水肿(n =19) 50.8±16.0 94.3±7.5 5.4±1.0 0.3±0.1 2.8±1.0 t值-2.67 -2.59 1.99 12.47 4.04 P值0.013 0.016 0.057 0.000 0.000
表3 同时伴有BME和IFP水肿患者与单纯性BME或IFP水肿患者临床参数比较 (±s)Table3 Comparison of the clinical parameters between patients with BME and IFPedema and patients with simple BME or IFPedema (±s)

表3 同时伴有BME和IFP水肿患者与单纯性BME或IFP水肿患者临床参数比较 (±s)Table3 Comparison of the clinical parameters between patients with BME and IFPedema and patients with simple BME or IFPedema (±s)
组别年龄/岁 随访时间/年术前VISA评分/分术后VISA评分/分术前改良Blazina评分/分术后改良Blazina评分/分同时伴有BME和IFP水肿(n =7) 29.7±9.7 3.3±1.4 46.0±7.8 88.1±11.9 4.4±0.8 0.7±0.1单纯性BME或IFP水肿(n =11) 27.6±8.8 3.3±1.5 58.1±12.1 98.6±4.2 3.8±0.9 0.2±0.1 t值0.48 0.00 -2.34 -2.71 1.44 1.92 P值0.641 1.000 0.033 0.015 0.170 0.073组别术前主观SANE评分/分术后主观SANE评分/分术前VAS评分/分术后VAS评分/分运动恢复所需的时间/月同时伴有BME和IFP水肿(n =7) 35.0±15.5 84.3±10.2 6.4±1.4 1.3±0.4 5.9±1.2单纯性BME或IFP水肿(n =11) 46.5±19.5 93.1±8.3 5.5±1.5 0.3±0.1 4.1±1.9 t值-1.31 -2.13 0.33 8.04 2.07 P值0.207 0.049 0.748 0.000 0.054
3 讨论
本研究表明,术前MRI表现可作为关节镜治疗慢性PT的预后因素。改良Blazina评分、主观膝关节功能SANE评分和VAS评分显示,术前IFP水肿与行关节镜治疗的PT 患者预后不良显著相关。所有患者于术后(4.0±1.2)个月恢复至伤前竞技体育水平。术前IFP水肿患者运动恢复时间明显延迟(6.5和2.8个月)。VISA评分、SANE评分和VAS评分显示,同时伴有BME和IFP水肿患者预后较单纯性BME或IFP水肿患者差,但运动恢复所需时间差异无统计学意义(P>0.05)。
目前,关于PT 危险因素的研究较多,但是基于循证医学的研究尚少。本研究显示,术前IFP水肿是功能恢复较差和运动恢复时间增加的预后因素。临床上普遍认为,肌腱滑液膜和IFP等腱周软组织损伤参与慢性PT的形成,本研究结果也支持这一观点[8-9]。IFP可触发复杂的病理生理和生化过程,应答骨关节炎和其他急、慢性膝关节功能障碍[10]。PT 还参与复杂的外在与内在过程的相互作用。长期机械过载可引起髌腱末端微小损伤,最终导致周围软组织炎症反应,促进新生血管形成,神经内生入近端髌腱,使痛感增加[9-10]。本研究中,这种代谢与促炎变化的病理改变表现为MRI检查显示的IFP水肿和BME,导致术前、术后功能变差,疼痛程度升高,术后恢复期延长[11]。本研究结果与CULVENOR等[4]和WARDEN等[12]的观察结果一致,CULVENOR等[4]研究表明,IFP异常与临床症状相关,IFP肥厚可增强痛感。WARDEN等[12]采用MRI检查30例有症状患者,检出13例(43.3%)IFP信号改变,其中10例(33.3%)表现为IFP水肿。
APR 着重于在不切除任何肌腱或骨骼情况下,对腱周软组织病理(IFP、腱鞘炎)进行病因性治疗[13]。有研究[14]表明,APR 作为一种软组织微创手术,其疗效与涉及切除肌腱、骨骼和创伤性更大的(关节镜或开放性)手术相反。临床实践中,根据预先观察MRI表现对患者进行危险分层和结局预测具有重要价值,尤其是对功能需求较高的患者。另外,预后因素还可用于辅助制定改善临床转归的个性化治疗和康复方案。本研究中,患者平均需要4个月才能恢复竞技体育水平,这是由于存在慢性肌肉运动疾病导致的延长术后康复时间,且行APR后,患者应避免运动至少3个月。过于激进的康复运动可能会促使症状(部分)持续、延长和/或复发。本研究结果能够使新的治疗方法成为可能,专门的IFP水肿保守治疗能够加快术后康复,并改善PT 关节镜治疗后的临床转归。
综上所述,本研究观察了关节镜治疗慢性PT的预后因素,术前只有IFP水肿或术前MRI 显示同时伴有BME和IFP水肿的患者与功能预后不良和运动恢复延迟相关。本研究强调累及腱周软组织的病理改变对慢性症状性PT的发病意义,从而可通过APR 微创技术有效治疗,不需切除骨骼或肌腱。了解这些预测因素可改进危险分层,使治疗和术后康复实现个性化,并且有助于改善临床疗效。
