裂叶荨麻醇提物体外抗氧化及α-葡萄糖苷酶抑制作用的研究
2020-02-22杨文娟何亚娟毛跟年胡媛侯景龙马养民龚频
杨文娟,何亚娟,毛跟年,胡媛,侯景龙,马养民,龚频
(1.陕西科技大学食品与生物工程学院,陕西西安710021;2.陕西科技大学化学与化工学院,教育部轻工助剂化学与技术重点实验室,陕西西安710021)
裂叶荨麻(Urtica fissa Pritz.)为被子植物门荨麻科(Urticaceae)荨麻属(Urtica Linn.)植物,该属植物在国内外广泛分布[1],研究发现荨麻植株含有α 亚麻酸、亚油酸、叶黄素、β-胡萝卜素、蛋白质、维生素C、钙、硒及多种人体必需氨基酸,因此,其嫩茎叶常作为野生蔬菜用来凉拌、炒蛋、做汤等,具有极高的营养价值[2]。此外,荨麻属植物含有黄酮、木脂素、萜类、甾醇、多酚[3]等多种次生代谢产物,药理研究表明,其具有抗炎抗风湿、镇痛、抗氧化、降糖降脂、抗前列腺增生、抗肿瘤等活性[4]。
氧化损伤由生物体内自由基过量堆积引发,是导致生物衰老及诱发Ⅱ型糖尿病等相关代谢性疾病的重要原因[5-6]。具有抗氧化活性的物质可有效清除体内多余自由基,减少由活性物质引起的细胞氧化损伤,防止多种疾病的发生[7]。α-葡萄糖苷酶是位于小肠黏膜细胞刷状缘内的一组水解酶,其主要作用是促进肠道食物中碳水化合物如淀粉、蔗糖、麦芽糖等分解成单糖,从而引起餐后血糖升高。抑制α-葡萄糖苷酶的活性可以减少单糖的生成,从而降低餐后血糖[8],通过对α-葡萄糖苷酶抑制活性的检测,可以初步判断药物有无降糖活性。
目前,已有文献报道荨麻属狭叶荨麻(Urtica angustifolia L.)、异株荨麻(Urtica dioica L.)的体外抗氧化[9]和降糖作用[10-11],而裂叶荨麻的研究主要集中于化学成分[12],体外抗氧化及α-葡萄糖苷酶抑制活性研究鲜有报道。本研究通过测定裂叶荨麻醇提物对DPPH 自由基、羟基自由基的清除率及总还原力来评价其体外抗氧化能力,通过α-葡萄糖苷酶抑制作用的研究评价其对血糖的调节能力,以期为裂叶荨麻的进一步开发利用提供新思路。
1 材料与方法
1.1 材料与试剂
裂叶荨麻原植物于2018 年8 月采自陕西省旬阳县,经陕西中医药大学颜永刚教授鉴定为荨麻科裂叶荨麻(Urtica fissa.Pritz.),植物标本保存于陕西科技大学药物制剂实验室。将裂叶荨麻全株阴干,置阴凉通风处存放。
无水乙醇、磷酸二氢钠(NaH2PO4)、抗坏血酸(VC)、硫酸亚铁(FeSO4)、水杨酸、30 %过氧化氢(H2O2)、铁氰化钾(K3[Fe(CN)6])、无水碳酸钠(Na2CO3)、硝酸铝(Al(NO3)3)、氢氧化钠(NaOH):分析纯,天津市天力化学试剂有限公司;亚硝酸钠(NaNO2):分析纯,天津市东丽区天大化学试剂厂;对硝基苯-α-D 葡萄糖吡喃苷(纯度为 90%,4-Nitrophenyl α-D-glucopyranoside,PNPG)、α-葡萄糖苷酶(23.5 U/mg):上海源叶生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、磷酸氢二钠(Na2HPO4)、三氯化铁(FeCl3):分析纯,天津市科密欧化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(纯度为 99.6 %,1,1-Diphenyl-2-picrylhydrazyl radical 2,2-Diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DPPH):上海笛医生物科技有限公司;三氯乙酸(trichloroacetic acid,TCA):分析纯,上海山浦化工有限公司;芦丁标准品:纯度98.5 %,苏州天可贸易有限公司。
1.2 仪器与设备
HH-4 数显恒温水浴锅:金坛市江南仪器厂;JA26038 电子天平:上海天美天平仪器有限公司;TG16-WS 台式高速离心机:湖南湘仪实验室仪器开发有限公司;XW-80A 涡旋混合仪:海门市其林贝尔仪器制造有限公司;varioskan flash 全波长扫描式多功能读数仪:赛默飞世尔科技有限公司(芬兰)。
1.3 试验方法
1.3.1 裂叶荨麻醇提物的制备
参照文献[13]及预试验,取裂叶荨麻干燥茎适量,粉碎,过60 目筛,称取70 g 粉末,加入1 400 mL70%乙醇,70 ℃回流提取1 h,抽滤,滤渣重复上述步骤2次,合并2 次提取液,滤液于旋转蒸发仪减压浓缩至80 mL,浓缩液60 ℃水浴蒸干,4 ℃冷藏,临用前配制成所需浓度。
1.3.2 裂叶荨麻醇提物黄酮含量的测定
1.3.2.1 芦丁标准曲线的绘制
参照柴郑[14]的方法进行试验,分别取配制好的200 μg/mL 的芦丁标准液 0.5、1.0、1.5、2.0、2.5 mL 于10 mL 试管中,用甲醇补足5 mL 后分别加入质量分数为5%的NaNO2溶液0.5 mL,摇匀放置6 min,然后再分别加入质量分数为10%的Al(NO3)3溶液0.5 mL,摇匀放置6 min,最后加入质量分数为4%的NaOH 溶液4 mL,摇匀放置20 min,在500 nm 波长处测定其吸光度。同时分别设立5 支对照管,用于消除测定吸光度时药物本身背景颜色的影响。以浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.2.2 裂叶荨麻醇提物中黄酮含量的测定
取裂叶荨麻醇提物0.015 g 于烧杯中加入少量甲醇超声溶解,溶解后转移至10 mL 容量瓶中定容,配成1.5 mg/mL 的溶液。采用与制定标准曲线中相同的显色方法进行显色,平行测3 次,在500 nm 波长处测定其吸光度值,同样设置对照管,消除药物本身颜色的影响。将测得的吸光度带入回归方程,计算裂叶荨麻醇提物中黄酮的含量。
1.3.3 体外抗氧化能力的测定
1.3.3.1 DPPH 自由基清除活性
取DPPH 适量,加无水乙醇溶解配制成50 μg/mL的溶液。通过预试验确定VC及裂叶荨麻醇提物浓度均分别为 2、20、60、200、400、800 μg/mL。按范金波等[15]的方法在517nm 处测吸光度,全程严格避光操作,每个样品平行测3 次,按式1 计算DPPH 自由基清除率,并计算IC50。

式中:A对为对照组(100 μLDPPH+100 μL 无水乙醇)吸光度;A样为样品(100 μLDPPH+样品溶液)吸光度;A空为空白组(100 μL 样品+100 μL 无水乙醇)吸光度。
1.3.3.2 羟基自由基清除率的测定
采用水杨酸比色法测定,参照文献[16-17]稍作修改进行试验。
在 96 孔板中依次加入 50 μL 9mmoL/L FeSO4,50 μL 9 mmoL/L 水杨酸-乙醇溶液,50 μL 蒸馏水,50 μL 不同浓度的裂叶荨麻醇提物溶液,50 μL 8.8 mmoL/L H2O2,在510 nm 处测吸光度,每个样品平行测3 次。对照管用蒸馏水代替样品溶液,空白管用蒸馏水H2O2。按式2 计算·OH 自由基清除率,并计算IC50。

式中:A对为对照孔的吸光度;A样为样品孔的吸光度;A空为空白孔的吸光度。
1.3.3.3 总还原力的测定
参照许女等[18]的方法,取1 mL 样品溶液,加入2.5 mL 的 0.2 mol/L 磷酸缓冲液(pH6.6)和 2.5 mL1 %K3[Fe(CN)6]于试管中混匀,50 ℃水浴中反应 20 min,迅速冷却并加入2.5 mL10%TCA,混匀后3 500 r/min离心10 min,取3 mL 上清液加入0.6 mL0.1%FeCl3混匀,再加3 mL 蒸馏水摇匀,以蒸馏水为空白对照,在波长700 nm 测定吸光度值。吸光度越大,总还原力越强。按式3 计算总还原力。

式中:A样为样品组的吸光度;A空为空白组的吸光度。
1.3.4 α-葡萄糖苷酶抑制试验
分为样品组、样品背景组、空白对照组、空白对照背景组,加入的试剂按表1 操作。加入样品与α-葡萄糖苷酶后37 ℃反应10 min,再加入PNPG(1 mmoL/L)37 ℃反应30 min,最后加入100 μL Na2CO3(1 moL/L)终止液终止反应[19],在405 nm 波长处测定吸光度。按式4 计算α-葡萄糖苷酶的抑制率,并计算IC50。

表1 裂叶荨麻醇提物对α-葡萄糖苷酶抑制活性测定的加样表Table 1 A sample of the determination of α-glucosidase inhibitory activity by the extract of Urtica

式中:A1为样品背景组吸光度;A2为样品组的吸光度;A3为空白对照组吸光度;A4为空白对照背景组吸光度。
1.4 数据处理
采用origin 8.0 及SPSS 24.0 对数据进行分析,结果以均数±标准误差表示。
2 结果与分析
2.1 裂叶荨麻醇提物中总黄酮含量测定结果
以芦丁的质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,如图1 所示。
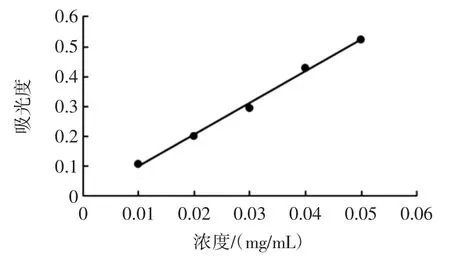
图1 芦丁标准曲线Fig.1 Standrad curve of rutin
由图1 可知,标准曲线方程为y=10.61x-0.008 6,R2=0.995 5,说明芦丁在 100 μg/mL~500 μg/mL 质量浓度范围内与吸光度具有良好的线性关系。试验测得裂叶荨麻醇提物中黄酮的含量为12.09 mg/g。
2.2 裂叶荨麻醇提物体外抗氧化测定结果
2.2.1 裂叶荨麻醇提物对DPPH 自由基的清除能力
裂叶荨麻醇提物对DPPH·的清除率如图2 所示。
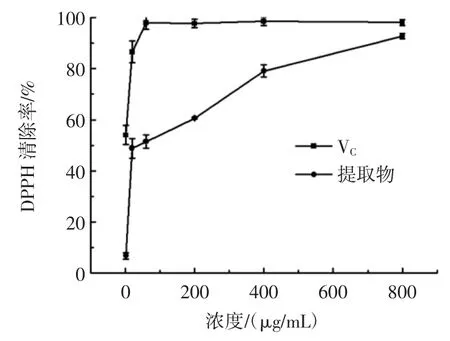
图2 DPPH 自由基清除能力Fig.2 DPPH·free radical scavenging capacity
由图2 可知,裂叶荨麻醇提物(IC50=9.960 μg/mL)对 DPPH 自由基的清除率与 VC(IC50=1.870 μg/mL)的趋势基本一致。在0~100 μg/mL 范围内裂叶荨麻醇提物对DPPH 自由基的清除率随浓度增加的趋势较快,在100 μg/mL~800 μg/mL 范围内随浓度增加的趋势较为缓慢,达到最大值后趋于稳定,最大值可达92.76%,VC对DPPH 自由基的最大清除率为98.61%。由此可以看出,裂叶荨麻醇提物对DPPH 自由基的最大清除率与VC相近,但达到最大清除率时所需浓度是VC的8 倍左右。
2.2.2 裂叶荨麻醇提物对羟基自由基的清除能力
裂叶荨麻醇提物对·OH 的清除率如图3 所示。

图3 羟基自由基(·OH)清除能力Fig.3 Hydroxyl radical scavenging capacity
由图3 可知,裂叶荨麻醇提物(IC50=1.123 mg/mL)对·OH 的清除率与VC(IC50=10.302 μg/mL)的趋势基本一致。在0~4 mg/mL 范围内对·OH 的清除率随浓度的增加基本上呈线性关系,在4 mg/mL~10 mg/mL 范围内,对·OH 的清除率随浓度增加的趋势较为平缓,最大值可达98.05%,VC对·OH 的最大清除率为97.39%,裂叶荨麻醇提物对·OH 的最大清除率与VC基本一致,说明裂叶荨麻醇提物具有较强的·OH 清除能力。
2.2.3 裂叶荨麻醇提物总还原力测定结果
裂叶荨麻醇提物的总还原能力测定结果如图4所示。
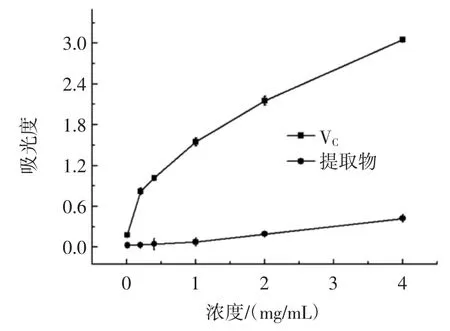
图4 总还原能力Fig.4 The total reducing power
裂叶荨麻醇提物与VC对Fe3+的还原力结果由图4可知,在一定范围内裂叶荨麻醇提物与VC的还原力都是随着浓度的增加而增加,有一定的量效关系,但是在与VC浓度相同时的还原力为VC的5%左右,可能是由于VC是纯净物,而裂叶荨麻提取物中所含化学成分较多,除黄酮外的其他成分影响了总还原力。
2.3 裂叶荨麻醇提物α-葡萄糖苷酶抑制活性测定结果
α-葡萄糖苷酶抑制剂能减少淀粉类分解为单糖的速度,从而降低餐后血糖。裂叶荨麻醇提物对α-葡萄糖苷酶的抑制作用如图5 所示。
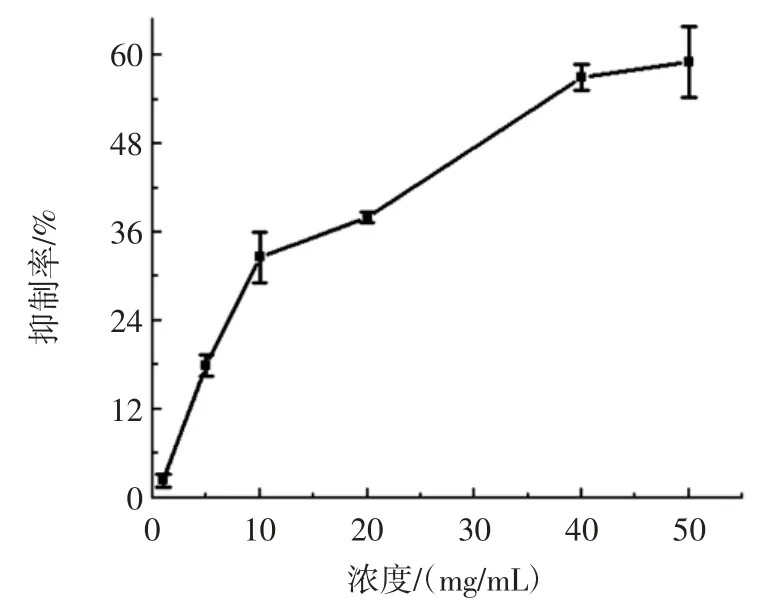
图5 裂叶荨麻醇提取物对α-葡萄糖苷酶的抑制率Fig.5 Inhibitiory effect of extract of Urtica on α-glucosidase
α-葡萄糖苷酶能将淀粉分解为葡萄糖,竞争性抑制其活性可以减少葡萄糖的生成,从而降低血糖值。由图5 可知,裂叶荨麻醇提物对α-葡萄糖苷酶的抑制率在0~40 mg/mL 范围内随浓度的增大而升高,大于40 mg/mL 后抑制率随浓度上升的较为缓慢。在试验所选浓度范围内,裂叶荨麻醇提物对α-葡萄糖苷酶的最大抑制率为59.06%,表明裂叶荨麻醇提物对α-葡萄糖苷酶有一定的抑制作用,提示裂叶荨麻醇提物可能有降糖作用。
3 结论
本文测定了裂叶荨麻醇提物中总黄酮的含量,并对其体外抗氧化作用及对α-糖苷酶的抑制作用进行了研究。经测定,裂叶荨麻醇提物中总黄酮含量为12.09 mg/g,表明醇提物含有一定量黄酮,而已有文献报导黄酮类化合物具有清除自由基的作用[20-21]。体外抗氧化结果表明,裂叶荨麻醇提物对DPPH 自由基的最大清除率为 92.76 %,IC50值为 1.123 mg/mL,VC对DPPH·的最大清除率为 98.61%,IC50值为 1.870 μg/mL;裂叶荨麻醇提物对羟基自由基的最大清除率为98.05%,IC50值为 1.123 mg/mL,VC对·OH 的最大清除率为97.39%,IC50值为 10.302 μg/mL,裂叶荨麻醇提物与VC的总还原力均随醇提物浓度的增加而增强。由试验数据可以看出当裂叶荨麻醇提物浓度升高到一定程度时,对DPPH 自由基及羟基自由基的最大清除率能达到与VC相同的效果,但在相同浓度下,清除率低于VC,总还原力随着浓度的增加而增加,相同浓度时的还原力为VC的5%左右。α-糖苷酶的抑制作用能够影响糖代谢,在本研究所选浓度范围内裂叶荨麻醇提物对α-糖苷酶的最大抑制活性为59.06%,IC50值为31.598 mg/mL。说明裂叶荨麻有一定的抑制α-糖苷酶的能力。本课题组经前期研究表明,裂叶荨麻对糖尿病小鼠的肝脏及肾脏损伤具有保护作用,对血糖指标也有改善[22-23],结合体外α-糖苷酶抑制测定结果,说明裂叶荨麻醇提物具有降糖活性,可能与抑制糖苷酶有关。由此可以看出,裂叶荨麻醇提物具有一定的抗氧化能力及抑制α-糖苷酶活性的能力,药效物质基础可能与黄酮类化合物有关,本研究为体内的抗氧化及降糖研究提供了理论依据,为裂叶荨麻的进一步加工应用提供了新途径。
