百香果籽内生细菌的分离鉴定及生长条件的研究
2020-02-21陈正培吴婉莹梁琳张银向煜吴锦兰熊建文
陈正培,吴婉莹,梁琳,张银,向煜,吴锦兰,熊建文,*
(1.广西科技大学鹿山学院食品与化学工程系,广西柳州545616;2.广西科技大学后勤管理处,广西柳州 545006)
百香果(passion fruit),属于西番莲科,主产于热带和亚热带地区,1913 年引入我国,目前主要种植于台湾、福建、广西、云南等地区[1-2]。百香果具有汁液丰富,香味浓郁的特征,深受人们的喜爱,并享有“果汁之王”的美誉[3-4]。随着食品产业的发展,百香果的利用率得到大幅度的提高,除了食用鲜果以外,还开发出了百香果饮料、百香果果脯、百香果果籽油等产品[5]。目前有较多研究表明,百香果果籽提取物具有多种生物学活性,如Kitada M 等的研究表明,百香果果籽中的白皮杉醇可以通过调节肥胖患者的胰岛素敏感性、血压和心率来促进人体健康[6]。Maruki-Uchida H 等发现百香果中的白皮杉醇具有抗氧化、抗衰老的作用,涂于皮肤上具有保湿和缓解疲劳的的功效,因此在开发抗光老化化妆品具有良好的应用前景[7-9]。
植物内生菌是重要的微生物资源宝库,陆小平等分别从香蕉、柑橘中分离到内生细菌,对常见的植物病原菌具有一定的拮抗作用[10-11]。张爱梅等从沙棘根瘤、温郁金、水稻、樟树、银杏等植物中分离到具有重要生物学活性的内生菌[12-15]。然而,对百香果籽内生菌的研究较少,百香果籽的重要功效成分是否来源于内生菌分泌的次级代谢产物尚不清楚,且内生菌的存在对食用百香果的人群是否产生影响尚不明确。因此,分离鉴定百香果果籽内生菌具有一定的意义。
1 材料与方法
1.1 材料、试剂与仪器
新鲜百香果产于柳州市,主要选择市售紫色百香果。
蛋白胨、酵母提取物:广东环凯微生物有限公司;琼脂粉:北京索来宝生物有限公司;琼脂糖、2×Master Mix、Ⅱ型核酸染料、DNA 提取试剂盒:天根生化试剂(北京)有限公司。
UV-1800 型紫外可见分光光度计:上海美谱达仪器有限公司;BYQ6072 基因扩增仪:杭州博日科技有限公司;Nikon Eclipse E200 光学显微镜:上海衡浩仪器有限公司。
1.2 方法
1.2.1 样品处理
新鲜百香果用去离子水洗净,去果皮和果汁,剥离出果籽,并用无菌水洗涤2 次,再将约30 粒百香果籽放置在无菌培养皿中,然后用20 mL 75%酒精浸泡15 min~20 min,去掉酒精,用无菌水洗涤果籽5 次,取出果籽并置于无菌研钵中,研碎果籽后加入20 mL 无菌生理盐水并混匀,取匀浆液于50 mL 无菌离心管中备用。
1.2.2 内生菌的分离与纯化
在无菌条件下,取100 μL 果籽匀浆液涂布于平板计数琼脂(plate count agar,PCA)固体培养基上,将培养皿放置于28 ℃恒温培养箱中培养16 h~24 h,挑选单菌落,用平板划线法纯化两次,获得候选菌株。
1.2.3 候选菌株的16S r DNA 序列测定
候选菌株接种至LB 液体培养基中,振荡培养过夜后进行菌株DNA 的提取,采用DNA 提取试剂盒提取(方法参考试剂盒说明书)。以DNA 为模板,采用引物16S 27F:5'-AGAGTTTGATCMTGGCTCAG-3' 和 16S 1492R:5'-TCCTCCGCTTATTGATATGC-3'进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,PCR产物送至华大基因生物公司进行测序。
1.2.4 系统进化树的构建
在GenBank 数据库中用BLAST 程序来搜索同源序列,在系统中查出相应微生物,完成鉴定,并挑选与靶序列最相近的参考序列,用于后续系统分析。用软件mega6.0 进行序列同源性分析,以及构建邻接树(neighbor joining,NJ)来进行系统发育分析。
1.2.5 培养基的选择
从平板上挑选候选菌株分别接种到pH 值为7.0的LB 液体培养基9.9 mL、PCA 液体培养基、牛肉膏蛋白胨液体培养基中,28 ℃、200 r/min 恒温振荡培养过夜。然后按1%的接种量接种至对应培养基中,28 ℃、200 r/min 恒温振荡培养12 h,测定菌液浓度(OD600nm)。
1.2.6 最适pH 值的测定
将候选菌株按1 %接种于不同pH 值(1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)的 LB 液体培养基中,在 28 ℃、200 r/min 的条件下培养过夜,测定菌液浓度(OD600nm)。
1.2.7 最适生长温度的测定
将候选菌株按1%接种于pH 值为5.5 的LB 液体培养基中,然后分别置于 15、20、25、30、35、40、45 ℃7 个温度下,200 r/min 恒温振荡培养过夜,测定菌液浓度(OD600nm)。
1.2.8 生长曲线的测定
候选菌株按照1%接种到pH 值5.5 的LB 液体培养基中,在35 ℃、200 r/min 的条件下恒温振荡培养,每隔 2 h 测定其菌液浓度(OD600nm)。
1.2.9 数据的处理和图形的绘制
采用SPPSS 22.0 进行数据处理和Origin 9.1 进行图形的绘制。
2 结果与分析
2.1 内生菌的分离纯化及初步鉴定
2.1.1 分离纯化
利用PCA 固体培养基,对百香果果籽中的内生细菌进行分离,得到的内生细菌形态图见图1。

图1 从百香果果籽中分离的内生细菌Fig.1 Endophyte from passion fruit seed
菌落形态均一,且呈白色。选取3 株特征菌株进行后续研究,并将其命名为GZ11、GZ23 和GZ27。经形态观察,该3 株细菌在LB 培养基上的单菌落呈圆形,乳白色不透明,表面光滑偏湿润,边缘规则,无晕环,菌落型态小,微凸起。
2.1.2 形态特征
从百香果果籽中分离到的内生细菌经革兰氏染色后在光学显微镜下进行观察,细菌形态图见图2。

图2 百香果果籽内生菌镜检结果Fig.2 Microscopic images of endophyte from passion fruit
3 株菌均为球形革兰氏阳性细菌,菌体直径约长1.1 μm~1.5 μm,两端钝圆。
2.2 百香果果籽内生菌的遗传学鉴定
2.2.1 PCR 扩增结果
分别以菌株 GZ11、GZ23、GZ27 的基因组 DNA 为模板,以细菌鉴定通用引物16S rDNA F27 和16S rDNA R1495 进行PCR 扩增,采用1.2%琼脂糖凝胶电泳检测PCR 扩增产物,扩增成功的PCR 产物在1500bp左右处有明显条带,百香果果籽内生菌16S rDNA 的PCR 扩增结果图见图3。

图3 16SrDNA PCR 扩增产物检测电泳图Fig.3 Electrophoresis of PCR products based on 16SrDNA sequence analysis
PCR 扩增结果显示,得到PCR 产物的大小与典型的16S rDNA 片段大小较为一致,可用于测序分析。
2.2.2 百香果果籽内生菌16SrDNA 同源性比对结果
百香果果籽内生菌 GZ11、GZ23、GZ27 的 16SrDNA 序列经测序后,进行同源性比对,同源性见表1 和图4。

表1 16SrDNA 同源性比对结果Table 1 Homological results of lactic acid bacteria by 16SrDNA sequence
3 株受试菌均属于不动杆菌属(Acinetobacter),并将其分别命名为:Acinetobacter sp.GZ11、Acinetobacter sp.GZ23 和 Acinetobacter bouvetii GZ27。
2.3 百香果果籽内生菌培养条件的研究
2.3.1 培养基的选择

图4 菌株系统发育进化树Fig.4 Phylogenetic tree of the bacterium
按方法“1.2.5”分别用LB、PCA 和牛肉膏蛋白胨液体培养基对 Acinetobacter sp.GZ11、Acinetobacter sp.GZ23 和Acinetobacter bouvetii GZ27 进行摇床过夜培养,然后测定其OD600nm值,结果见图5。

图5 培养基的选择Fig.5 Select the preferable medium
从图5 中对比3 株内生菌在该3 种培养基中的生长状况,结果显示3 株内生细菌均呈现LB 培养基>PCA 培养基>牛肉膏蛋白胨培养基的趋势,通过T 检验比较LB 培养基与PCA 培养基之间的差异,P 值为0.000 8<0.01,具有极显著性差异。因此在这3 种常用的细菌培养基中,LB 培养基更适合用于这些百香果果籽内生细菌的培养。
2.3.2 最适pH 值的测定
按方法“1.2.6”分别在不同pH 值的LB 液体培养基中过夜培养菌株Acinetobacter sp.GZ11、Acinetobacter sp.GZ23 和 Acinetobacter bouvetii GZ27,测定 OD600nm下的吸光值,得到菌株生长的最适pH 值见图6。
该3 株内生细菌在pH 5.5~8.0 之间生长较为良好,其最适pH 值为7.0,但在pH 5.0 以下其生长均受到强烈的抑制。由于百香果果浆的pH 值在2.0~3.0 之间,而百香果果籽内生菌的最适pH 值为7.0,这可能是因为百香果果籽表皮阻碍果浆中的酸进入到果籽,为不动杆菌的生长提供良好的微环境。
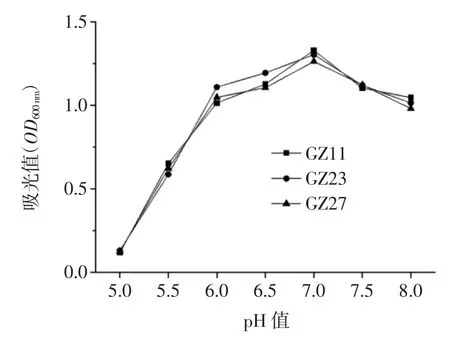
图6 百香果果籽内生细菌最适pH 值的测定Fig.6 Optimal value pH of the bacterium from passion fruit seed
2.3.3 最适生长温度
按方法“1.2.7”分别在不同的温度下,利用LB 液体培养基过夜培养菌株Acinetobacter sp.GZ11、Acinetobacter sp.GZ23 和 Acinetobacter bouvetii GZ27,测定OD600nm下的吸光值,得到菌株的最适生长温度图见图7。
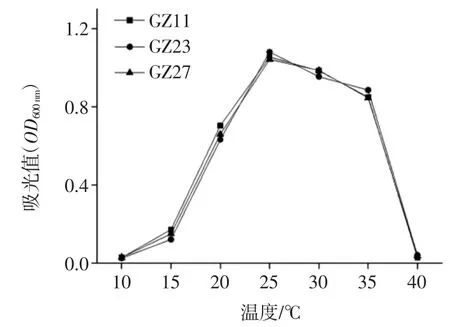
图7 最适生长温度的测定Fig.7 Optimal temperature of the bacterium from passion fruit
该3 株菌在培养温度为20 ℃~35 ℃之间均呈现良好的生长状况,在该范围内其生长受温度变化的影响小,属于中温型细菌,且最适生长温度约为25 ℃。但当温度低于15 ℃或高于40 ℃以上时,其生长受到显著的抑制,即在低温下和在高温下对温度的敏感性明显增强。
2.3.4 生长曲线
按方法“1.2.8”利用LB 培养基分别测定Acinetobacter sp.GZ11、Acinetobacter sp.GZ23 和 Acinetobacter bouvetii GZ27 的生长曲线,每隔2 h 测定OD600nm下的吸光值,得到菌株的生长曲线图见图8。

图8 生长曲线的测定Fig.8 Growth curve of the bacterium from passion fruit
3 株菌均在接种后的6 h 以内生长缓慢,处于适应期,该时期细菌主要进行细胞分裂必需物质的准备;在4 h~16 h 范围内快速生长,处于对数生长期,主要进行细胞分裂;在18 h~20 h 范围内处于平稳期,主要进行次级代谢产物的合成;当接种时间大于20 h 以后,细菌数量逐渐减少,代谢活性降低。
3 讨论与结论
百香果果籽提取物具有多种生物学活性,而这些活性物质是否由内生菌所产生尚不清楚,本文基于生物资源挖掘的目的对百香果果籽内生菌进行了初步探索。利用PCA 培养基对百香果果籽内生细菌进行了分离,结果分离到圆形,乳白色不透明,表面光滑偏湿润,边缘规则,无晕环,菌落型态小,微凸起的菌落。通过分析这些内生菌的16SrDNA 序列,结果发现均属于不动杆菌属(Acinetobacter)。不动杆菌属细菌广泛存在于自然界中,而且功能丰富,是一类重要的生物资源,具有重大的研究价值。刘兴凯等[16]对一株具有琼胶酶的不动杆菌进行了研究,琼胶酶可催化琼胶转化为琼胶寡糖,获得的琼胶寡糖具有抑菌、抗衰老、抗淀粉老化、增强免疫和保湿美白等生物活性,在新功能性食品、新药和高端化妆品的研发领域有较好的应用前景。朱婷婷等[17]分离鉴定出一株苯并芘降解不动杆菌,该菌株用于处理石油污染的土壤或者焦化废水中的苯并芘,在环保方面具有重要的意义。刘玉华等筛选出了降烷烃、石油烃、塑化剂等的不动杆菌[18-21]。百香果果籽具有多种生物学活性的特征,因此鉴定百香果内生菌为研究百香果果籽生物活性物质的来源奠定了基础。
