菌株和培养基质对虫草菌质主要营养成分和活性成分的影响
2020-02-21杨宗渠李长看雷志华曲金柱李坤陶孔庆寒罗青
杨宗渠,李长看,雷志华,曲金柱,李坤陶,孔庆寒,罗青
(1.郑州师范学院生命科学学院,河南郑州450044;2.河南省涉鸟故障工程技术研究中心,河南郑州450044;3.郑州师范学院生物物种资源研究中心,河南郑州450044)
冬虫夏草是我国特有的名贵中药资源,是由冬虫夏草菌(Cordyceps sinensis)侵染鳞翅目蝙蝠蛾幼虫后发育而成的由子座和菌核组成的菌体,具有补肺益肾、止血、化痰等功效。冬虫夏草含有腺苷、虫草素、虫草多糖、虫草酸、甾醇类物质,及多种氨基酸、维生素和矿物质元素[1]。现代医学研究表明,冬虫夏草有抗肿瘤、抗菌、抗氧化、抗衰老、降血压、调节内分泌、提高免疫力、镇静、抗心肌缺血以及调节心率等功效[2]。冬虫夏草的生长对寄主和环境条件的要求非常严苛,主要生长在高海拔雪域地区,产量很低。市场对冬虫夏草的需求量日益增加,价格飙升,造成对冬虫夏草的肆意采挖,使这一珍贵的野生物种资源濒临灭绝。在冬虫夏草人工培育技术尚未成熟的情况下,通过发酵法生产冬虫夏草菌丝体,以菌丝体活性成分替代天然冬虫夏草的药用价值受到人们的关注[3]。王尊生等[4]分析了冬虫夏草菌丝体固体发酵粉的化学成份,指出虫草发酵粉中3′-脱氧腺苷,甘露醇的含量明显高于冬虫夏草,其它化学成份和冬虫夏草相应成份基本一致。陈建国等[5]对冬虫夏草菌丝体进行了安全性毒理学评价,证实冬虫夏草菌丝体属无毒级。韦会平等[6]用蛹虫草为发酵菌株、大米为基质生产虫草素,经过约13 d的培养,培养基中虫草素达到0.60%,比传统液体发酵方法的最高产量高出近2 倍。吴彩琴等[7]以豆粕和米糠为培养基质,采用固体发酵生产冬虫夏草多糖,在适宜的工艺条件下,菌质中多糖含量达到16.991 mg/g。由于试验菌株和发酵基质的不同,文献报道的固体发酵工艺条件和活性成分产率差别较大。本文以小麦为发酵基质,通过固体发酵培养虫草菌丝体,分析菌质中活性成分和主要营养成分的含量,从而找出活性成分含量高的虫草菌株和固体培养基质,为虫草固体发酵提供依据。
1 材料与方法
1.1 材料
1.1.1 试验菌株
试验的虫草菌株分别由广东省微生物研究所和河南农业大学提供,编号分别为ZNB2.1 和ZNB2.2。
1.1.2 试剂
葡萄糖:天津市天力化学试剂有限公司;苯酚:天津市北联精细化学品开发有限公司;浓硫酸:广州万从化工有限公司;氯化钙:无锡市亚泰联合化工有限公司;碘:天津市津北精细化工有限公司;二甲基亚砜(分析纯):天津市申泰化学试剂有限公司。
1.1.3 仪器与设备
LDZX-50FB 型高压蒸汽灭菌锅:上海申安医疗器械厂;DH-420 型电热恒温培养箱:北京科伟永兴仪器有限公司;TU-1901 紫外可见分光光度计:北京普析通用仪器有限责任公司;Resesrch plus 移液器:德国Eppendorf 公司。
1.2 方法
1.2.1 培养基质的制备
用清水将麦粒清洗2 遍,浸泡12 h 后捞出,放入锅中加热直至锅内水沸腾,煮沸20 min,待麦粒充分吸水膨胀但不开裂时捞出,沥去多余的水分。然后将麦粒摊晾至麦粒表面无水分,配制成5 种培养基质。A:小麦100%;B:小麦50%、燕麦30%、玉米20%;C:小麦50 %、燕麦30 %、糙米 10 %、谷子10 %;D:小麦50%、燕麦30%、荞麦5%、高粱 5%、玉米10%;E:小麦50%、燕麦30%、糙米5%;玉米8%、高粱7%。将不同配方的培养基质分装于500 mL 菌种瓶中,每瓶装干料150 g,121 ℃下杀菌2 h。每个配方4 次重复。
1.2.2 接种和培养
在无菌条件下,将虫草母种接种到经过高压杀菌的培养基质上,接种后的菌种瓶置于25 ℃的恒温培养箱中进行避光培养。
1.2.3 虫草多糖含量测定
1.2.3.1 葡萄糖标准曲线的制作
取105 ℃烘干至恒重的葡萄糖20 mg 放入小烧杯中,加蒸馏水溶解,然后转至500 mL 容量瓶中,加水定容,即为40 μg/mL 的葡萄糖标准液。分别取40 μg/mL的葡萄糖溶液 0、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL至编号为0~8 的9 支20 mL 具塞试管中,各加蒸馏水1.8 mL,6%的苯酚溶液1.6 mL 以及浓硫酸7.5 mL,摇匀,静置 10 min,再摇匀,(23±2)℃放置 20 min 后,每组设3 个平行样品,用紫外分光光度计在490 nm 波长测定样品吸光度。横坐标为葡萄糖微克数,纵坐标为吸光度,用excel 软件制作葡萄糖标准曲线。
1.2.3.2 样品提取液的制备
精确称取烘干粉碎的菌质样品放入100 mL 烧杯中,分别加入50 mL 的蒸馏水,85 ℃水浴加热浸提2 h,连续提取3 次。合并滤液用蒸馏水定容至100 mL。
1.2.3.3 去淀粉处理
将固体菌质用粉碎机打成细末状,然后称取样品粉末放入50 mL 烧杯中。向烧杯中分别添加4 mL 3 mol/L 的CaCl2溶液,然后将烧杯放入85 ℃的水浴锅中加热,用玻璃棒搅拌10 min 促进溶解,使淀粉糊化。取出烧杯,再分别向烧杯中添加15 mL 6 mmol/L 的I2-DMSO 溶液,溶解淀粉,放入85 ℃的恒温水浴锅中,加热30 min。将烧杯里的样品倒入离心管中,放入离心机中,转速3 000 r/min,离心5 min。取出离心管,倒掉上清液,取出离心管底部的沉淀放入烧杯中,向烧杯中分别添加4 mL 的CaCl2溶液,置85 ℃的恒温水浴锅里,进行第2 次去淀粉,再制备样品提取液,提取,定容,稀释2 倍,装于50 mL 容量瓶中。
1.2.3.4 样品多糖含量的测定
分别从50 mL 的容量瓶中用移液枪取0.2 mL 提取液至10 支20 mL 具塞试管中,另准备一支20 mL 具塞试管作为对照,向11 支具塞试管中加蒸馏水补至1.8 mL。分别加1.6 mL 的6%的苯酚溶液和7.5 mL 的浓硫酸至20 mL 具塞试管中,摇匀,静置10 min;再次摇匀,(23±2)℃放置 20 min 后,于 490 nm 测定吸光度。
样品多糖含量/(mg/g)=[提取液的多糖含量(μg)×稀释倍数×100]/[样品干重(g)×1 000]
1.2.4 虫草素含量测定
称取2.00 g 粉碎的样品于离心管中,加入15 mL的蒸馏水,在50 ℃水浴中超声60 min,离心取上清液;再向离心管中加入5 mL 的蒸馏水,混合均匀,水浴超声30 min,离心取上清液;然后再加入5 mL 蒸馏水,混匀水浴超声30 min,离心取上清液,将3 次离心的上清液合并,用蒸馏水定容25 mL,过滤膜进样测定,若浑浊再次离心后过滤膜。色谱柱为C18(4.6 mm×250 mm,5 μm),柱温 35 ℃,流动相为水与乙腈体积比为 90 ∶10,流速 1.0 mL/min,进样量 20 μL,波长 260 nm。
1.2.5 虫草酸含量测定
提取过程与虫草素测定相同。色谱柱C18(4.6 mm×250mm,5μm),柱温35℃,流动相为水,流速0.6 mL/min,进样量20 μL,检测器为示差检测器。
1.2.6 营养成分含量测定
1)还原糖:GB/T 5009.7-2016《食品中还原糖的测定》直接滴定法。
2)蛋白质:GB/T 5009.5-2016《食品中蛋白质的测定》凯氏定氮法。
3)脂肪:GB/T 5009.6-2016《食品中脂肪的测定》酸水解法。
4)淀粉:GB/T 5009.9-2016《食品中淀粉的测定》酸水解法。
2 结果与分析
2.1 葡萄糖标准曲线
测定葡萄糖含量,标准曲线如图1 所示。以葡萄糖质量为横坐标,吸光度值为纵坐标,得到回归方程y=0.004 9x+0.021 9,R2=0.986 6。

图1 葡萄糖含量标准曲线Fig.1 Standard curve of glucose content
2.2 不同菌质中虫草多糖含量
培养基质是虫草菌丝体生长的基础,基质的成分和原料配比直接影响菌丝的生长,进而影响次生代谢产物的形成。不同菌质的虫草多糖含量见表1。
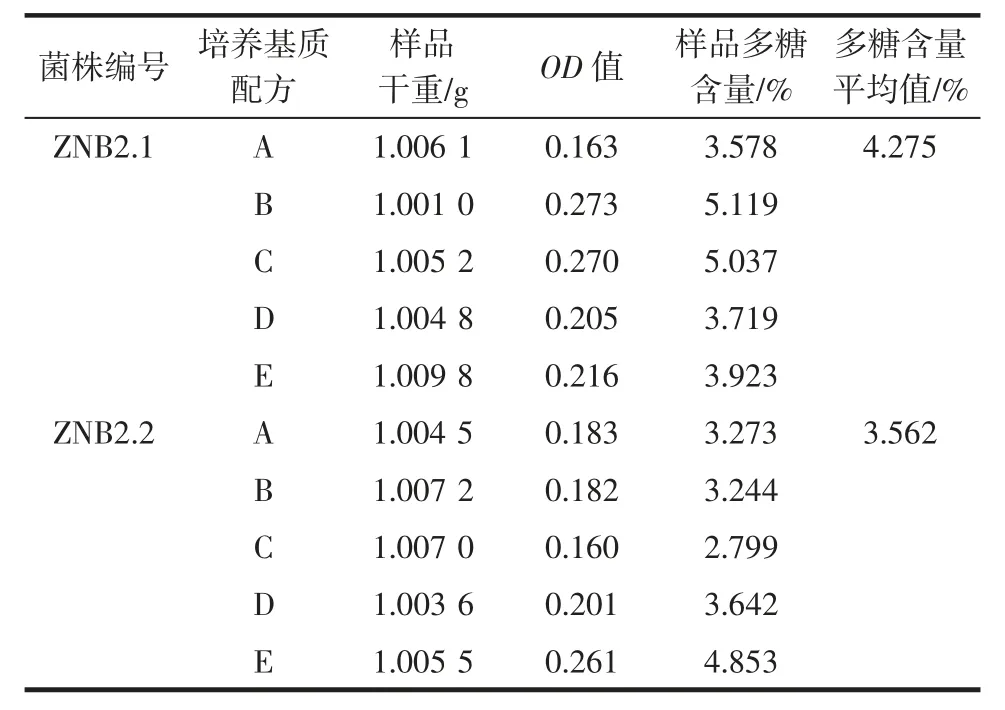
表1 不同菌质的虫草多糖含量Table 1 Cordyceps polysaccharide content of different fungal substance
由表1 可以看出,2 个菌株在5 种不同配方的培养基质上的多糖产率不同,菌株ZNB2.1 在B 和C 培养基质中的多糖产率较高,分别为5.119%、5.037%,A培养基质中的多糖含量最低,仅为3.578 %。菌株ZNB2.2 在E 培养基质中的多糖含量最高,达到4.853%,在C 培养基质中的多糖含量最低,为2.799%。由表1还可知,菌株ZNB2.1 在5 种培养基质中多糖含量的平均值大于菌株ZNB2.2,说明ZNB2.1 产生多糖的能力大于ZNB2.2。
2.3 去淀粉处理的多糖含量的影响
据文献报道,测定菌质的多糖含量时,菌质中的剩余淀粉,特别是被虫草菌丝降解而产生的小分子淀粉,会使多糖的测定值提高,增大试验误差[8]。为减小菌质中淀粉对虫草多糖测定的干扰,采用二甲基亚砜去除残留淀粉后,再测定虫草多糖含量。样品经去淀粉处理后,虫草多糖含量测定结果见表2。
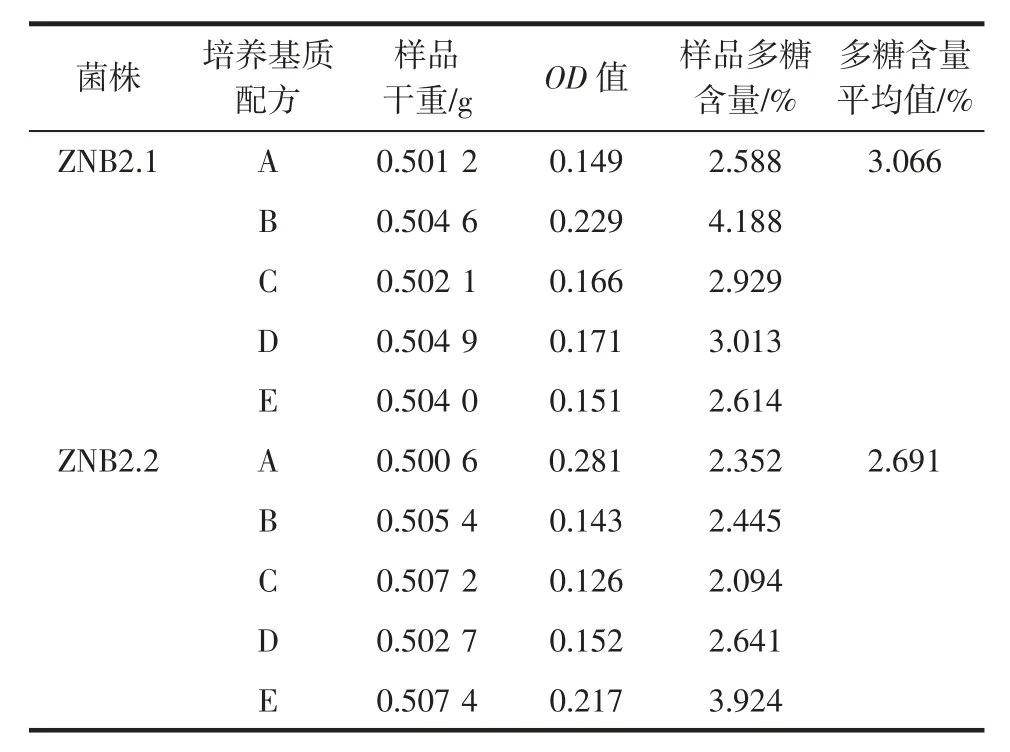
表2 去淀粉后的菌质中虫草多糖含量Table 2 Cordyceps polysaccharide content of fungal substance after starch removal
由表2 可知,去淀粉后10 个菌质样品的多糖含量都比去淀粉前降低,ZNB2.1 菌株5 种培养基质的菌质多糖含量由3.578 %~5.119 %降至2.588 %~4.188%,ZNB2.2 菌株5 种培养基质的菌质多糖含量则由2.799%~4.853%降至2.094%~3.924%。
5 种培养基质中,ZNB2.1 在B 培养基质中产生的多糖最多,菌质多糖含量最高,为4.188%,在A 培养基质中形成的多糖最少,菌质多糖含量最低,为2.588%。ZNB2.2 在E 培养基质中的多糖产率最高,菌质多糖含量达到3.924 %,C 培养基质中的多糖含量最低,为2.094%。由表 2 还可知,去淀粉后,ZNB2.1 在 5 种培养基质菌质的多糖含量平均值依然大于ZNB2.2。无论是去淀粉前还是去淀粉后,ZNB2.1 在5 种培养基质中多糖含量的平均值都大于菌株ZNB2.2。
2.4 不同菌株的菌质中主要营养成分及活性成分的影响
发酵前后基质的营养成分变化和活性成分含量见表3。
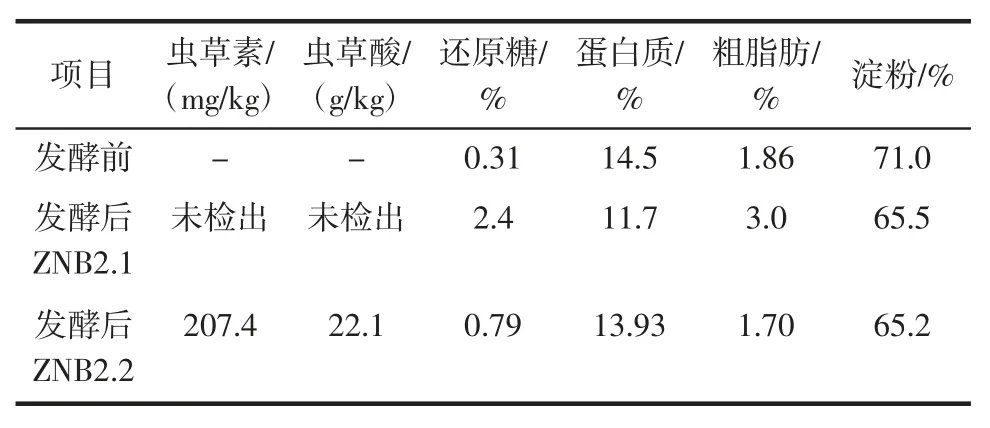
表3 发酵前后基质的营养成分变化和活性成分含量Table 3 Changes of nutritional components and contents of active components in substrates before and after fermentation
虫草菌丝体在生长过程中,从培养基质中吸取营养,完成生长代谢过程,产生活性成分,同时使基质的营养成分发生变化。将2 个菌株分别接种到基质E上,发酵结束后测定菌质的主要营养成分及活性成分含量,可以发现基质经过2 个虫草菌株发酵后,其营养成分发生了变化,均表现为还原糖含量增高,淀粉和蛋白质含量降低。ZNB2.2 菌株在发酵过程中,产生虫草素和虫草酸,菌质中生活性成分虫草素和虫草酸的含量分别达到207.4 mg/kg 和22.1 g/kg,而ZNB2.1 菌质中未检测到虫草素和虫草酸。说明虫草菌丝体固发酵可产生虫草素和虫草酸,产生活性成分的能力因菌株而异。
3 结论与讨论
菌株ZNB2.1 和ZNB2.2 分别在基质B 中和基质E中的多糖产率最高,ZNB2.1 产生虫草多糖的能力大于ZNB2.2。对菌质样品进行去淀粉处理,可减小残留淀粉对虫草多糖测定的干扰。基质经过虫草固体发酵后,还原糖含量增高,淀粉和蛋白质含量降低。ZNB2.2 菌株的菌质中虫草素和虫草酸的含量分别达到207.4 mg/kg和22.1 g/kg,而ZNB2.1 菌质中未检测到虫草素和虫草酸。虫草菌丝体固发酵产生活性成分的能力因菌株而异,综合考虑虫草多糖、虫草素和虫草酸的产率,虫草固体发酵宜选用ZNB2.2 菌株和基质E。
庄毅等以槐耳菌为发酵菌种、中药材黄芪为发酵基质进行双向固体发酵,即基质为槐耳菌生长提供所需营养,槐耳菌产生新的活性成分,而基质的原有成分因真菌分泌的酶的作用发生变化,槐耳菌丝体、活性成分和黄芪基质共同构成药性菌质,从而产生新的性味功能,具有比该真菌或药性基质本身或两者简单相加更好的药效[9]。本研究选用虫草为发酵菌种、小麦为发酵基质进行双向固体发酵,虽然基质中的淀粉和蛋白质等营养成分被菌丝分解而减少,但菌质中生成了虫草的活性成分——虫草多糖、虫草素和虫草酸,菌质可用于开发营养保健食品。该双向固体发酵研究为小麦的精深加工提供了一条新途径。薛俊杰等报道,虫草素的分泌与菌株特性有密切关系,并不与菌株的长势直接相关[10]。孙军德等通过5 个虫草菌株的菌丝生长速率和培养基中活性物质含量的对比研究,发现不同虫草菌株的菌丝生长速率、虫草多糖和虫草素地含量不同[11]。刘艳芳等对19 个虫草属菌株的菌丝体中活性成分进行了分析,结果表明不同菌株菌丝体虫草素含量差异显著[12]。本试验中不同虫草菌株产生活性成分的能力不同,与文献[10-12]的研究结果一致。另据报道,虫草菌丝的培养条件直接影响菌质中活性成分的含量,为提高虫草多糖、虫草素和虫草酸等活性物质的产率,需要对虫草双向固体发酵的培养条件进行更深入的研究。
