虎纹蛙肠道微生物结构与功能分析
2020-02-21刘文舒陈彦良郭小泽唐艳强肖海红李思明
刘文舒 陈彦良 郭小泽 唐艳强 肖海红 李思明
(江西省农业科学院畜牧兽医研究所,南昌,330200)
肠道微生物是动物肠道内栖息的微生物群落,这些微生物细胞的数量和基因数量都远远超过宿主本身[1]。肠道微生物与宿主营养、代谢、免疫和疾病等密切相关[2-3]。近年来,宿主肠道菌群研究成为热点之一。
虎纹蛙(Ranarugulosa)属于无尾目(Anura)、蛙科(Ranidae)、蛙属的两栖动物,在我国分布较广。因其体型大、味道鲜美,长期被乱捕滥杀,加上生态环境的恶化,虎纹蛙数量剧减,现已列为国家Ⅱ级重点保护野生动物。为满足市场需求,中国南方地区虎纹蛙人工养殖发展迅速,但高密度养殖模式下腐皮病、肠胃炎、白内障病、红腿病和烂鳃病等细菌性疾病频发[4-5],造成极大损失。本研究对成体虎纹蛙不同肠道部位,通过高通量测序技术对其微生物进行研究,探索其肠道微生物结构和功能差异,分析潜在病原菌和益生菌种类,为虎纹蛙健康养殖提供理论基础。
1 材料与方法
1.1 样本来源
5只虎纹蛙活体(142.67±10.83)g取自江西省进贤县某虎纹蛙养殖场。在无菌超净工作台内,从枕骨大孔插针快速处死,解剖,迅速取出完整肠道,按照李庆等[6]方法分离前肠、中肠和后肠,内容物和肠道组织一起匀浆用于微生物DNA的提取。
1.2 DNA提取
使用HiPure Stool DNA Kits(美基生物,广州,中国),按说明书提取虎纹蛙肠道样品的总基因组DNA。
1.3 PCR扩增及回收
采用带有8个碱基标记的特异引物(341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT)针对16S rDNA V3-V4 区进行扩增,进行聚合酶链式反应PCR扩增,PCR扩增反应条件95 ℃预变性2 min,98 ℃变性10 s,62 ℃退火30 s,68 ℃延伸30 s,27个循环,最后68℃再延伸10 min。PCR反应体系如下:5 μL 10×KODbuffer,5 μL 2.5 Mm dNTPs,5 μM引物各1.5 μL,1 μL KOD聚合酶,100 ng DNA模板,加ddH2O补齐至50 μL,每个样品3个重复。随后,扩增子用2%琼脂糖进行切胶回收,利用GeneJRT胶回收试剂盒(Thermo Scientific,上海,中国)纯化扩增子。
1.4 文库构建和高通量测序
纯化后的扩增子按照等质量混合后,使用Thermofisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。
1.5 测序数据分析
使用Cutadapt(V1.9.1,http://cutadapt.readthe- docs.io/en/stable/)[7]得到有效序列后,利用Uparse软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)[8]对所有样品的有效序列进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),使用QIIME[9]进行结构和多样性分析,使用PICRUSt软件进行功能预测分析[10]。
1.6 统计分析
通过Turkey检验分析组间物种多样性和结构差异性。
2 结果与分析
虎纹蛙前肠(HF)、中肠(HM)和后肠(HD)15个样品共得到有效读长1 188 162条,平均每个样品79 120条,统计每个样品的OTUs数量,所有样品测序覆盖度99.7%以上,表明测序比较真实反映各样品的微生物组成(表1)。图1展现3组样品共有和特有OTU数目,HF组OTU数目为2 879个,HM组OTU数目为2 874个,HD组OTU数目为1 151个,其中3组共有的OTU数目为851个,HF和HM组共有的OTU数目为1 998个,HF和HD组共有的OTU数目为924个,HM和HD组共有的OTU数目为968个,HF组特有的OTU为808个,HM组单独有的OTU数为759,RD组单独有的OTU数为110。
表1 样品OTUs
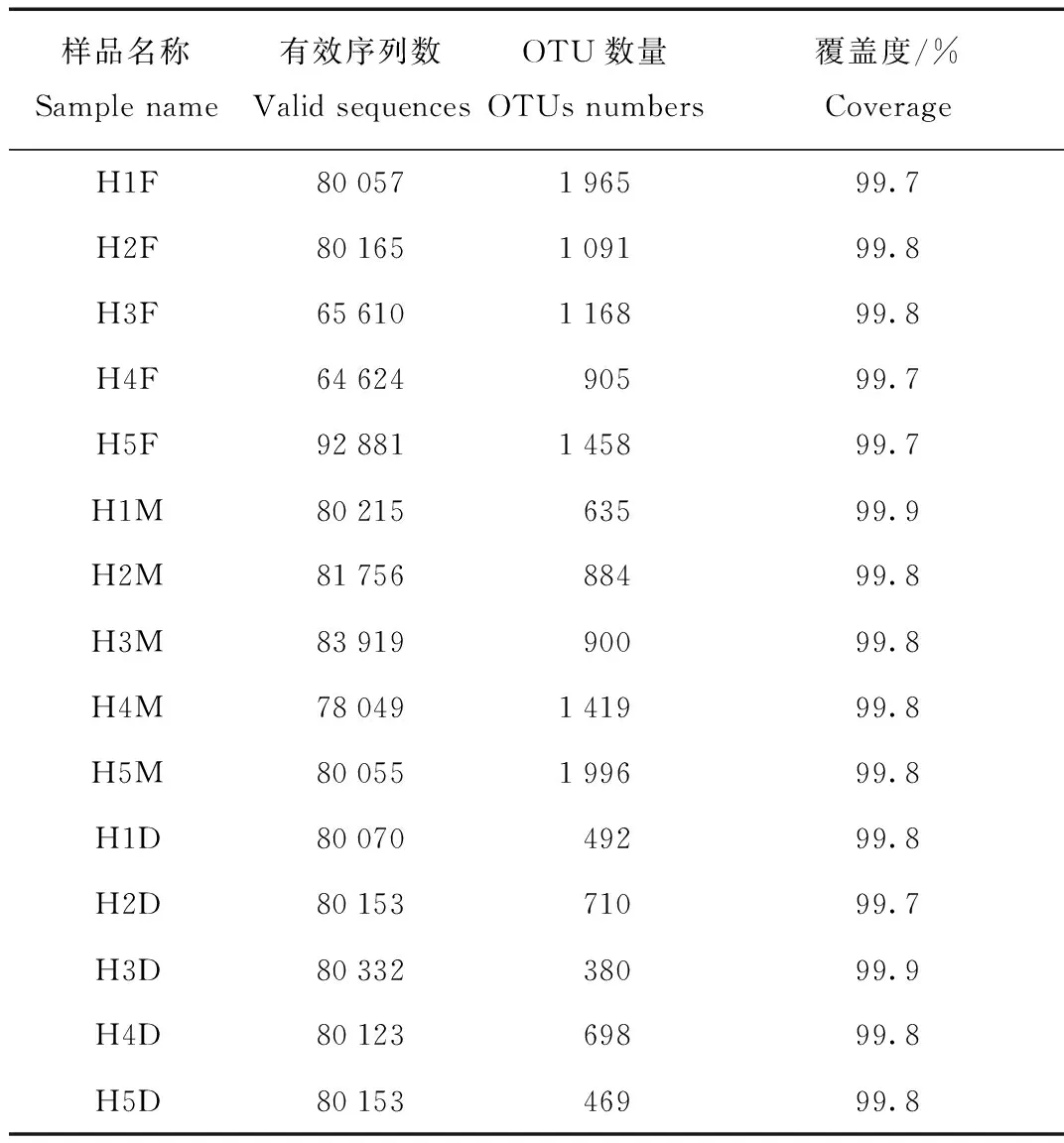
Tab.1 OTUs of each sample
2.1 虎纹蛙肠道菌群整体结构分析
2.1.1 门水平结构分析
全部样品共鉴定出优势菌群10个,为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)、螺旋体门(Spirochaetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、脱铁杆菌门(Deferribacteres)和产氧光细菌门(Oxyphotobacteria)(图2)。核心菌群为厚壁菌门、变形菌门、拟杆菌门和梭杆菌门。
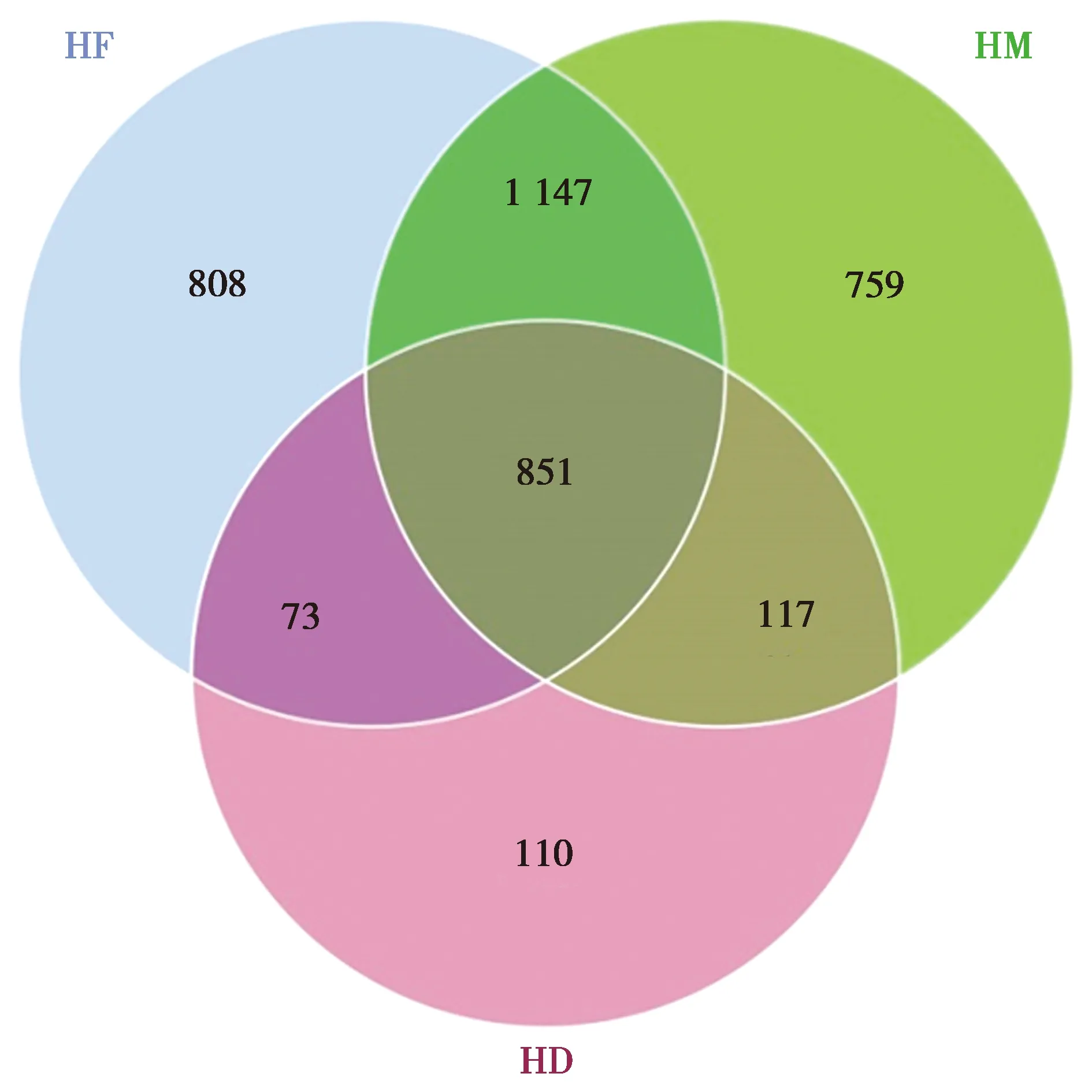
图1 OTUs 韦恩图Fig.1 OTUs venn chart
2.1.2 属水平结构分析
对虎纹蛙肠道菌群中丰度最高的10个属进行统计(图3)。虎纹蛙肠道中优势菌属有Romboutsia属、鲸杆菌属(Cetobacterium)、叶杆菌属(Phyllobacterium)、未鉴定的梭菌(unidentified_Clostridiales)、不动杆菌属(Acinetobacter)、鞘氨醇单胞菌(Sphingomonas)、拟杆菌属(Bacteroides)、阿里叶柄属(Alistipes)、邻单胞菌属(Plesiomonas)和短螺旋体属(Brachyspira)。Romboutsia、鲸杆菌属和叶杆菌属是核心菌属。从图上看,在相同肠道区域,不同个体肠道微生物在属水平上差异较大。
2.1.3 属水平系统进化树分析
选取丰度前100的属作为代表序列构建而成的物种系统进化树,反映了物种的进化关系。在进化树中距离越近,表明物种系统关系越近,图中树枝的不同长度代表了物种进化的差异。进化树中颜色相同的属归属于同一菌门,共有12个菌门和不能鉴定细菌,其中占比例最高的是变形菌门有31个属,潜在病原菌弧菌(Vibro)、邻单胞菌、气单胞菌(Aeromonas)和爱德华氏菌(Edwardsiella)亲缘关系较近,不动杆菌和假单胞菌(Pseudomonas)亲缘关系较近;其次厚壁菌门有24个属,其中Romboutsia属和未鉴定的梭菌(unidentified_Clostridiales)在各样品中出现频率最高,芽孢杆菌(Bacillus)、片球菌(Pediococcus)和乳酸杆菌(Lactobacillus)等潜在益生菌亲缘关系较近;梭杆菌门中的鲸杆菌属出现频率较高,且与厚壁菌门菌属亲缘关系较近;拟杆菌门有17个菌属,发现蛙类常见脑膜炎致病菌伊丽莎白菌(Elizabethkingia)在部分样品中出现;放线菌门有13个菌属,潜在益生菌双歧杆菌(Bifidobacterium)在部分样品中出现。
2.2 不同肠道部位菌群差异分析
2.2.1 α多样性分析
发现前肠和中肠的物种数(observed_species)、Chao1指数、ACE指数均显著高于后肠(P<0.05),而前肠-中肠组间无显著差异(P>0.05)。Shannon和Simpson指数在3组间均无显著差异(P>0.05)。

图2 门水平上物种相对丰度Fig.2 The relative abundance of species on the phylum level
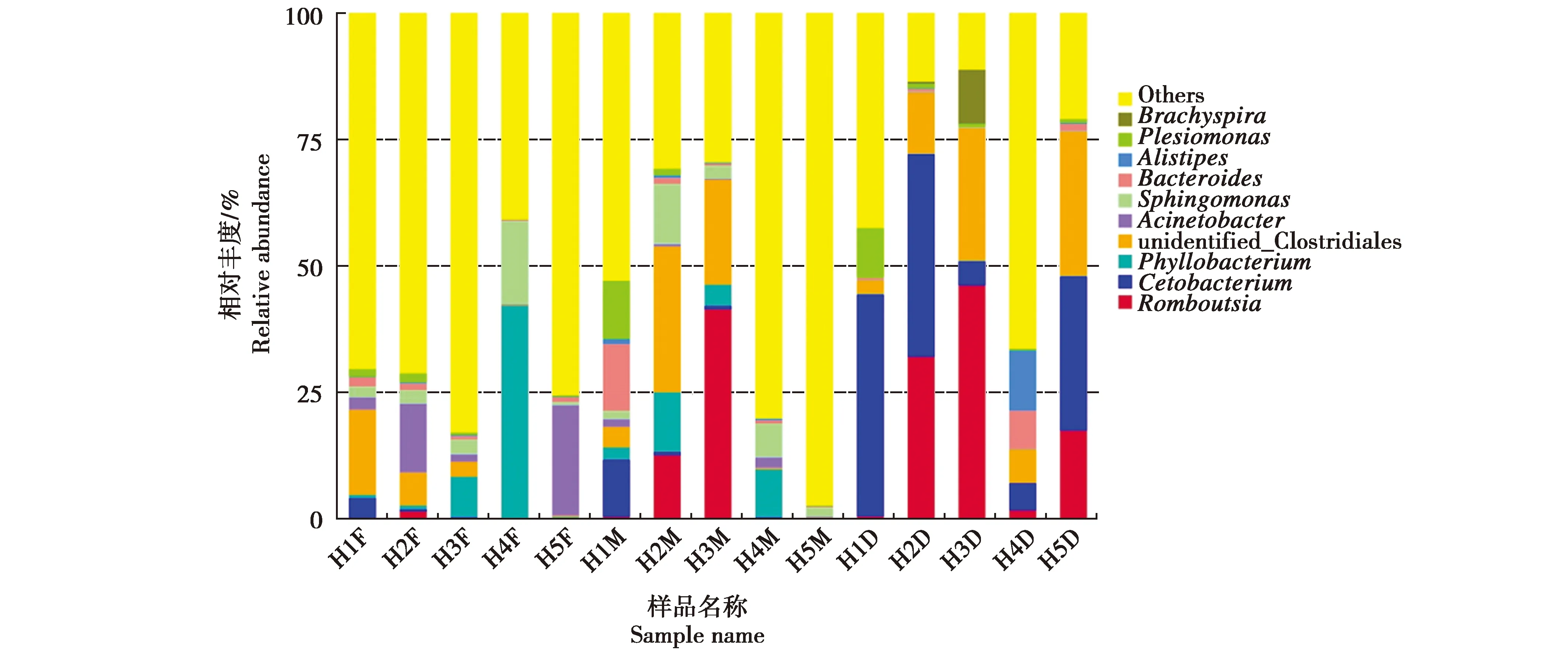
图3 属水平物种相对丰度Fig.3 The relative abundance of species on the genus level

图4 物种系统进化树Fig.4 Genus species phylogeny tree
表2 不同肠道区域微生物α生物多样性统计分析
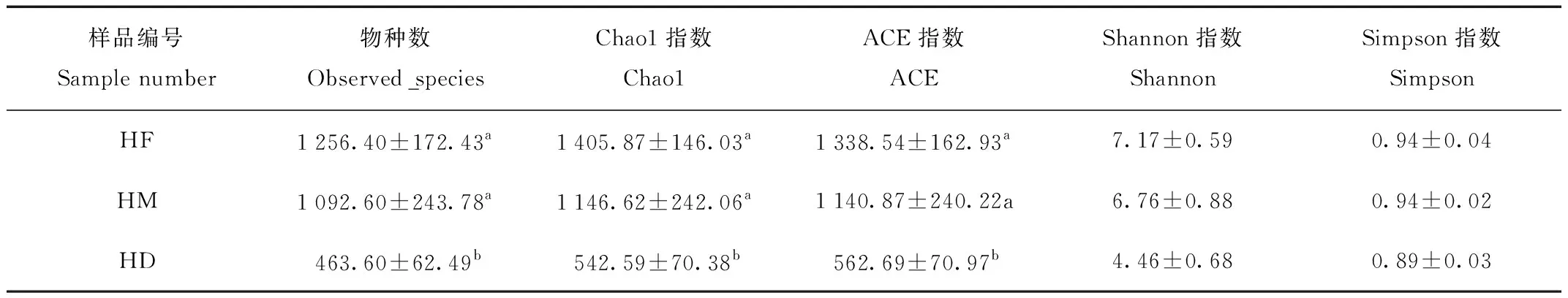
Tab.2 Statistics analysis of α diversity among different intestine regions
注:数据标有不同字母表示显著差异(P≤0.05)
Note:Data marked different superscript means significant differences existed(P≤0.05)
2.2.2 降维分析
主坐标分析(PCoA,Principal Co-ordinates Analysis)和无度量多维标定法(NMDS,Non-Metric Multi-Dimensional Scaling)是根据样品信息,以点的形式反映在二维平面上,如果样本距离越接近,表示物种组成结构越相似,因此群落结构相似度高的样本倾向于聚集在一起,群落差异很大的样本则会远远分开。PCoA和NMDS分析结果显示前肠和后肠样本分布在不同的区域,微生物群落结构相似度低,中肠样本分布在前肠与后肠之间,表明微生物结构介于两者之间(图5)。
2.2.3 门水平上结构差异分析
虎纹蛙不同肠道部位菌群门水平结构如图6。统计发现有7个菌门相对丰度存在显著差异(表3)。前肠厚壁菌门和梭杆菌门相对丰度显著低于中肠和后肠(P<0.05),中肠与后肠间差异不显著(P>0.05);后肠变形菌门、放线菌门、酸杆菌门、绿弯菌门和产氧光细菌门相对丰度显著低于前肠和中肠(P<0.05),前肠与中肠间差异不显著(P>0.05)。
2.2.4 属水平结构差异分析
虎纹蛙不同肠道部位菌群属水平结构见图7。统计发现后肠Romboutsia属相对丰度显著高于前肠,鲸杆菌属相对丰度显著高于前肠和中肠,叶杆菌属相对丰度显著低于前肠和中肠(P<0.05)。
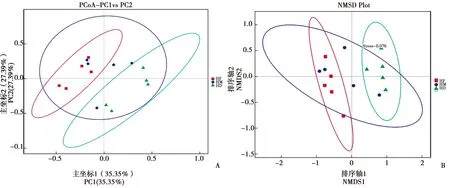
图5 不同样品的PCoA(A)分析和NMDS(B)排序图Fig.5 PCoA(A)analysis and NMDS(B)ordination diagram of different samples
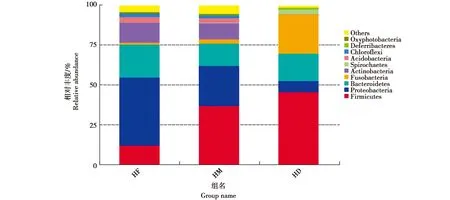
图6 不同肠道部位在门水平上的物种相对丰度Fig.6 The relative abundance of different section of gut at the phylum level
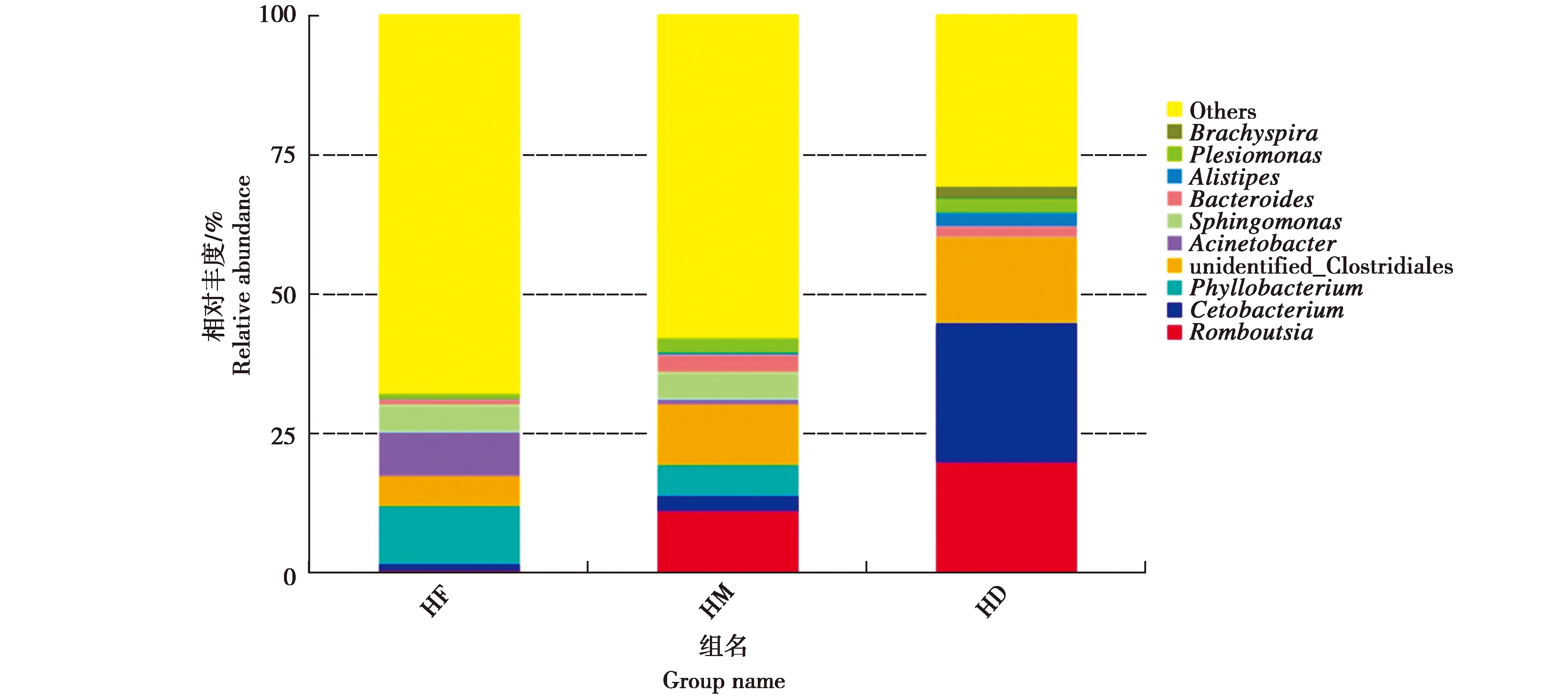
图7 不同肠道部位在属水平的物种相对丰度Fig.7 The relative abundance of different section of gut at the genus level
表3 不同肠道部位在门水平的物种相对丰度差异统计

Tab.3 Statistic analysis of the relative abundance of different section of gut on the phylum level %
注:数据标有不同字母表示显著差异(P≤0.05)
Note:Data marked different superscript means significant differences existed(P≤0.05)
2.3 肠道菌群功能预测
根据样品在数据库中的功能注释及丰度信息,选取丰度排名前 35的功能及它们在每个样品中的丰度信息绘制热图(图8)。总体上看,前肠和中肠微生物功能相近,与后肠差异较大。在代谢功能上,前肠和中肠中与能量代谢、萜类和聚酮化合物代谢、氨基酸代谢、脂代谢、次级代谢、外源物质降解和代谢关联微生物丰度较高,而后肠中与核酸代谢、碳水化合物代谢关联微生物丰度较高。前肠和中肠中与信号转导、神经系统、内分泌系统、转运和分解等关联微生物丰度较高,后肠中与信号分子互作、细胞过程与信号、增殖与修复、翻译、转录、酶家族、环境适应、膜转运等关联微生物丰度较高。
表4 不同肠道部位在属水平上的物种相对丰度差异统计
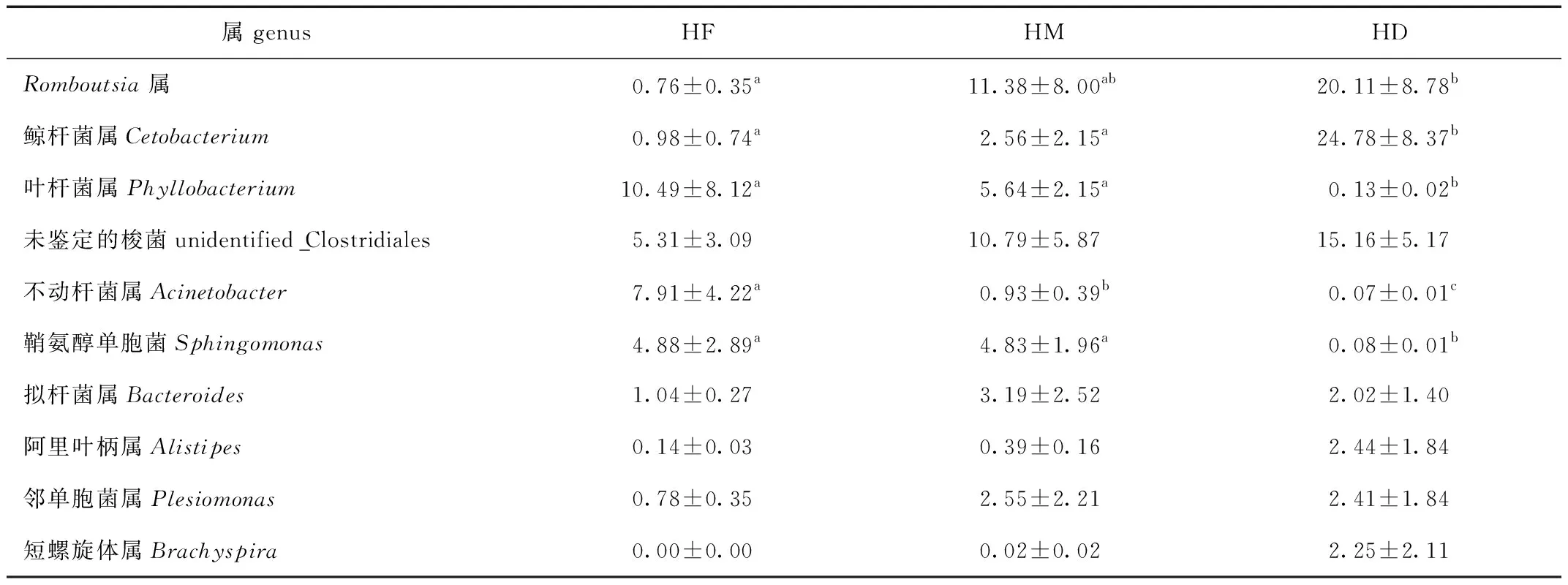
Tab.4 Statistic analysis of the relative abundance of different section of gut on the genus level %
注:数据标有不同字母表示显著差异(P≤0.05)
Note:Data marked different superscript means significant differences existed(P≤0.05)
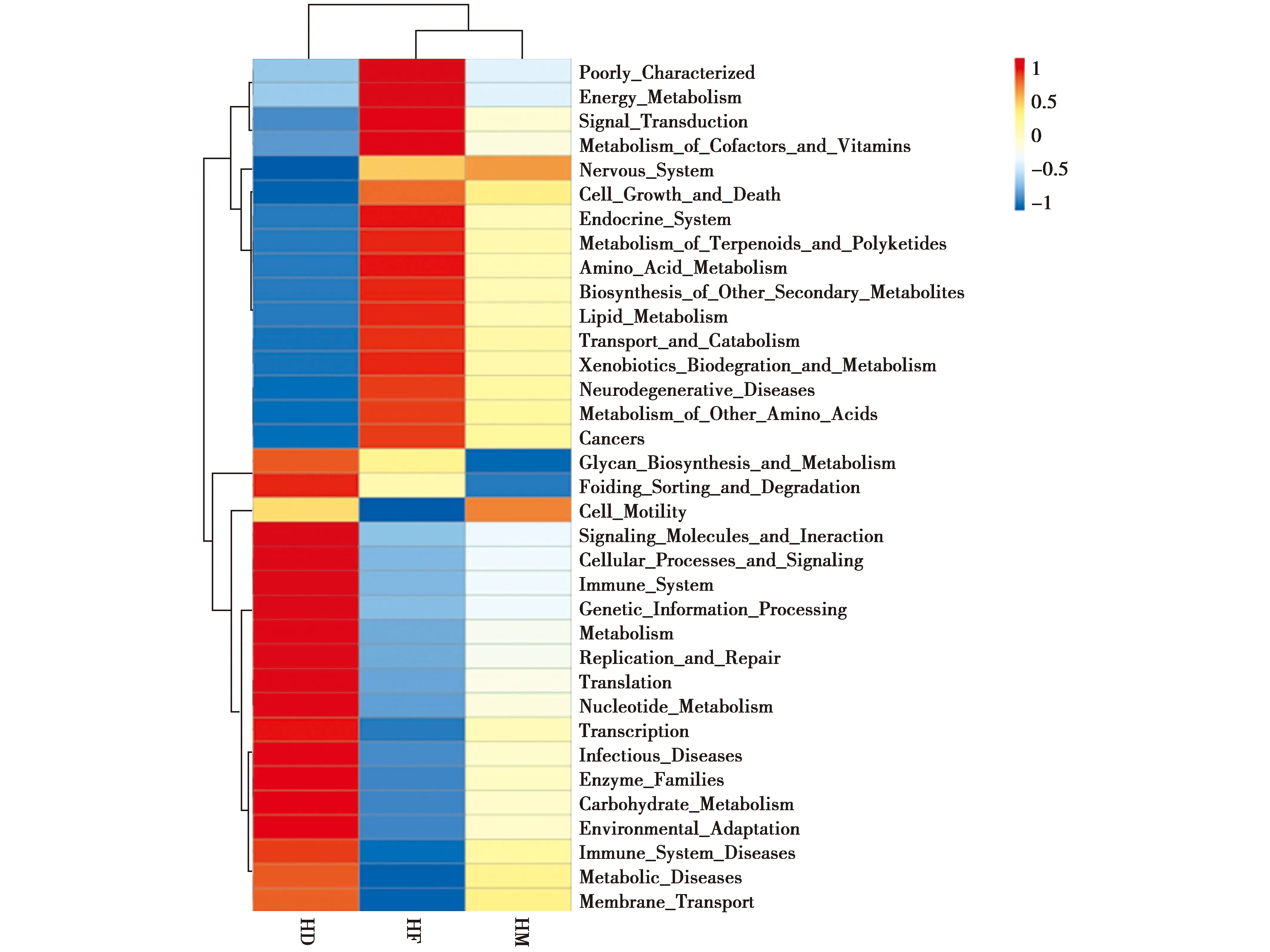
图8 不同肠道部位微生物功能预测Fig.8 Functional prediction of different intestine regions
3 讨论
3.1 虎纹蛙肠道菌群结构
影响肠道菌群定植的因素有很多,主要包括宿主因素(如,遗传背景、性别、年龄、免疫系统、肠道动力)、环境因素(如,水源、食物、药物)、微生物因素(如,粘附力、细菌酶、代谢方式以及生物素)等[11]。人肠道内的细菌主要以厚壁菌门、拟杆菌门、变形菌门和疣微菌门(Verrucomicrobia)为主[12-13],而小鼠肠道中主要菌群为厚壁菌门、拟杆菌门、脱铁杆菌门、软壁菌门(Tenericutes)[14-16]。近年来,水生动物,尤其是鱼类消化道微生物成为研究焦点。鱼类消化道主要由变形菌门、梭杆菌门、厚壁菌门、拟杆菌门、放线菌门、酸杆菌门、绿弯菌门、产氧光细菌门和疣微菌门组成[17-20]。其中,变形菌门、拟杆菌门、放线菌门、厚壁菌门和梭杆菌门为5大主要门类[21-22]。蛙类作为两栖动物,其肠道微生物结构研究仍未引起广泛关注。慕丹阳利用高通量测序方法分析黑斑蛙(Rananigromaculata)、林蛙(R.chensinensis)和牛蛙(R.catesbeiana)蝌蚪(Tadpole)的肠道微生物,发现拟杆菌门、变形菌门为绝对优势菌,其次是梭杆菌门和厚壁菌门[23]。马丽利用蓝白斑筛选技术发现绿蛙(Ranaclamitans)蝌蚪消化道中微生物优势菌群为变形菌门、梭杆菌门和拟杆菌门[24]。摄食全豆粕蛋白饲料的牛蛙成体肠道优势菌群为变形菌门、梭杆菌门和厚壁菌门[25]。斑腿泛树蛙(Polypedatesmegacephalus)肠道微生物核心菌群为拟杆菌门、厚壁菌门、梭杆菌门和变形菌门[26]。虎纹蛙肠道微生物结构组成尚未见报道,本研究虎纹蛙肠道核心菌群以厚壁菌门、变形菌门、拟杆菌门、梭杆菌门和放线菌门为主导。比较以上研究结果,从主要核心菌门上看,蛙类肠道微生物与人类、哺乳动物和鱼类差异较大,而且不同蛙种类间肠道微生物差异也较大,表明蛙类在进化过程中,肠道微生物随着环境、发育等因素影响,形成了差异。
益生菌在水生动物生产中的应用越来越广泛,可作为添加剂以提高动物生长、免疫和抗病性,作为调水剂以改善水质[27-29],但是非宿主来源的益生菌在使用过程中存在潜在风险,宿主来源的益生菌更值得关注和挖掘[30]。本研究中,发现潜在益生菌芽孢杆菌、乳酸杆菌和双歧杆菌等存在于在虎纹蛙肠道中。而水生动物常见的条件致病菌弧菌、邻单胞菌、气单胞菌、爱德华氏菌不动杆菌属、黄杆菌属(Flavobacterium)、脱硫弧菌属(Desulfovibrio)、鞘脂单胞菌属(Sphingomonas)、伊丽莎白菌等均有发现,而且弧菌和爱德华氏菌在不同个体中出现频率最高。这些发现为虎纹蛙专属益生菌的开发和细菌疾病的防治提供了参考意义。
3.2 虎纹蛙不同肠道部位菌群结构与功能差异
由于消化道不同部位理化性质的差异,消化道菌群的数量和结构有很大差别[31]。以鱼类为例,多数研究证明多种鱼类消化道不同区段从前到后菌群数量呈逐渐上升趋势[32-36],且肠道中的菌群数量最多。然而,Austin等发现虹鳟(Oncorhynchusmykiss,Walbaum)各段消化道细菌数量呈逐渐下降的趋势[37],Ringø等研究发现北极嘉鱼(SalvelinusalpinusL.)小肠和大肠的细菌数量是恒定的[38]。Ye等研究比较了黄鱼(Dorosomacepedianum)前肠和后肠菌群组成,发现黄鱼后肠中菌群量最大且α-多样性指数最大[39]。本研究中虎纹蛙前肠和中肠α-多样性指数显著高于后肠,这与大多数鱼类研究结果相反。
在门水平上,虎纹蛙后肠拟杆菌厚壁菌门和梭杆菌门丰度高于和中肠。厚壁菌通过分解纤维素,产生挥发性脂肪酸,以提高宿主的营养利用率,维持肠道微生物生态平衡,还可经调节T细胞调控IL-10的表达,改善肠道黏膜炎症;梭杆菌门中的绝对优势菌鲸杆菌属能够发酵多肽碳水化合物,产生有益的维生素B12[40-42]。PICRUSt预测前肠和中肠中与脂代谢、氨基酸代谢、外源物质降解和代谢关联微生物丰度较高,而后肠中与碳水化合物代谢关联微生物丰度更高。我们推测虎纹蛙前肠和中肠可以直接消化、吸收脂肪和氨基酸,更难分解的碳水化合物进入到后肠,在微生物的帮助下降解利用。有研究发现,虎纹蛙肠道脂肪酶活力大小次序是中肠>后肠>前肠,淀粉酶活力大小次序是前肠>中肠>后肠,蛋白酶活力大小次序是前肠>后肠[6,43]。脂肪酶和蛋白酶活力大小与PICRUSt预测结果基本一致,但是淀粉酶活力与微生物功能预测结果并不一致,肠道微生物功能预测与肠道生物酶活间的评估还有待进一步的研究。
