长链非编码RNA AFAP1-AS1通过PTEN/p-AKT信号通路调控结直肠癌细胞增殖的分子机制研究
2020-02-21庄树彤丁世华孙大勇
曾 理 庄树彤 丁世华 陈 冲 焦 璐 孙大勇
结直肠癌(Colorectal cancer,CRC)是常见的消化道恶性肿瘤之一,其发病率和死亡率在我国呈逐年上升趋势[1]。CRC患者生存时间取决于患者首次诊断CRC时所处的临床分期。研究提示CRC患者5年总生存率从I期超过90%下降至Ⅳ期不足10%[2]。因此,辅助临床早期诊断的标志物在CRC诊断和治疗中具有重要的临床意义。
长链非编码RNA(Long non-coding RNA,LncRNA)是一类转录本长度超过200 nt几乎不参与编码蛋白的RNA。研究显示,lncRNA在多种癌症的病理发展和预后中起着关键作用。现已发现多种lncRNA的异常表达与疾病,特别是肿瘤的发生与发展密切相关[3-4]。研究报道,肌动蛋白纤维相关蛋白1-反义RNA1(Actin filament-associatedprotein1-antisense RNA1,AFAP1-AS1)在食管癌、食管腺癌和鼻咽癌中高表达,与肿瘤的发展和预后不良密切相关,有望作为癌症治疗的潜在靶点[5-6]。也有文献证明,AFAP1-AS1高表达可促进CRC细胞的生长和迁移,但具体机制尚不清楚[7]。因此,本研究集中研究lncRNA AFAP1-AS1,探讨其在CRC发展和进展中的作用,期望为AFAP1-AS1作为CRC临床诊治辅助标志物提供理论依据。
1 材料与方法
1.1 CRC粪便样本
收集2014年7月—2018年6月深圳市第二人民医院消化内科及胃肠外科诊治的38例未经手术,但病理检测明确诊断为CRC患者的粪便(1~2 g/例),38例经胃肠镜及其他影像学、实验、物理学检查确诊为正常人群的粪便(1~2 g/例),所有新鲜粪便置于-80℃保存。所有参与者均签署知情同意书。有家族性腺瘤型息肉病、家族性非息肉性CRC、结肠手术史以及CRC手术前辅助治疗史、急性感染性腹泻的患者标本不予采集。
1.2 细胞培养
正常结肠上皮细胞株NCM460、CRC细胞株SW620和HCT116购自中国科学院上海细胞库。NCM460用含10%胎牛血清的DMEM培养基,SW620和HCT116用含10%胎牛血清的RPMI 1640培养基,细胞置于37℃,5% CO2细胞培养箱中培养。
1.3 主要实验试剂和仪器
RNA提取试剂盒(日本Takara公司),反转录试剂盒PrimeScriptTMRT reagent Ki和实时荧光定量PCR(Real-time PCR)检测试剂盒SYBRTMGreen PCR Master Mix(日本Takara公司),粪便RNA提取试剂盒(上海晶旷生物科技有限公司),Lipofectamine 2000和RPMI1640培养基(美国Gibco公司),一抗anti-Cleased caspase 3,anti-Bax,anti-Bcl-2,anti-p-AKT,anti-AKT,anti-PTEN和anti-β-actin(美国CST公司),二抗辣根过氧化酶标记的山羊抗鼠IgG和辣根过氧化酶标记的山羊抗兔IgG(美国Santa Cruz公司),凝胶电泳成像分析系统(美国Alpha innotech公司),实时荧光定量PCR仪(美国ABI公司)。
1.4 总RNA提取和Real-time PCR检测粪便或细胞中AFAP1-AS1的表达
分别取38例CRC患者和38例正常人粪便0.5 g/例,采用Takara的粪便RNA提取试剂盒提取粪便中的总RNA,具体操作参照试剂盒说明书。此外,利用TRIzol试剂提取细胞内总RNA,用DNaseI处理,然后用RNeasy kit纯化处理后的总RNA。最终将提取的RNA溶解于无RNAase水中。琼脂糖凝胶电泳检测RNA质量,Nanodrop检测RNA浓度。取2 μg上述提取RNA(粪便RNA或细胞RNA)按照反转试剂盒PrimeScriptTMRT reagent Ki的说明步骤合成cDNA作为之后Real time-PCR反应体系的模板。PCR反应体系为25 μL,条件为:95℃、2 min,(95℃、30 s,55℃、30 s,72℃、30 s;40个循环),72℃、5 min。每个样品设3个平行复孔,所有样品重复检测3次。用2-ΔΔCt表示目的基因的相对表达量,β-actin为内参基因,引物序列见表1。
1.5 细胞转染
以AFAP1-AS1为靶点的小干扰RNA(siRNA)抑制AFAP1-AS1的表达,Invitrogen提供阴性对照siRNA(si-NC)。根据Lipofectamine 2000的使用说明,对培养在六孔板中的SW620和HCT116细胞转染si-AFAP1-AS1或si-NC,然后置于培养箱中继续培养。si-AFAP1-AS1序列为5′-GGGCTTCAATTTACAAGCATT-3′;对照序列si-NC:5′-CCTATCTGGTCAACACGTATT-3′。

表1 引物序列Table 1 The sequences of primers
1.6 MTT法测定CRC细胞株增殖
按照5×103/孔的细胞密度,正常结肠上皮细胞株NCM460和CRC细胞株SW620、HCT116接种于96孔板培养,以及si-AFAP1-AS1和siNC分别转染细胞,并于24 h、48 h、72 h后每孔加入20 μL MTT溶液(1.5 g/L),置于37℃培养4 h后弃上清,每孔加入150 μL DMSO,酶标仪上490 nm处读取每孔的OD值,绘制细胞生长曲线。
1.7 蛋白提取和免疫印迹
SW620和HCT116细胞转染si-AFAP1-AS1或si-NC 48 h后,RIPA裂解细胞,4℃离心10 min,取上清液定量样品蛋白浓度。进行10%SDS-PAGE电泳,将蛋白转移至硝酸纤维膜,5%脱脂牛奶室温封闭1 h,然后加入Cleaved caspase 3、Bcl-2、Bax、p-AKT、总AKT、PTEN和β-actin抗体(1∶1 000),4℃孵育过夜,次日TBST漂洗三次,每次10 min,然后加入对应的辣根过氧化物酶(HRP)标记的羊抗兔(或鼠)二抗(1∶5 000),室温孵育1 h。ECL显影,Image J分析条带灰度。
1.8 统计学方法
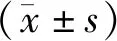
2 结果
2.1 Real-time PCR检测粪便中AFAF1-AS1的表达
通过Real-time PCR检测AFAP1-AS1在38例CRC患者和38例正常人粪便中的表达水平。结果表明CRC患者粪便中AFAP1-AS1的表达量为21.53±8.58,正常人粪便中AFAP1-AS1的表达量为2.74±1.23。与正常人相比,CRC患者粪便中AFAP1-AS1表达水平显著升高,差异具有统计学意义(P<0.001)(图1)。
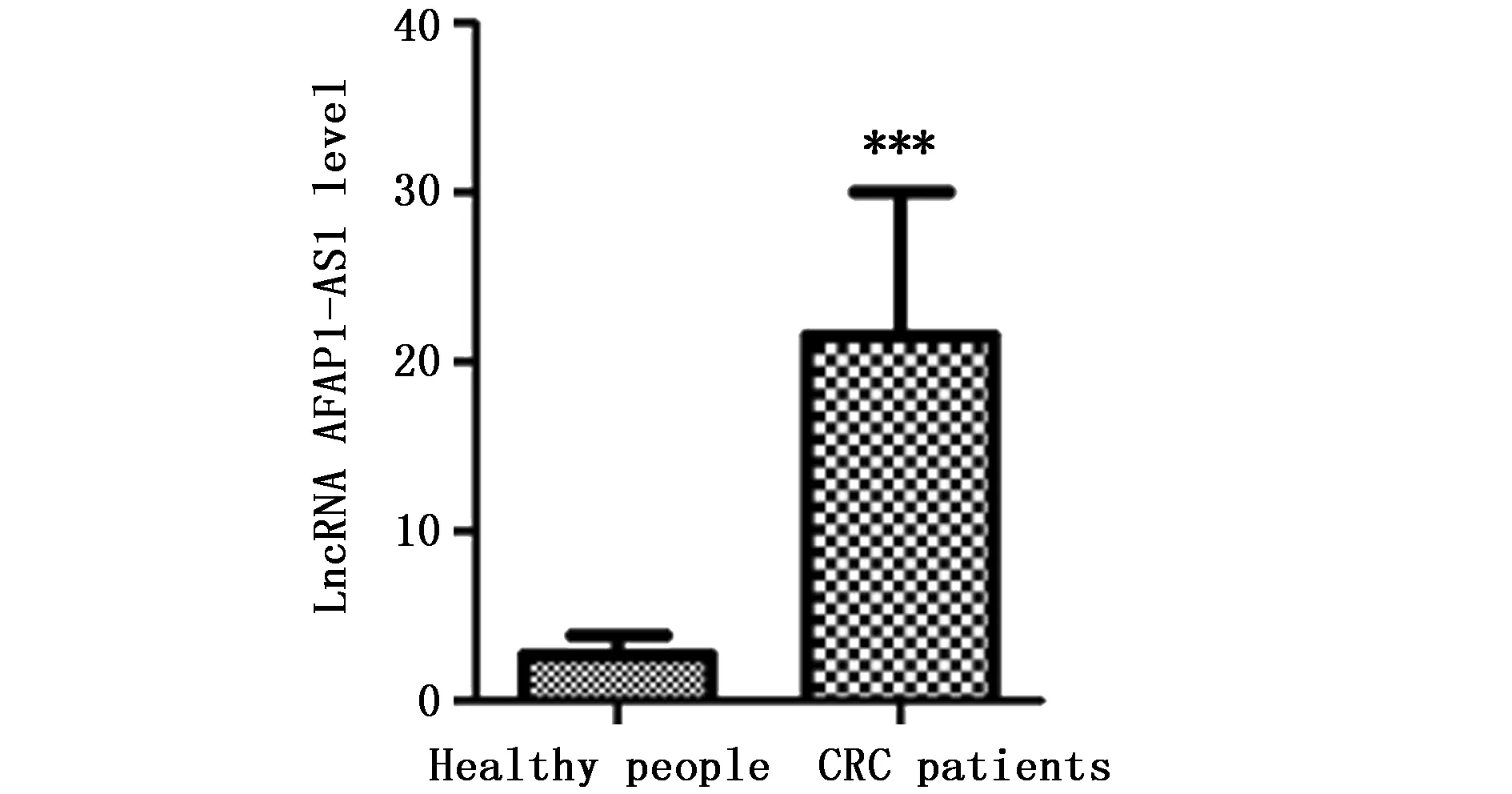
图1 Real-time PCR检测CRC患者和正常人群粪便中AFAP1-AS1的表达Figure 1 AFAP1-AS1 of CRC patients and healthy people in feces was detected by Real time-PCRNote:***P<0.001,when compared with the healthy people.
2.2 正常结肠上皮细胞株和CRC细胞株中AFAP1-AS1的表达情况
为了进一步验证AFAP1-AS1在CRC中的调控作用,我们检测了CRC细胞株SW620和HCT116以及正常结肠上皮细胞株NCM460中AFAP1-AS1的表达。结果显示,与正常结肠上皮细胞株相比,CRC细胞中AFAP1-AS1的水平显著上调,差异具有统计学意义(P<0.01)(图2)。
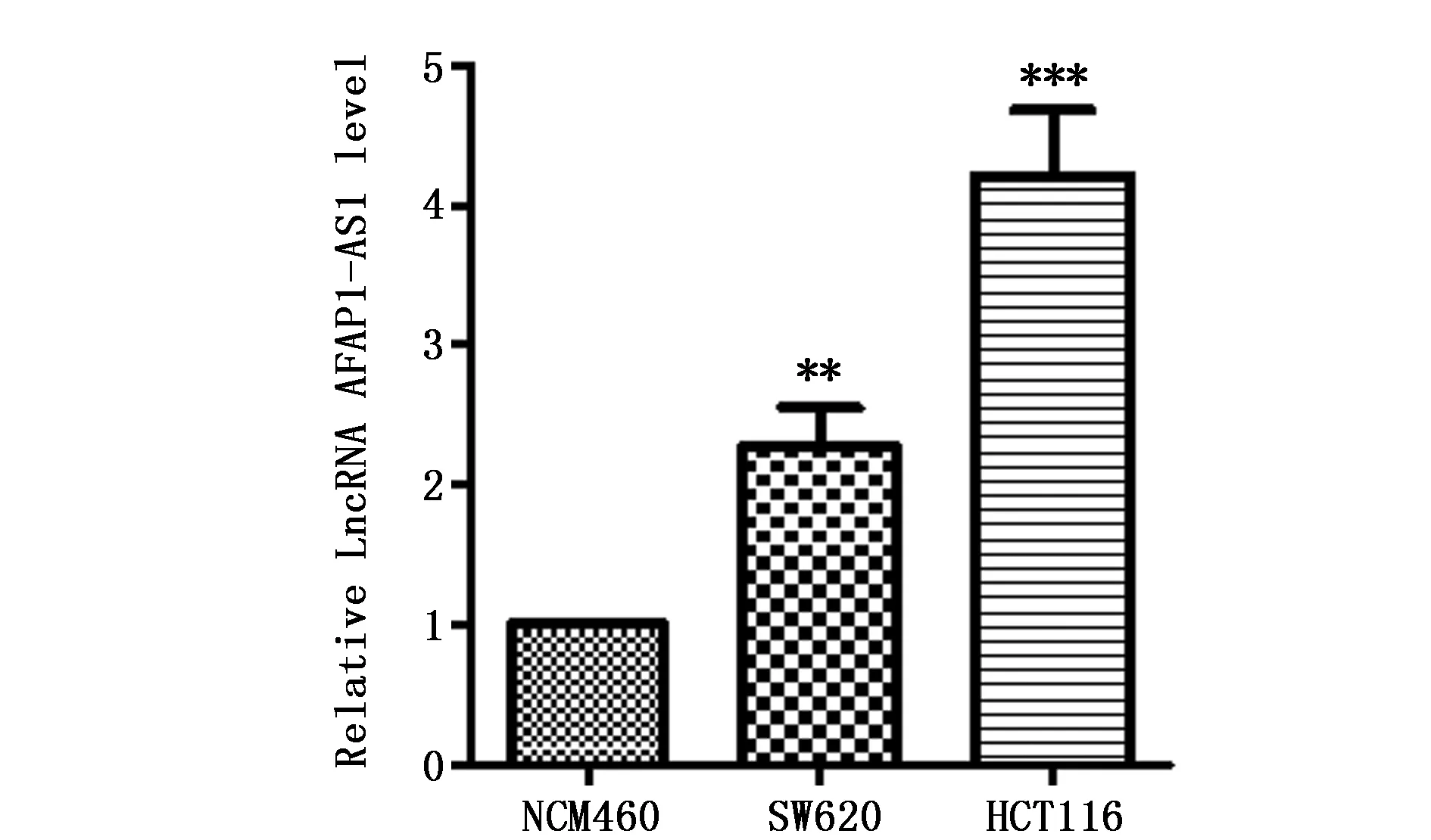
图2 在CRC细胞中AFAP1-AS1的表达情况(n=3)Figure 2 The expression of AFAP1-AS1 was detected in NCM460,SW620 and HCT116 cells(n=3)Note: **P<0.01,***P<0.001,when compared with the NCM460 cells.
2.3 si-AFAP1-AS1干扰对细胞增殖的影响
为了研究AFAP1-AS1在CRC中的分子作用机制,我们利用si-AFAP1-AS1干扰AFAP1-AS1的表达。结果表明,si-AFAP1-AS1可以显著下降SW620和HCT116细胞中AFAP1-AS1的表达,证明si-AFAP1-AS1转染成功(P<0.01)(图3A)。为了确定AFAP1-AS1对SW620和HCT116细胞增殖的影响,利用MTT实验测定转染si-NC或si-AFAP1-AS1后SW620和HCT116细胞的存活率(图3B)。与转染si-NC相比,转染si-AFAP1-AS1后,SW620和HCT116细胞的增值速率均显著降低(P<0.01),说明下调AFAP1-AS1表达可以抑制上述细胞系的增殖。
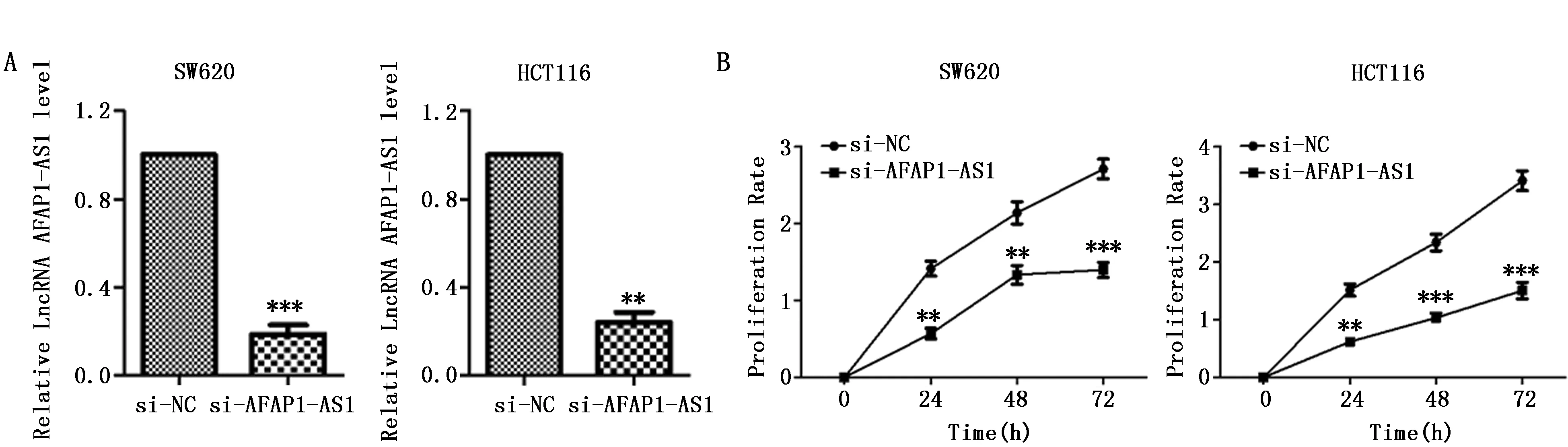
图3 si-AFAP1-AS1干扰对CRC细胞增殖的影响(n=3)Figure 3 The effect of si-AFAP1-AS1 on proliferation of SW620 and HCT116 cells(n=3)Note:A.The effect of si-AFAP1-AS1 on the expression of AFAP1-AS1;B.Cell viability was detected in SW620 and HCT116cells after transfected with si-AFAP1-AS1.**P<0.01,***P<0.001,when compared with the si-NC group.
2.4 AFAP1-AS1通过内在途径抑制CRC细胞死亡
为了检测AFAP1-AS1调节SW620和HCT116细胞死亡的分子机制,用Western blot检测Cleaved caspase 3的表达,与转染si-NC相比,转染si-AFAP1-AS1后,SW620和HCT116细胞中Cleaved caspase 3表达升高,具有统计学意义(P<0.01)(图4A)。此外,我们还检测了Bcl-2和Bax的表达,与转染si-NC相比,转染si-AFAP1-AS1的SW620和HCT116细胞中Bcl-2蛋白水平降低(P<0.001),Bax表达增加(P<0.05)(图4B)。以上数据表明,si-AFAP1-AS1干扰可诱导内源性SW620和HCT116细胞凋亡。
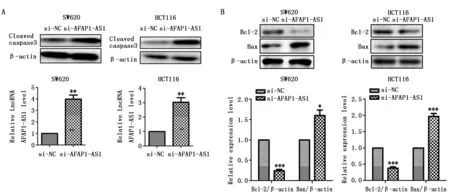
图4 AFAP1-AS1敲低通过内源性途径增加CRC细胞凋亡(n=3)Figure 4 si-AFAP1-AS1 increased the expression of cleaved-caspase-3,Bax and Bcl-2 protein in SW620 and HCT116 cells(n=3)Note:A.The effect of si-AFAP1-AS1 on the expression of cleaved-caspase-3 in SW620 and HCT116 cells;B.The effect of si-AFAP1-AS1 on the expression of Bcl-2 and Bax in SW620 and HCT116 cells.*P<0.05,**P<0.01,***P<0.001,when compared with the si-NC group.
2.5 AFAP1-AS1通过PTEN/P-AKT调控细胞增殖
为了检测AFAP1-AS1调控SW620和HCT116细胞增殖的分子机制,用Western blot检测p-AKT和总AKT的表达。与转染si-NC相比,转染si-AFAP1-AS1降低了SW620和HCT116细胞中p-AKT/AKT的蛋白比值(P<0.01)。此外,si-AFAP1-AS1干扰也诱导了SW620和HCT116细胞中PTEN高表达(P<0.01)(图5)。
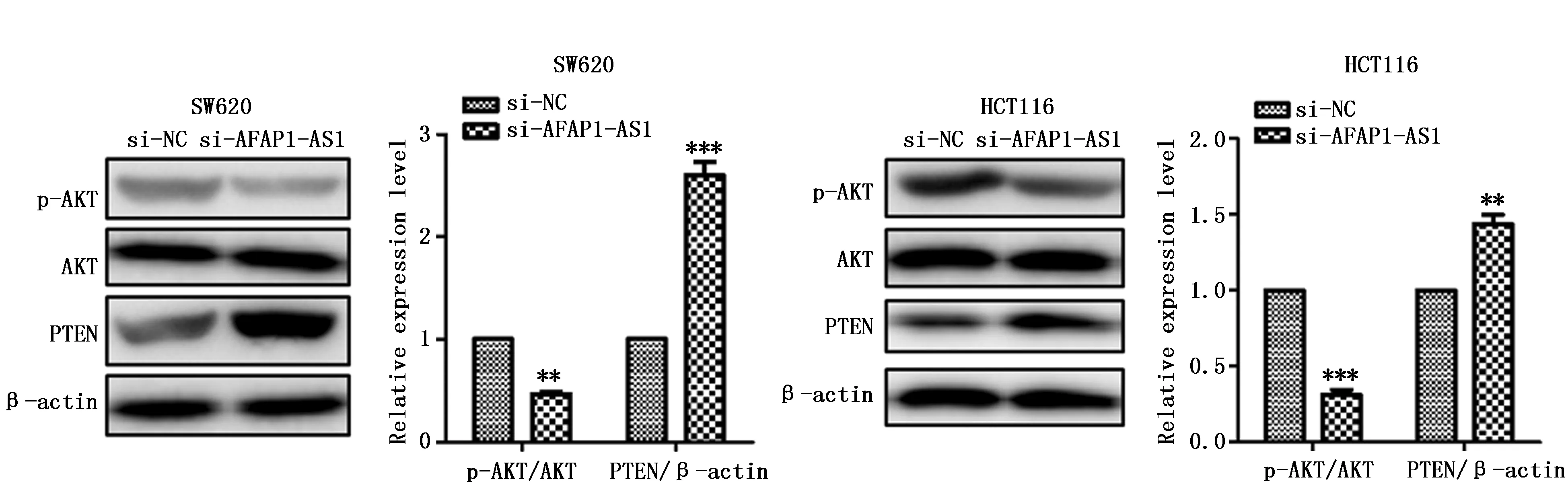
图5 AFAP1-AS1敲低对PTEN/p-AKT信号通路表达的影响(n=3)Figure 5 The effect of si-AFAP1-AS1 on the PTEN/p-AKT signaling pathway(n=3)Note: **P<0.01,***P<0.001,when compared with the si-NC group.
3 讨论
CRC是一种常见的恶性肿瘤,发病率高,进展快,确诊时多数已进入中晚期。因此,寻找CRC特异性的分子靶点,可能会成为对CRC早期诊断、判断治疗效果、预后评价等的一种经济而有效的方法。lncRNA是一类长度超过200 nt、缺乏开放阅读框的非编码RNA。越来越多的研究发现lncRNA在多种肿瘤中表达失调,有希望成为新型肿瘤标志物和肿瘤治疗的靶点,在肿瘤诊断和治疗方面显示出良好的临床应用前景。同miRNA相似,lncRNA也与靶基因形成复杂的调控网络,从而发挥复杂的生物学功能,即不仅调节细胞生长、发育、代谢和凋亡的正常生理过程,而且参与肿瘤的发生发展、侵袭和转移过程。全基因组转录本分析发现许多lncRNA在癌症中异常表达或失调,并以各种调控方式参与肿瘤的代谢,从而影响了肿瘤的发生发展[4]。在CRC的研究中,越来越多发挥重要作用的lncRNA也相继被发现,它们的异常表达,往往发挥着潜在的促癌或抑癌的作用,且多数具有较高的特异性和敏感性。因此,lncRNA有望作为肿瘤诊断标志物和治疗干预的新靶点。
粪便中脱落细胞反映了结肠粘膜上皮细胞的增殖和分化,可为CRC的早期发现提供重要线索,因此,粪便中lncRNA的表达异常可能是CRC早期诊断的新靶点。本研究通过提取确诊为CRC患者的粪便与正常人粪便的总RNA,采用Real-time PCR方法检测AFAP1-AS1的表达水平。结果显示,AFAP1-AS1在CRC患者粪便中的表达水平显著高于正常人粪便,提示AFAP1-AS1的异常表达可能与CRC的发生发展有关;粪便中检测到AFAP1-AS1表达异常,进一步说明AFAP1-AS1可能是CRC早期无创诊断的特异性检测指标。结合上述发现,为了进一步了解这一差异性表达的lncRNA在CRC中的生物学作用,我们设计了一段干扰AFAP1-AS1的siRNA序列,将其转染至CRC细胞SW620和HCT116中,MTT法检测干扰AFAP1-AS1表达对于CRC细胞增殖的影响。MTT结果显示,si-AFAP1-AS1转染CRC细胞可显著降低其增殖速率,说明AFAP1-AS1的表达下调能够抑制CRC细胞增殖,其在CRC中的高表达有可能发挥着潜在的促癌作用,这与王峰等的研究一致[8]。已知PTEN是一种肿瘤抑制基因,可以下调AKT信号传导[9]。在多种癌症中,PTEN/AKT信号传导被频繁激活[10]。为了进一步阐明AFAP1-AS1在CRC发展过程中的分子机制,我们研究了转染si-AFAP1-AS1后,PTEN/p-AKT的CRC细胞中的表达情况。实验结果证实,si-AFAP1-AS1干扰降低了p-AKT的蛋白水平,并增加PTEN的表达,表明AFAP1-AS1通过调节PTEN/p-AKT信号调节CRC细胞增殖。
众所周知,Bcl家族蛋白在调节细胞凋亡的过程中起着关键作用,其中,Bcl-2的是抗细胞凋亡蛋白,Bax可促进细胞凋亡[11]。此外,也有几种典型的与细胞凋亡相关的信号通路,如caspase家族通路[12]。因此,为了阐明导致细胞凋亡的潜在靶点,我们探索了si-AFAP1-AS1干扰对Cleaved caspase 3,Bcl-2和Bax表达的影响。结果显示,转染si-AFAP1-AS1可增强CRC细胞内Cleaved caspase 3和Bax表达,下调Bcl-2的蛋白水平。这些数据表明,si-AFAP1-AS1干扰可诱导SW620和HCT116细胞发生内源性凋亡。
综上所述,本研究在CRC粪便中检测并发现lncRNA AFAP1-AS1表达上调,并且体外实验证明,在CRC细胞中干扰AFAP1-AS1表达水平能够显著抑制细胞增殖,诱导细胞发生内源性凋亡,表明AFAP1-AS1高表达很可能与CRC的发展密切相关。由此,AFAP1-AS1可能是CRC发生发展中的重要靶标,可以作为潜在的标志分子辅助CRC早期诊断和判断预后复发。
