IFN-γ在早孕母胎界面对吲哚胺2,3-双加氧酶(IDO)表达的正性调节研究
2020-02-20涂媛媛喻海芬赵淑云翁宇红李仕祥钱志瑶黄官友
涂媛媛 喻海芬 赵淑云 翁宇红 王 珺 李仕祥 钱志瑶 黄官友
(贵州医科大学附属医院,贵阳 550004)
胎儿如何逃脱母体免疫系统的攻击,具体机制尚不明确。母胎界面由母体的蜕膜组织及胚胎的滋养细胞组成,胚胎作为半同种移植物不被母体排斥,与母胎界面的免疫耐受状态相关。干扰素(interferon-γ,IFN-γ)由分泌蛋白质组成,存在于各种脊椎动物体内,具有抗病毒、抗细胞增殖、抗肿瘤、免疫调节等多种活性[1]。吲哚胺-2,3双加氧酶(indoleamine-2,3-dioxygenase,IDO)是沿犬尿酸途径中分解代谢催化色氨酸的限速酶,存在于哺乳动物的组织与细胞中,在淋巴组织和胎盘中广泛表达,正常状态下呈低水平表达,在炎症过程或感染中,IDO表达显著增加,另外IFN-γ和脂多糖(lipopolysacch-arides,LPS)也可诱导IDO表达[2,3]。雌激素是一种性激素,对生殖发育至关重要,主要有三种类型:雌酮、雌二醇、雌三醇。当雌二醇水平逐渐升高约100倍时,雌三醇水平从早期妊娠到晚期妊娠增加约1 000倍,产后则急剧下降[4]。在怀孕期间,胎盘细胞产生性激素,特别是雌激素。雌激素在免疫系统中也有作用,但其机制尚不完全清楚。雌激素主要通过影响胸腺的T淋巴细胞、B淋巴细胞及细胞因子表达而调节免疫系统,此外雌激素还可促使自身免疫性B细胞增多而克服免疫耐受,通过改变细胞因子来诱导B细胞活化,降低B细胞凋亡。由于Th1型细胞因子参与急性同种移植排斥反应,Th2型细胞因子参与免疫耐受。传统理论认为母胎界面中Th1/Th2的平衡向Th2偏倚有利于母胎免疫耐受,向Th1偏倚与复发性流产等密切相关。近年的研究表明,胚胎植入部位有包括IFN-γ在内的高水平的Th1型细胞因子[5,6],而妊娠期有一个非常显著的特征是胎盘组织通过产生大量的IDO来维持母胎耐受。在免疫微环境中,早期IDO的表达可能与IFN-γ有关,而晚期可能与TGF-β有关[7]。由于Th1型细胞因子参与急性同种移植排斥反应,Th2型细胞因子参与免疫耐受。传统理论认为母胎界面中Th1/Th2的平衡向Th2偏倚有利于母胎免疫耐受,向Th1偏倚与复发性流产等密切相关[8-13]。本文分析早孕绒毛和脱膜组织中IFN-γ上调IDO表达的可能性。
1 材料与方法
1.1材料
1.1.1标本 选择2015年10月至2017年6月,在贵州医科大学附属医院收治的接受人工流产治疗的孕6~9周正常妊娠妇女38例及人工流产获得的绒毛及蜕膜组织。纳入标准:健康正常妊娠妇女;妊娠6~9周;妊娠期间未接受过药物治疗。排除标准:合并全身性疾病者;接受稽留流产或孕酮和米非司酮人流前处理者。研究经贵州医科大学附属医院伦理委员会批准,且患者均签署知情同意书。
1.1.2主要试剂 细胞裂解缓冲液(RIPA)(BL502A)和蛋白酶抑制剂(P8340)均购自美国Sigma公司;一抗和二抗去除液(HCY055)、三羟甲基氨基甲烷-甘氨酸电泳液粉剂(56-40-6)及BCA-100蛋白定量试剂盒(P0012)均购自碧云天公司(877-616-CELL2355)、(D3H2)XP®Rabbit mAb、10×TBST(T1081)、IFN-γ(877-616-cell 2355)和兔抗IDO抗体均(86630)购自美国Cell Signaling Technology公司;PVDF膜(IPVH00010PCRE)、ECL试剂(c_311032402_10)和HRP标记山羊抗兔IgG(M_25420100_10)均购自PerkinElmer公司;预染蛋白相对分子质量Marker(BL706A)和5×SDS-PACE蛋白上样缓冲液(BL502A)均购自美国Biosharp公司;兔抗GAPDH抗体(A01020美国Gnne Tex公司);SDS-PACE制备试剂盒(325OGR500)(北京索莱宝科技有限公司)。
1.2方法
1.2.1IFN-γ和IDO在早孕绒毛及蜕膜中的表达 用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤早孕绒毛和蜕膜残留的红细胞,取绒毛和蜕膜组织各100 mg,置于研钵并加入适量液氮,碾碎组织成粉末,加入蛋白酶抑制剂的裂解液充分裂解,置于4℃离心机,3 000 r/min离心30 min,取上清并采用BCA检测蛋白浓度。加缓冲液煮沸变性,将变性的样本加入聚丙烯酰胺凝胶中电泳,转聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),封闭,孵育一抗,4℃过夜,洗膜加二抗,孵育1 h,ECL显影,图片浏览软件(Imagel J)处理图片,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,IFN-γ和IDO的表达采用目的蛋白条带与内参吸光度值的比值表示(标准:Western blot实验得到的目的蛋白灰度值,除以GAPDH内参灰度值得到的目的蛋白的相对表达量)。
1.2.2Western blot检测不同浓度IFN-γ培养对IDO蛋白表达的影响 无菌收集绒毛和蜕膜组织后,立即放入0.1 m无菌磷酸盐缓冲液(phosphate buffer saline pH7.2,PBS pH7.2)中且15 min内在盒内运送到实验室,然后用PBS洗涤去除红细胞。在Western blot分析前,将组织标本保存在-80℃处,或切成小块(湿重≤1 mg)进行培养。培养样品在收集后40 min内进行处理。将小块绒毛和蜕膜用F-12/DMEM(21041025加拿大Invitrogen公司)冲洗2次,离心5 min后,在培养基中加入10%FBS(10100147吉布科;澳大利亚)和1%青霉素,在37℃温箱(美国Thermo公司)与5% CO2共同孵育。给予不同浓度的IFN-γ(1、10、100 ng/ml)分别以48 h、72 h培养胚胎绒毛组织与蜕膜组织,对照组用PBS水替代,Western blot检测IDO在两种组织中的表达情况。
1.3统计学方法 采用SPSS22.0软件对实验数据进行统计,t检验和双变量的直线相关性分析IFN-γ和IDO在早孕绒毛及蜕膜组织中的表达等计量资料,P<0.05为差异有统计学意义。
2 结果
2.1IFN-γ、IDO在早孕绒毛及蜕膜组织中的表达及相关性 Western blot检测显示早孕绒毛组织和蜕膜组织中(图1A)均可见分子量为46 kD和17 kD的蛋白条带,与人的IDO和IFN-γ蛋白分子量大小一致,提示绒毛和蜕膜中均有IDO和IFN-γ的表达。分别对IDO、IFN-γ在两种组织中的表达情况进行统计分析,结果显示,IDO与IFN-γ蛋白在绒毛组织中呈正相关表达,如图1B所示(r=0.987 1,P<0.05);IDO与IFN-γ蛋白在脱膜组织中呈正相关表达,如图1C所示(r=0.979 1,P<0.05)。分别以IDO、IFN-γ在绒毛组织与蜕膜组织中的表达量进行统计分析,如图2,结果显示,IDO在蜕膜组织中的表达高于在绒毛组织中的表达(P=0.002);IFN-γ在蜕膜组织中的表达同样高于在绒毛组织中的表达(P=0.001)。图3为各数据汇总统计分析图。
2.2IFN-γ诱导绒毛和蜕膜中IDO的表达 通过IFN-γ诱导绒毛和蜕膜中IDO的表达,以确定IFN-γ是否能影响IDO的表达。将绒毛和蜕膜分别切成小块,孵育6 h,然后加入不同浓度(1、10、100 ng/ml)的IFN-γ,培养48 h和72 h后分别进行Westren blot分析,以检测IDO的表达。根据IDO、IFN-γ扩增带灰度值与GAPDH带灰度值的比值进行统计分析,数据为平均值±Se,相关实验结果重复3次后选取1例为文章示例图。图2、3表示在IFN-γ浓度分别为1、10、100 ng/ml时,对绒毛组织孵育48、72 h时, IDO表达情况与不同IFN-γ浓度之间的关系,P值分别为0.048、0.036,r值分别为0.952 1,0.964 1;图4、5为IFN-γ浓度分别为1、10、100 ng/ml时,对蜕膜组织孵育48、72 h时,IDO表达情况与不同IFN-γ浓度之间的关系,P值分别为0.036、0.034,r值分别为0.964 1、0.966 4。结果显示,在培养的绒毛和蜕膜组织中加入IFN-γ培养48 h及72 h后,IDO蛋白有较高表达,均高于对照组,且随着IFN-γ浓度的升高而增加(图2~5)。由此可知,IFN-γ可上调母胎界面中IDO的表达来维持免疫耐受。
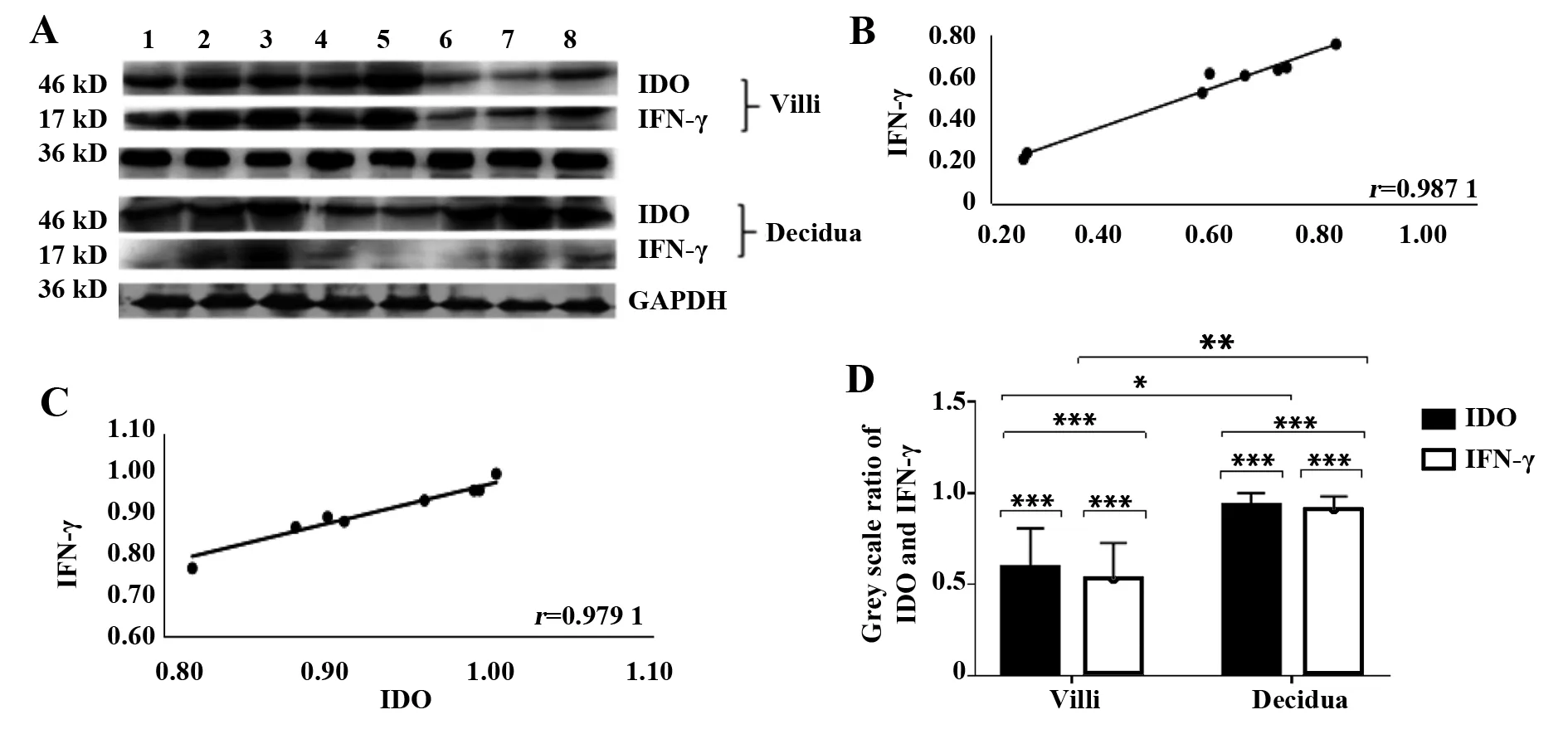
图1 IDO与IFN-γ在绒毛、蜕膜组织中的表达Fig.1 IDO and IFN-γ expression in chorionic villi and deciduaNote:Samples of Numbers 1-8.***.P<0.001,**.P<0.01,*.P<0.05.
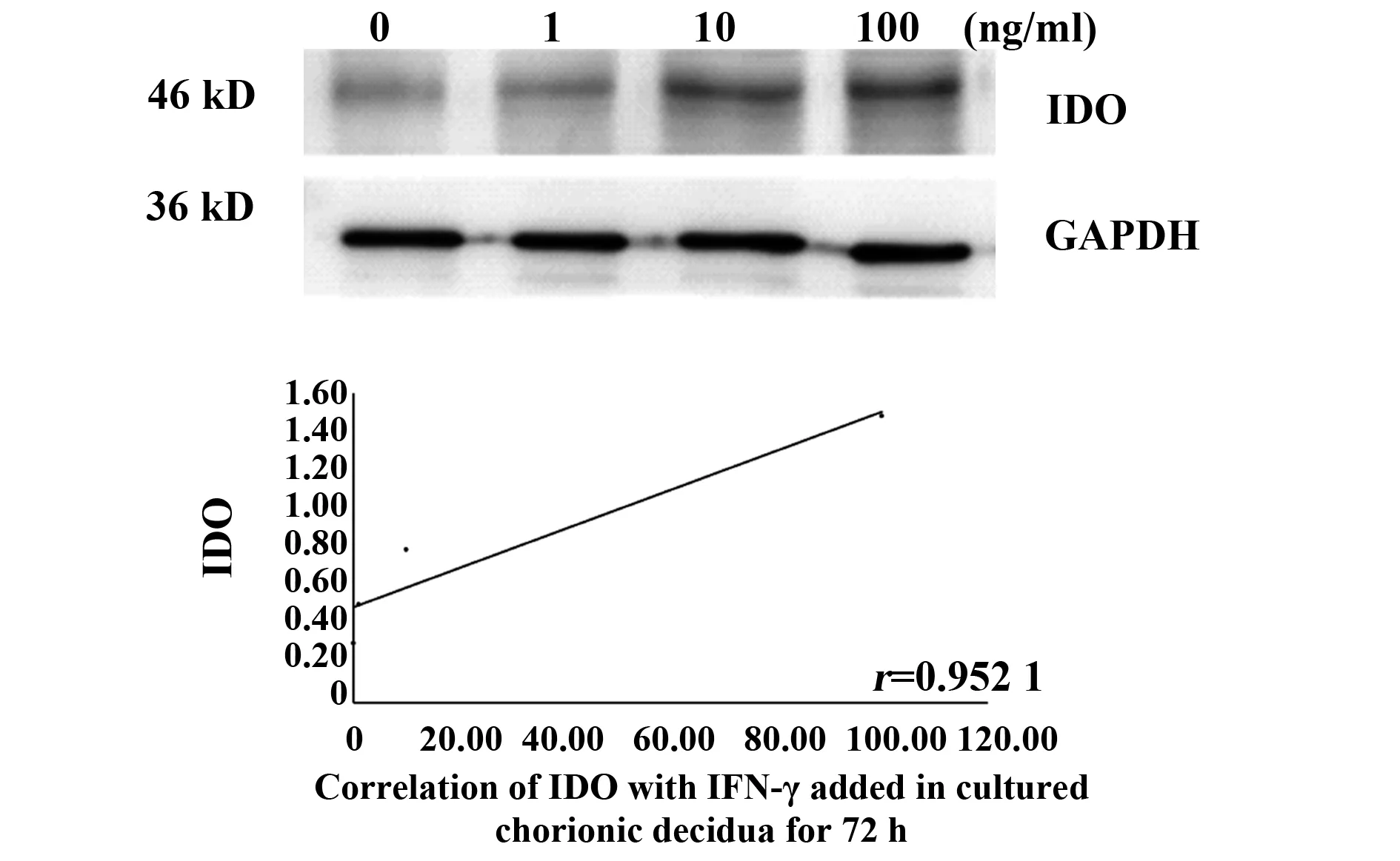
图2 绒毛组织中不同IFN-γ浓度48 h IDO的表达情况Fig.2 Expression of IDO with IFN-γ added in cultured chorionic villi for 48 h

图3 绒毛组织中不同IFN-γ浓度72 h IDO的表达情况Fig.3 Expression of IDO with IFN-γ added in cultured chorionic villi for 72 h
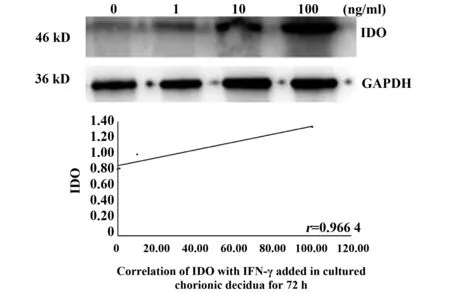
图4 蜕膜组织中不同IFN-γ浓度48 h IDO的表达情况Fig.4 Expression of IDO with IFN-γ added in cultured decidua for 48 h
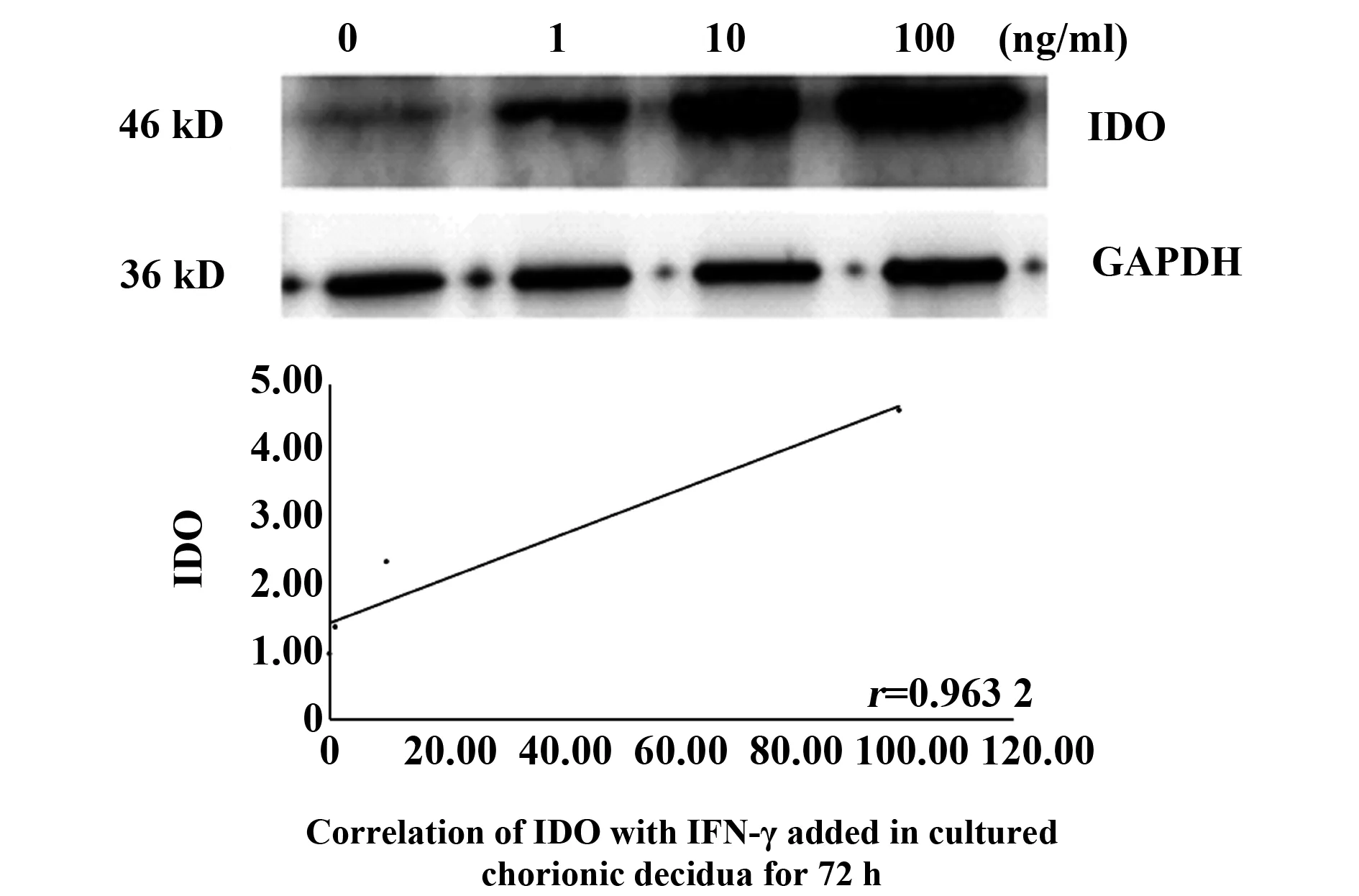
图5 蜕膜组织中不同IFN-γ浓度72 h IDO的表达情况Fig.5 Expression of IDO with IFN-γ added in cultured decidua for 72 h
3 讨论
本研究结果表明,在早孕绒毛和蜕膜组织中,IFN-γ和IDO的表达均呈正相关,提示在该组织中,IFN-γ上调IDO的可能性较大; 在培养的早孕绒毛和蜕膜组织中加入不同浓度的IFN-γ,发现所加入的IFN-γ的浓度与IDO的表达均呈正相关,揭示在早孕绒毛和蜕膜组织中,IFN-γ上调IDO的表达。Kudo等[14]曾报道在培养的人胎盘绒毛组织中加入不同浓度的IFN-γ,发现所加入的IFN-γ的浓度与IDO mRNA的表达呈剂量依赖关系,但该文的研究仅限于mRNA水平,且仅限于细胞培养(只研究培养的胎盘绒毛,未研究蜕膜组织),并没有报道未培养的早孕绒毛和蜕膜组织中IFN-γ和IDO的表达的关系。我们在Kudo 等报道的基础上做了进一步的研究。本研究结果表明,不仅仅是绒毛组织,蜕膜组织亦可通过IFN-γ上调IDO的表达来致免疫耐受。
IFN-γ诱导的一氧化氮敏感性效应机制有可能是诱导IDO的作用机制之一[15,16]。IFN-γ的抗衣原体活性超越色氨酸耗竭,包括干扰细胞能量代谢,导致后代减少,但也降低了细胞的抗菌敏感性[17]。IFN-γ通过信号转导和转录激活因子1的激活,显著增加IDO的表达[18]。IFN-γ能显著激活角质形成细胞的IDO表达,而非成纤维细胞[19]。Sakural等[20]发现IFN-γ在实验性自身免疫性脑脊髓膜炎发病的临床前期达到高峰,缓解期降低。而IDO的升高在时相上正好在IFN-γ之后。IFN-γ诱导IDO表达的特点是表达强度较高及表达持续的时间较为短暂。因而,IFN-γ诱导IDO的表达有助于宿主限制微生物的生长及预防急性炎症对宿主潜在的损害,但IFN-γ诱导IDO表达的特点不能解释IDO在体内的长期效应,即维持包括妊娠和自身耐受等免疫稳态[2]。
众所周知,母胎界面有Th1 型细胞因子和Th2 型细胞因子。Th1 型细胞因子包括IFN-γ、TNF-α、TNF-β、IL-2及IL-12。Th2型细胞因子,包括IL-4、IL-5、IL-6 及IL-10。正常情况下,母胎界面的细胞因子向Th2 型偏倚,即母胎界面Th2 型细胞因子较Th1 型细胞因子占优势[21]。传统认为,受孕后,母体对胎儿的识别及妊娠的维持是通过占优势的Th2 型细胞因子来实现的,母胎界面的Th2 型细胞因子是维持同种异体耐受的核心,Th2 型偏倚的重要意义在于维持妊娠和抑制母体和胎儿之间的排斥反应,即维持母胎耐受[22,23]。我们的研究结果提示,Th1 型细胞因子(IFN-γ)亦可通过调节IDO的表达致母胎耐受,从而保护胎儿免受母体的排斥。因而,本研究进一步完善了母胎耐受的机制。
总之,本研究发现早孕绒毛和蜕膜组织中IFN-γ和IDO的表达呈正相关,并在体外培养的该组织中发现IFN-γ可上调IDO的表达。本研究结果表明,在早孕母胎界面IFN-γ可通过上调IDO的表达来致母胎耐受。
