抗结核治疗中患者外周结核分枝杆菌抗原水平与特异性免疫应答相关性分析①
2020-02-20梁宇硕陈颖盈蔡潭溪程齐俭
梁宇硕 陈颖盈 蔡潭溪 季 萍 胡 晔 程齐俭 王 颖
(上海市免疫学研究所,上海交通大学医学院,上海 200025)
结核病(Tuberculosis)是由结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染引起的慢性传染性疾病。根据2018年世界卫生组织(World Health Organization,WHO)结核病报告指出,我国在2017年约有90万例新发结核,结核患病人数仅次于印度,高居全球第二位[1]。同时,近年来随着多重耐药结核患病人数的增加,各类结核病合并其他疾病(如艾滋病、糖尿病)的出现,对我国结核病的诊断和治疗提出了新的挑战[2]。但是,由于结核病病灶的空间特征,使其诊断和监控难,虽然细菌学检查(痰培养及痰涂片)是结核病临床诊断的金标准,但其培养周期长、灵敏度较低,且假阴性多,目前临床上仅有32%的肺结核是通过细菌学确诊的[1]。而在抗结核治疗中,即便在治疗前细菌学检测阳性的患者,往往在强化期结束后其痰培养或痰涂片结果也已经转阴,但其临床病征并未消失,所以在结核病检测和治疗监察中,痰液中结核分枝杆菌的培养结果不甚理想[3]。
结核分枝杆菌感染宿主后,经过呼吸道到达肺泡,并感染定植于肺泡的巨噬细胞[4]。感染的巨噬细胞和树突状细胞通过主要组织相容性抗原分子提呈M.tb抗原到T细胞,激发T细胞产生特异性更强的抗结核适应性免疫应答[5],T细胞可以通过分泌干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、IL-2等多种细胞因子激活或募集更多炎症细胞对抗M.tb感染[6-8]。目前,基于结核感染过程中的免疫细胞分泌IFN-γ功能所建立的干扰素释放实验也成为目前临床上结核病重要的辅助诊断手段。但是该方法一方面很难区分结核病和结核潜伏感染,同时其对于结核病治疗过程中的诊断意义也需要进一步的实验数据证明,而其中核心的未解决的问题在于目前尚不能确定不同患者在治疗过程中抗原特异性IFN-γ分泌水平与结核病原菌荷载之间的关系。
最近,基于Protein A磁珠免疫沉淀富集联合质谱检测外周结核特异性抗原方法的建立为结核合并艾滋病患者诊断提供新方法。该方法利用Protein A磁珠免疫沉淀富集了患者血浆中由结核分枝杆菌分泌的特异性抗原CFP-10酶切后的短肽1593(肽段:TDAATLAQEAGNFER;质荷比m/z 1593.75),并通过引入同位素标记的目标肽段降低抗原抗体结合效率的误差,最后通过质谱分析方法检测目标抗原的含量[9]。同时有研究发现在无艾滋病毒感染的结核病患者中,1593的检出与定量在结核病的快速诊断中起着重要的作用[10]。因此,该方法有效提高了M.tb检出效率,并具有较高的特异性,为检测患者在抗结核治疗过程中病原学特征提供新方案。目前,该方法是否可用于检测结核病治疗过程中外周抗原的动态变化还未知晓。
为此,本研究拟同步分析活动期结核病患者在抗结核治疗过程的外周M.tb抗原水平与抗原特异性细胞免疫应答的水平,并进行相关性分析,一方面为结核病治疗中的免疫动态变化提供病原学基础,另一方面也为抗结核治疗监控提供了新的理论依据。
1 材料与方法
1.1材料
1.1.1样本来源 本研究共纳入40例活动性结核病患者,患者均来自上海交通大学医学院附属瑞金医院,所有患者同意并签署知情同意书。患者入组时间2012年10月至2016年5月。结核病的诊断标准为微生物学检查M.tb涂片或者M.tb培养阳性,同时结合病史、症状、体征、影像学检查(X射线或CT)等辅助诊断以及住院期间的抗结核治疗效果确诊。其中年龄大于80岁的患者,合并了乙肝、艾滋病等其他感染性疾病的患者均予以剔除;同时部分入组的患者跟踪遗失或样本遗失,最终有6例患者完整收集了治疗前及治疗中1、2、4、5、6个月的25例外周血样本用于本研究分析,并记录患者痰培养、痰涂片信息、临床症状和病情的转归。
1.1.2实验材料、试剂 RPMI1640培养液、胎牛血清(FBS)、氨苄青霉素、硫酸链霉素、淋巴细胞分离液均购自美国Life Technology公司;丙二醇甲醚酸树脂(PMA)和离子霉素(ionomycine)购自美国Sigma公司;96孔U底板购自美国BD公司;Pacific Blue-鼠抗人CD3、Perc P-鼠抗人CD8、FITC-鼠抗人IFN-γ抗体、PE-鼠抗TNF-α抗体和细胞破膜试剂盒均购自BD Bioscience公司;碳酸氢铵(pH7.8)、甲酸购自美国Sigma公司;特异性增强胰蛋白酶购自Promega公司;1593特异性多克隆抗体和1593同位素标记肽段(质荷比1,603.6)均购自GenScript公司;Dynabeads-Protein A磁珠和Crosslinker均购自Thermo Fisher。
1.2方法
1.2.1人外周血单个核细胞分离 取结核病患者外周血5 ml,肝素抗凝,收集血浆保存于-80℃,并经淋巴细胞分离液密度梯度离心法分离获得PBMCs,台盼蓝染色计数后,重悬于含10% FBS、氨苄青霉素和硫酸链霉素的RPMI1640完全培养液中,计数,调整细胞至工作浓度。
1.2.2血浆的酶切 在0.1 ml血浆中加入0.4 ml 10-7mol/L的碳酸氢氨溶液,加入10 μg胰蛋白酶进行酶切。涡旋振荡,溶液充分混匀后,1 200 W微波炉设置为20%火力,均匀加热5 min,重复此加热步骤6次。微波酶切后,将样本置入37℃恒温摇床中混匀孵育16~20 h。
1.2.3Dynabeads-Protein A磁珠的活化和1593特异性抗体的连接 取200 μl磁珠于Ep管中,磁力架上弃上清。加入500 μl PBST(pH=7.4;PBS加0.05% Tween-20),涡旋混匀后,在磁力架上弃上清。活化后的磁珠与50 μg 1593特异性抗体在200 μl PBS 37 ℃孵育30 min后,500 μl PBST重悬洗涤2次。洗涤后,磁珠用200 μl PBS重悬备用。
1.2.4抗体与Dynabeads-Protein A磁珠的化学连接 超纯水配置含0.02 mol/L磷酸钠和0.15 mol/L氯化钠(pH=7.4)的溶剂一和含1 mol/L Tris 盐酸(pH=7.5)的溶剂二。备用磁珠用500 μl溶液一洗涤2次。洗涤后,磁珠与500 μl稀释至0.5 mol/L的BS3室温孵育30 min后加入25 μl溶剂二终止反应。PBST(PBS加0.05% Tween-20)洗涤磁珠2次。磁珠用200 μl PBS重悬备用。
1.2.5抗体连接的Dynabeads-Protein A磁珠预处理及与样本孵育 200 μl 1% 甲酸与交联后的磁珠在室温下共孵育15 min。置于磁力架上弃上清,加入500 μl PBST洗涤1分钟,涡旋混匀后弃上清。重复洗涤3次。磁珠用200 μl PBST重悬。同时将20 μl 磁珠和2.5 nmol/L的1593同位素肽段(1603)加入酶切后的样品,充分混匀后在4℃摇床中孵育16~20 h。孵育后磁珠置于磁力架上,弃上清。加入 500 μl PBST洗涤1 min,充分混匀后,弃上清。重复洗涤2次。加入500 μl PBS洗涤1 min,充分混匀后,弃上清。重复洗涤3次。快速离心后,置于磁力架上,弃上清。20 μl 1% 甲酸洗脱磁珠上的目标肽段。离心,将上清转移到新的Ep管中。21 130 g离心20 min,室温。将上清转移至新Ep管中。重复离心1次。上清转移至液相质谱上样管中。三重四极管高效液相色谱仪检测样本,经过Skyline进行分析,同时抗原肽反应性=目标肽段(1593)/同位素标记肽段(1603),以减少批次间的误差。
1.2.6胞内细胞因子的检测 将PBMCs以1×106个/200 μl每孔接种于96孔U底板中,分别加入PMA/IONO(阳性对照)和抗原(CFP-10)进行刺激,其中PMA/IONO组培养6 h,并同时加入Golgi Stop;抗原刺激组于37℃培养20 h,培养结束前6 h加入Golgi Stop。培养结束后,收集细胞,先行使用Pacific Blue-鼠抗人CD3抗体和Perc P-鼠抗人CD8抗体进行表面标志染色,于4℃避光孵育30 min后,用FACS buffer(含2% FBS的PBS)洗涤2遍,加入破膜固定剂,4℃孵育20 min;破膜洗涤液洗涤2次,加入工作浓度的FITC-鼠抗人IFN-γ和PE-鼠抗人TNF-α抗体进行胞内染色,4℃避光孵育30 min;破膜洗涤液洗2次,用PBS重悬细胞,FACS CantoⅡ流式细胞仪收集细胞,并采用Flow Jo软件分析。
1.3统计学处理 实验结果统计分析用Microsoft Excel,Graphpad 6.0进行统计分析。相关性分析运用Pearson相关性分析。
2 结果
2.1结核患者临床用药及治疗信息 目前我国抗结核治疗主要采取规范化的治疗方案,即前2个月为四药联用的加强期(异烟肼、利福平、吡嗪酰胺、乙胺丁醇),4个月两药联用的巩固期(异烟肼、利福平)[11]。根据临床诊断,在本次入组的6例患者中,1例患者在治疗6个月后结束治疗,1例患者在治疗7个月后结束治疗,余下4例患者的治疗周期均大于或等于9个月(表1)。6例患者在治疗前的痰培养阳性为5例,1例为阴性;经过2个月强化期治疗后痰培养结果均为阴性,并直至治疗结束(表2)。
表1 6例跟踪患者临床用药信息
Tab.1 6 tracked TB patients clinical medication information
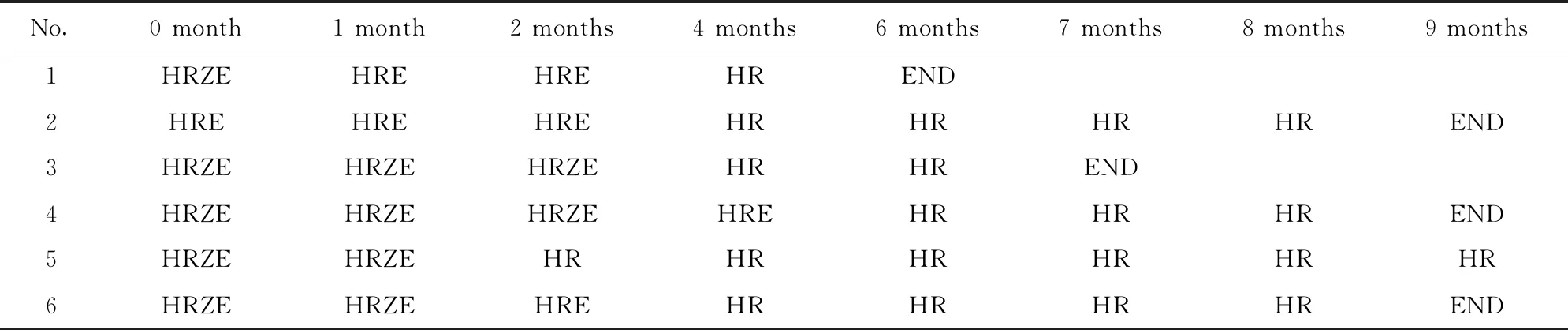
No.0 month1 month2 months4 months6 months7 months8 months9 months1HRZEHREHREHREND2HREHREHREHRHRHRHREND3HRZEHRZEHRZEHRHREND4HRZEHRZEHRZEHREHRHRHREND5HRZEHRZEHRHRHRHRHRHR6HRZEHRZEHREHRHRHRHREND
Note:H.Isoniazid;R.Rifampin;Z.Pyrazinamide;E.Ethambutol.
2.2结核患者治疗过程中的外周结核特异性抗原CFP-10含量的动态变化 在本研究中,我们通过Dynabeads-Protein A磁珠富集结核病跟踪患者外周血浆中结核特异性肽段,并利用高效液相色谱法分析CFP-10肽段与同位素标记肽段的反应性(图1A),结果显示,1~5号结核病患者在治疗前CFP-10 的水平相当,但是在治疗过程中的变化趋势不尽相同,其中患者1和患者4的结核特异性抗原水平随着治疗的进程,均有明显下降;其他4例患者的抗原水平在治疗6个月后仍然处于相当的水平,表现为下降并不明显,其中患者6的外周CFP-10的水平在整个治疗过程中均处于较高水平(图1B),上述结果表明外周血浆中结核菌抗原在治疗过程中的动态变化均在个体差异。
表2 6例患者治疗过程中痰涂片结果
Tab.2 6 patients with sputum smear results during treatment

No.0 month2 months6 months1+--2+--3+--4+--5---6+--
Note:+.Sputum smear positive;-.Sputum smear negative.
2.3结核患者治疗过程中CFP-10特异性IFN-γ+CD4+T细胞数量的动态变化 早前的研究发现在抗结核过程中,CD4+T细胞是主要的抗感染免疫效应细胞[12], Th1型细胞能通过分泌IFN-γ发挥抗感染作用。本研究通过流式细胞法分析患者PBMCs中结核特异性抗原CFP-10刺激下IFN-γ分泌细胞数量的百分比,结果显示CFP-10特异性IFN-γ+CD4+T细胞的比例变化与CFP-10在外周血浆中的含量相似,在治疗过程中呈现不同程度的浮动。与CFP-10的动态改变相似,患者1和患者4的IFN-γ+Th1细胞比例在治疗早期就呈现明显下降的趋势,患者2和患者5中的IFN-γ+Th1细胞比例在治疗早期呈现上升趋势,但是随着治疗的进行,则呈现下降趋势,而患者3和患者6的IFN-γ+Th1细胞比例的动态变化趋势不明显(图2B),上述结果提示IFN-γ+Th1细胞比例在结核治疗过程中的动态变化同样具有个体差异性。
2.4结核患者治疗过程中的CFP-10含量的变化与CFP-10特异性IFN-γ+CD4+T细胞比例的相关性分析 我们通过分析抗结核治疗过程中M.tb特异性CFP-10在外周血浆中的动态变化与CFP-10特异性IFN-γ+CD4+T细胞比例,发现CD4+T细胞分泌IFN-γ的水平与结核菌抗原在外周的变化趋势具有部分一致性(图3A),通过相关性分析发现两者存在显著性相关(P<0.05)。
2.5结核患者治疗过程中CFP-10特异性TNF-α分泌CD4+T细胞数量的动态变化 TNF-α是重要的炎症因子,在抗结核感染过程中,TNF-α能通过诱导已吞噬M.tb的巨噬细胞凋亡发挥抗感染作用。我们通过流式细胞法分析患者外周PBMCs中CFP-10刺激下TNF-α+CD4+T细胞比例的动态变化(图4A),结果显示:患者1和患者6的TNF-α+CD4+T细胞的比例在治疗初期大幅度下降,并在治疗3个月后维持在较低水平;患者2的CD4+T细胞分泌TNF-α的水平在治疗初期有明显上升,但在治疗3个月后呈现逐步下降的趋势;余下3例患者的TNF-α+CD4+T细胞比例的动态变化趋势不明显(图4B)。上述结果提示了TNF-α+CD4+T细胞比例在结核治疗过程中动态变化同样具有个体差异性。
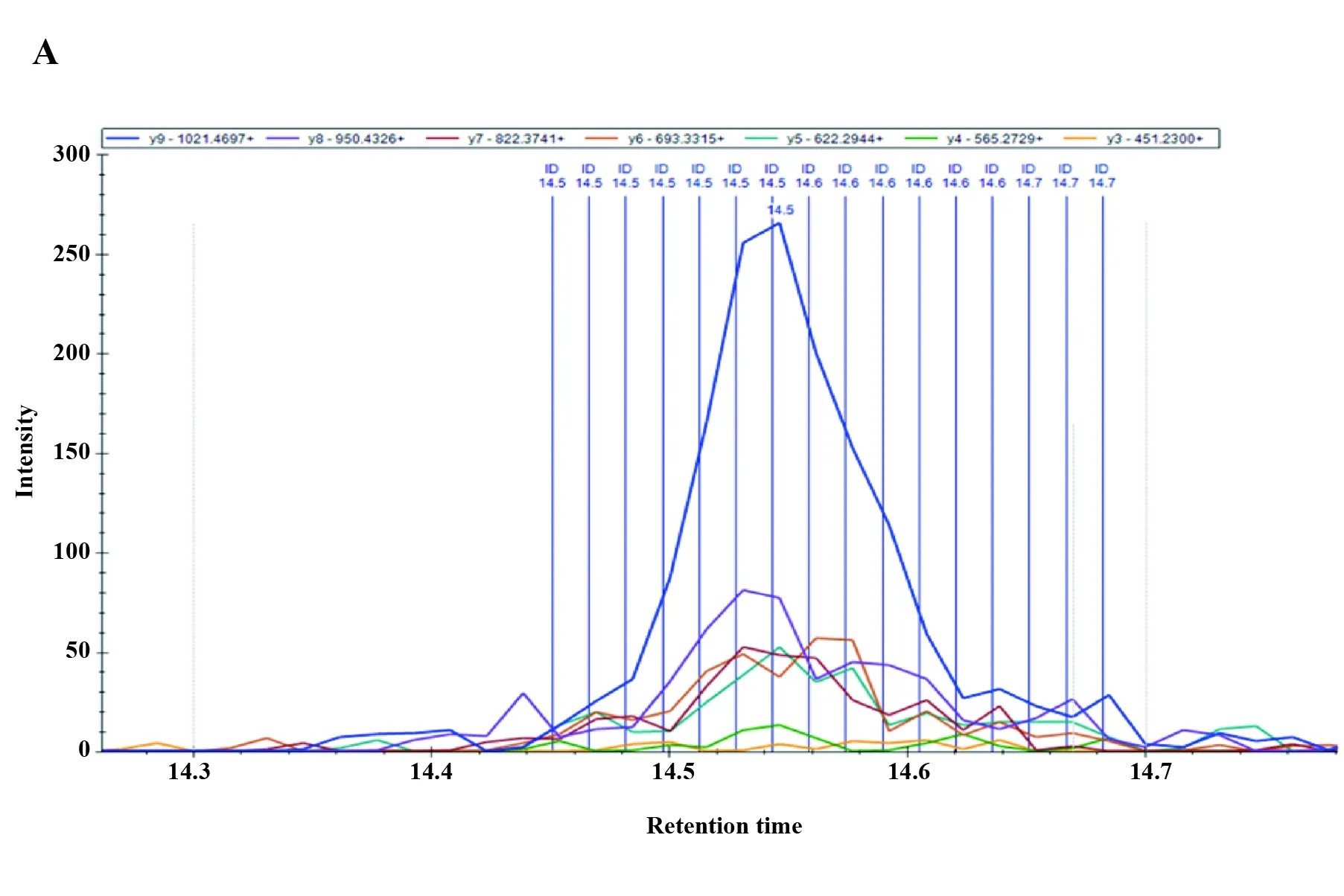

图1 肺结核患者治疗过程中血浆游离CFP-10的动态变化
Fig.1 Dynamics of CFP-10 burden in peripheray of TB patients receiving anti-TB treatment
Note: A.Representitive of Skyline's analysis of CFP-10 in the peripheray of TB patients receiving anti-TB treatment;B.Dynamics of CFP-10 burden in the peripheray of TB patients receiving anti-TB treatment.
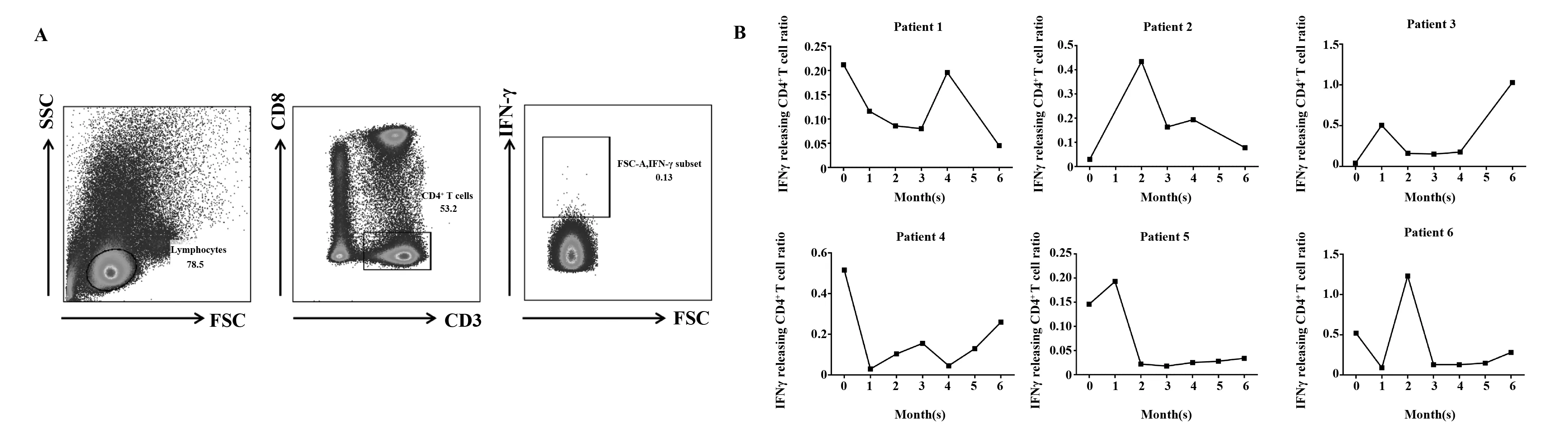
图2 结核患者在抗结核治疗中CFP-10特异性IFN-γ+CD4+T细胞的比例变化Fig.2 Dynamics of IFN-γ releasing CD4+T cell in TB patients receiving anti-TB treatmentNote:A.Representitive of IFN-γ producing CD4+T cells by flow cytometry;B.Dynamics of IFN-γ+CD4+T cell in TB patients receiving anti-TB treatment.

图3 结核患者在抗结核治疗中CFP-10和CFP-10特异性IFN-γ+CD4+T细胞的比例变化Fig.3 Dynamics of CFP-10 burden and CFP-10 specific IFN-γ+CD4+T cell percentage in TB patients receiving anti-TB treatmentNote:A.Dynamics of CFP-10 burden and corresponding CFP-10 specific IFN-γ+CD4+T cell percentage during anti-TB treatment in 6 active TB patients;B.The correlation between CFP-10 burden and CFP-10 specific IFN-γ+CD4+T cell percentage in TB patients receiving anti-TB treatment.

图4 结核患者在抗结核治疗中CFP-10特异性TNF-α+CD4+T细胞的比例变化Fig.4 Dynamics of TNF-α+CD4+T cell in TB patients receiving anti-TB treatmentNote:A.Representitive of TNF-α producing CD4+T cells by flow cytometry;B.Dynamics of TNF-α+CD4+T cell of TB patients receiving anti-TB treatment.

图5 结核患者在抗结核治疗中CFP-10和CFP-10特异性TNF-α+CD4+T细胞的比例变化Fig.5 Dynamics of CFP-10 burden and CFP-10 specific TNF-α+CD4+T cell percentage of TB patients receiving anti-TB treatmentNote:A.Dynamics of CFP-10 burden and corresponding CFP-10 specific TNF-α+CD4+T cell percentage during anti-TB treatment in 6 active TB patients;B.The correlation between CFP-10 burden and CFP-10 specific TNF-α+CD4+T cell percentage in TB patients receiving anti-TB treatment.
2.6结核患者治疗过程中CFP-10含量的变化与CFP-10特异性TNF-α+CD4+T细胞比例的相关性分析 分析CFP-10含量的变化与CFP-10特异性TNF-α+CD4+T细胞比例的相关性发现,在患者治疗期间TNF-α+CD4+T细胞的比例与CFP-10含量的变化趋势并不一致(图5A),通过相关性分析发现,释放TNF-α的CD4+T细胞比例与外周血中M.tb的含量变化无相关性(P>0.05,图5B)。
3 讨论
结核病的治疗过程中,结核菌荷载可以直接反映患者接受抗结核治疗的有效性,而机体内抗结核免疫反应水平的动态变化则是间接的生物标志,在以往的研究中,尚没有关于两者之间相关性的直接证据。本研究则利用高灵敏度的高效液相色谱测定了患者在抗结核治疗中M.tb特异性抗原CFP-10的动态变化,并同步测定了CFP-10特异性细胞免疫应答的动态改变,以此获得了机体内CFP-10特异性细胞免疫应答水平和抗原荷载的相关性,以期为抗结核细胞免疫应答水平提供病原学依据。
本研究纳入的6例结核病患者均接受规范化的DOTS治疗方案,即前2个月四药联用的加强期(异烟肼、利福平、吡嗪酰胺、乙胺丁醇),和4个月两药联用的巩固期(异烟肼、利福平),并根据疾病临床表现决定是否延长。对在此治疗过程中外周CFP-10抗原肽的检测结果显示,CFP-10含量在抗结核治疗过程中的变化趋势在个体间差异较大,包括有持续下降(患者1和4),逐步上升(患者2和5)和基本持平(患者3和6)等三种情况。事实上,治疗前和治疗过程中目前常规的菌培养的检测方法只能定性,而非定量,而本研究中的方法则可以实现外周病原抗原更好的定量。在本研究中患者6在治疗前的抗原水平明显高于其他患者,但是在临床上目前的检测方法很难获得类似的结果。此外,在治疗过程中CFP-10抗原肽的动态变化在个体间的差异也可能与患者药物治疗后病原菌释放的抗原在人体内的持留有关。
已有的研究充分表明CD4+T细胞作为抗结核免疫应答的重要组成[13],在药物治疗过程中的免疫动态变化特征则可以很好地反映病原菌的清除[14]。我们分析了6例患者在抗结核治疗前和治疗1、2、3、4、5、6个月过程中分泌IFN-γ和TNF-α的CD4+T细胞比例的动态变化后,结果显示:不同的细胞因子在治疗过程中分泌水平的变化趋势不完全相同。在抗结核治疗6个月后,CD4+T细胞中上述两个细胞因子的水平在5例患者中都有不同程度的减少;而在余下的1例患者中,两个细胞因子均有不同程度的增长。
机体在结核菌的刺激下能活化T细胞释放IFN-γ和TNF-α等多种细胞因子,发挥抗感染作用。这些细胞因子在结核病的发展和治疗中能诱导产生不同的免疫学效应[15]。IFN-γ作为一种重要的结核应答细胞因子,可以进一步激活单核巨噬细胞,促使巨噬细胞活化并产生一氧化氮合成酶(nitric oxide synthase,NOS)杀灭结核分枝杆菌[16]。研究发现,3例患者IFN-γ+CD4+T细胞的比例在前期治疗中有显著性下降;而在有治疗2月前(治疗前和治疗1个月)数据的5例患者中,4例患者的Th1细胞在治疗2个月时有显著性回升。随着抗结核治疗,结核特异性抗原的变化趋势与Th1细胞的水平有一定的相关性。
TNF-α可以通过募集免疫细胞聚集和黏附形成肉芽肿,隔离结核分枝杆菌感染区域;TNF-α能诱导已吞噬结核分枝杆菌的巨噬细胞凋亡,激活炎症介质。但TNF-α作为促炎细胞因子,对结核分枝杆菌的控制有双向作用,有研究发现高水平的TNF-α会减少对结核分枝杆菌活性的抑制作用,加重患者病情[17]。随着结核病情加重,TNF-α水平也随之升高[13]。因此,TNF-α在抗结核治疗中有着重要地位,或许能成为疗效鉴别的重要生物指标。我们的研究中发现,TNF-α+与IFN-γ+CD4+T细胞水平在治疗期间的反复性变化不同,TNF-α+CD4+T细胞的比例在6例患者中有4例随着治疗过程有显著降低,提示了TNF-α在抗结核中的保护作用。而其与外周CFP-10抗原含量之间的无相关性则提示TNF-α+CD4+T细胞的水平可能还有抗原以外的其他因素影响。
综上所述,本研究通过高灵敏度的高效液相色谱测定结核患者在抗结核治疗中M.tb抗原CFP-10的动态变化,并同步运用流式细胞法检测了CFP-10刺激下细胞免疫反应的动态改变,发现了CFP-10在抗结核治疗过程中动态变化的个体差异性,而这些抗原肽的动态变化与外周IFN-γ+CD4+T细胞比例呈现正相关,与TNF-α+CD4+T细胞的比例无关联性,提示我们目前所采用的IFN-γ释放实验某种程度上可以反映患者外周结核分枝杆菌抗原的载量,而TNF-α+CD4+T细胞的水平则与抗原水平的关系一致性较差,上述基于结核病原学和机体免疫应答水平的同步检测,对于进一步解析抗结核免疫应答的病原学驱动因素,建立新型抗结核治疗疗效评价的生物标志物提供前期理论依据。后续将进一步治疗跟踪样本进行扩大研究。
