肺原发性黏液样肉瘤伴EWSR1易位1例
2020-02-19王前进王礼俊马达李长旭孙强
王前进 王礼俊 马达 李长旭 孙强
临床资料
患者 男,47岁。体检发现右上肺结节1周。胸部CT平扫提示:右肺上叶见22mm×13mm结节,境界尚清,胸腔无积液,纵隔淋巴结无肿大(图1、2),CT重建提示:结节轮廓不规整,呈“分叶状”,临近奇静脉和右上叶支气管(图3、4),全身PET-CT提示:右肺上叶后段结节灶伴FDG代谢异常增高;生化检查提示:血清降钙素明显增高;肿瘤标志物检测:细胞角质蛋白19片段高于正常。诊断右上肺癌。
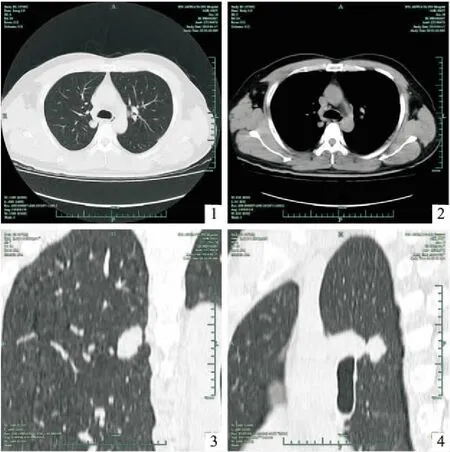
1 胸部CT平扫提示右肺上叶后段结节,境界尚清 图2 胸腔无积液,纵隔淋巴结无肿大 图3 冠状位CT重建提示结节轮廓不规整,呈“分叶状” 图4 结节临近奇静脉和右上叶支气管
2019年4月在全麻下行单孔胸腔镜手术。术中右肺上叶后段见20 mm×12 mm×21 mm结节,质韧,与奇静脉粘连,行右上肺楔形切除,快速冰冻病理提示:肺间叶性肿瘤,低度恶性可能。考虑楔形切除范围足够,未行肺叶切除手术。术后痊愈出院。随访3月无异常。
术后病理示:镜检富于黏液背景,间质显著胶原化(图3),多量梭形细胞增生(图4)。免疫组织化学标记:波形蛋白 (+),细胞角蛋白(-),间变淋巴瘤激酶(-),Bcl-6(+部分),CD34(-),CD68/kpl(-),CD99(-/+),上皮膜抗原(灶+),平滑肌肌动蛋白(-),Ki67(灶+)。分子病理:荧光原位杂交法(FISH)检测发现t(22q12)阳性,即有尤文肉瘤断裂区域1基因( EWSR1 基因) 相关易位 (〉50% 肿瘤细胞内可见红绿分离信号)。病理诊断:肺原发性黏液样肉瘤。
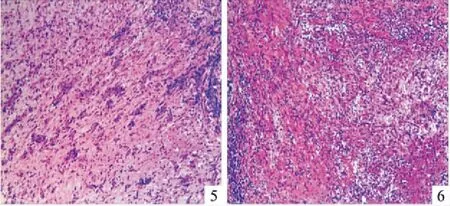
图5 间质显著胶原化,见大量黏液HE×100图6 多量梭形细胞增生,大量淋巴细胞、浆细胞浸润HE×100
讨 论
肺原发性黏液样肉瘤( primary pulmonary myxoid sarcoma,PPMS) 是一种非常罕见的肺软组织肿瘤。2011年,THWAY等[1]报道10例,分子遗传学检测发现染色体易位,环腺苷酸反应元件结合蛋白1(CREB1) 融合基因,将该病定义为伴EWSR1-CREB1 融合基因的PPMS。2015年新版世界卫生组织肺肿瘤组织学分类[2],将PPMS首次纳入肺间叶性肿瘤,命名为PPMS伴EWSR1-CREB1易位。国内报道较少,经检索发现2篇个案[3-4],上海肿瘤医院报道6例[5],本例也经上海肿瘤医院病理科会诊明确诊断。
PPMS发病年龄较肺癌轻,多在40岁左右,无典型临床症状,肿瘤位于肺实质内,与支气管关系密切,呈结节状,界限清楚,镜下病理可见肿瘤细胞梭形增生,间质呈黏液样,大量淋巴细胞、浆细胞浸润。无特异性免疫组化标志,几乎所有病例均表达波形蛋白,部分病例上皮膜抗原局灶性弱表达,其他免疫组化标记均为阴性[4]。FISH检测证实有EWSR1-CREB1基因融合[6]。PPMS病理诊断要慎重,需基因检测确诊[7]。该病例在多家医院无法诊断,在上海肿瘤医院病理科会诊,免疫组化检测波形蛋白 (+),上皮膜抗原和Ki67局灶阳性,最后分子病理检测EWSR1基因易位,才明确诊断。该患者术前血清降钙素明显增高,术后复查降至正常,相关文献未见报道,降钙素高是否为本病特点待进一步证实。
PPMS需与血管瘤样纤维组织细胞瘤( angiomatoid fibrous histiocytoma,AFH)鉴别,两者在镜下形态、免疫表型、分子表型上有重叠,AFH可见血管瘤样结构及瘤周明显的淋巴浆细胞袖套样结构,间质黏液少,Desmin阳性可与PPMS相鉴别。
PPMS是一种低度恶性或具有恶性潜能的肺肿瘤,发病率低,国内外只报道数十例,目前没有TNM分期标准。首选手术治疗,根据肿瘤大小,可行肺楔形切除、肺段切除或肺叶切除手术。对不能手术或不愿手术者,可行化疗、放疗,但效果不佳[5]。该肿瘤具有低级别或中间性生物学行为,建议术后定期随访,密切观察病情变化。
