低温贮藏过程中水牛肉品质变化研究
2020-02-18刘纯友付春婷许金蓉玉万国高小尧
刘纯友,2,*,付春婷,许金蓉,玉万国,高小尧
(1.广西科技大学生物与化学工程学院,广西柳州 545006; 2.华中农业大学食品科技学院,湖北武汉 430070)
水牛(Bubalusbubalis)是我国黄牛、水牛和牦牛三大牛种中唯一可以适应热带、亚热带地区高温高湿极端环境的特殊牛种。由于水牛对粗纤维的转化率高,能把农副产品的副产物直接转变成人类所需的营养食品,同时具有环境适应性强、肉质优良和抗病力强等生物学特性,因此被联合国粮农组织(FAO)认为是最具开发价值的大型经济动物[1-2]。
目前全球水牛存栏量为19888余万头,其中我国有4650万头位,仅次于印度11540万头,居世界第二,占全球水牛总数的23.4%,我国水牛肉年产量60余万吨,占全球水牛肉总产量的17.3%[3]。长期以来,某些研究者认为水牛肉色泽暗淡、质地粗糙、风味欠佳,这可能是由于食用了劳役时间长达十年以上的老龄水牛肉[4-5]。Neath等[5]比较研究相同年龄、性别和饮食条件下的黄牛肉与水牛肉的嫩度差异情况,研究结果显示宰后成熟后的水牛背最长肌、半膜肌的嫩度显著优于普通黄牛。最新研究表明,与普通黄牛肉相比,水牛肉中的总蛋白质含量较高,总脂肪含量较低,肌红蛋白含量更高,肌肉红值(a*)较高,黄值(b*)较低,且胆固醇含量较低,可以显著降低人体患心血管疾病的风险[3]。
与黄牛肉、牦牛肉产业相比,我国水牛肉产业严重滞后,水牛饲养比较分散,生产方式较落后,水牛肉产业链尚未形成[4],这成为影响我国水牛肉产业高效持续发展的关键问题。目前我国水牛肉主要以鲜肉消费为主,但新鲜水牛肉在贮藏、运输和销售过程中,由于在其自身内源酶、外界环境条件等共同作用下,水牛肉容易发生水解氧化、腐败变质,最终导致水牛肉食用品质下降。
低温肉制品是未来肉类重要的发展方向。截止目前,关于黄牛肉、牦牛肉贮藏过程中品质变化研究报道较多[6-8],但关于低温贮藏过程中水牛肉品质变化则鲜见文献报道。因此,本研究以广西水牛肉为研究对象,实验模拟水牛肉冷链贮藏运输中4 ℃冷藏、-18 ℃冻藏和-60 ℃超低温冻藏三个不同温度梯度,通过分析不同贮藏温度下水牛肉的色差、蒸煮损失、滴水损失、pH、双烯值、挥发性盐基氮、菌落总数和大肠菌群数等品质指标,进而揭示低温贮藏过程中水牛肉的品质变化规律,以期为生鲜水牛肉的贮藏保鲜提供科学依据与技术支撑。
1 材料与方法
1.1 材料与仪器
公水牛肉 年龄3~4岁,共7头,体格健壮,品种为富钟,来源于广西壮族自治区富川县,动物宰杀前禁食24 h,禁水2 h,水牛宰杀后,迅速选取股二头肌,肉样采集后迅速用聚乙烯塑料薄膜袋包装,置于0~4 ℃冷藏箱中避光保存,肉样四周放置冰块,迅速运送至实验室,并在低温下排酸24 h备用;盐酸、硫酸、硼酸、氧化镁、硫酸铜、硫酸钾等 分析纯,国药集团化学试剂有限公司。
DW-86L386超低温冰箱 青岛海尔特种电气有限公司;BCD-198冰箱 博西华家电有限公司;WSC-S色差计 上海仪电物理光学仪器有限公司;HH-8数显电热恒温水浴锅 国华电气有限公司;MC电子分析天平、PE200K pH计 梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 肉样贮藏处理 实验用刀具、砧板等器具先用质量分数75%酒精搽拭,再用紫外灯照射处理15 min。肉样先剔除表面肉眼可见的脂肪、筋腱和结缔组织后,将肉样切成厚3 cm,质量300 g的肉块,再置于低密度聚乙烯食品保鲜袋中,分别于4、-18和-60 ℃下贮藏,每组的处理量为900 g。肉块在4 ℃冷藏条件下分别贮藏0、2、4、6、8、10、12 d,肉块在-18、-60 ℃冻藏条件下分别贮藏0、5、10、15、20、25、30 d,冷冻肉样采用20 ℃流水进行解冻,当肉样中心温度达4 ℃时,则肉样解冻完毕,并准备测试肉样的品质指标。不同低温贮藏肉块分别测定色差值、蒸煮损失、滴水损失、pH、双烯值、挥发性盐基氮、菌落总数和大肠菌群数等品质指标。
1.2.2 测定品质指标
1.2.2.1 色差值测定 参照文献Maqsood等[9]方法,并做适当修改:采用色差计分别测定肉样的L*(亮度)、a*(红度)和b*(黄色度)值,每个样品至少独立平行3次试验,并求其平均值。色泽是评价肉品新鲜度的重要感官品质指标,是直接影响消费者购买决定的重要因素[10]。L*值表示肉品的亮度,L*值越高,表示肉品的光泽度越好。a*值表示肉品的红度,a*值越高,表示肉样越鲜红,肉品质量越新鲜[11];b*值表示肉品的黄色度,b*值越高表示肉品越不新鲜。
1.2.2.2 蒸煮损失测定 参考Xia等[12]方法,并做适当修改:将肉样切割成3 cm×2 cm×4 cm肉样切割的样块,准确称量后的肉样置于蒸煮塑料袋中,抽取袋内空气后立刻密封,并记下肉样质量W1(g),放入温度为80 ℃入恒温水浴加热30 min,再在流水下冷却至室温,用吸水纸吸干肉样表面的水分,准确称量加热后的样品质量,记下肉样质量为W2(g)。蒸煮损失率的计算公式如下:
蒸煮损失率(%)=(W1-W2)×100/W1
1.2.2.3 滴水损失测定 参考Traore等[13]方法并做适当修改:先将肉样切成3 cm×2 cm×4 cm的肉块,再用分析天平称取肉样质量,记为M1;然后用铁丝钩住肉块的一端,使肌纤维垂直向下,悬挂于聚乙烯自封袋中,并使肉样与塑料袋不相接触,扎紧袋口后悬挂于冰箱中,在4 ℃的条件下吊挂24 h,取出称量记为M2。滴水损失的计算公式如下:
滴水损失(%)=(M1-M2)×100/M1
1.2.2.4 pH测定 参考Kandeepan等[14]方法,并做适当修改:将不同贮藏温度下的肉样先将脂肪、结缔组织等切除后切碎捣碎,称取肉样10 g放入锥形瓶中,加入100 mL新煮沸冷却后的蒸馏水,在10000 r/min转速条件下高速均质1 min,均质结束后取滤液50 mL,pH计测量滤液的pH。
1.2.2.5 双烯值测定 参考闫文杰等[15]方法,并做适当修改:称取10 g肉样,加入60 mL氯仿-甲醇(2∶1,v/v)混合溶液,在8000 r/min转速下均质2 min,过滤后收集滤液并转入分液漏斗中,再加入8 mL的0.7%氯化钠溶液,震荡后静置收集氯仿层,回收溶剂即可得肉样脂质。准确称取2000 μg溶于10 mL环己烷,测定波长232、215 nm处的吸光度值A,则定义A232/A215为双烯值[16]。
1.2.2.6 挥发性盐基氮测定 按照国标GB 5009.228-2016[17]测定肉样中挥发性盐基氮的含量。
1.2.2.7 微生物指标测定 按照国标GB 4789.2-2016[18]测定肉样中菌落总数,结果以菌落总数的对数值(lg CFU/g)表示。按照国标GB 4789.3-2016[19]测定肉样中大肠菌群数,结果以每g检样中大肠菌群最可能数(MPN/g)表示。
1.3 数据处理
采用SPSS 19.0软件对所得数据进行统计分析,并用Duncan法进行多重差异比较,显著水平设为0.05,水牛肉的各项品质指标独立进行3次平行试验,试验结果表示以平均值±标准误差(Means±SE)。
2 结果与分析
2.1 低温贮藏过程中水牛肉色泽变化
由图1可知,低温贮藏过程中水牛肉的L*、a*值随着贮藏时间的延长呈不断下降趋势,水牛肉在4 ℃冷藏条件下变化最为明显,几乎呈直线下降(P<0.05);但-18、-60 ℃冻藏在前10 d水牛肉的L*值变化较大(P<0.05),10 d后变化趋势则趋于平缓。低温贮藏过程中水牛肉的L*、a*值不断下降,这是由于水牛肉中红色的肌红蛋白被空气中的氧气氧化成褐色的高铁肌红蛋白以及肉样中总血红素下降,随着高铁肌红蛋白的不断积累及血红素的不断降低,进而导致水牛肉L*、a*值降低[8-9]。低温贮藏过程血红素的中水牛肉的b*随着贮藏时间的延长呈不断上升趋势,其中4 ℃冷藏的水牛肉前4 d变化非常明显,但-18、-60 ℃冻藏的水牛肉变化趋势基本一致,前15 d变化b*值增加较快,随后趋于平缓(图1)。低温贮藏过程中,水牛肉的b*值不断增加,这可能一方面是由于水牛肉中脂质氧化产物与磷脂基团或蛋白质中的胺之间的非酶促褐变反应生成的黄色素造成的,另一方面是由于肌红蛋白中的亚铁离子(Fe2+)氧化成高铁离子(Fe3+)所致[12]。

图1 低温贮藏过程中水牛肉色泽的变化Fig.1 Color variation of buffalo meat during low temperature storage注:a:L*值;b:a*值;c:b*值。

图2 低温贮藏过程中水牛肉蒸煮损失变化Fig.2 Variation of cooking loss of buffalo meat during low temperature storage
2.2 低温贮藏过程中水牛肉蒸煮损失变化
蒸煮损失率是衡量水牛肉保水性的重要品质指标之一。由图2可知,随着贮藏时间的延长,3个不同低温贮藏条件下水牛肉的蒸煮损失率呈上升趋势。在4 ℃冷藏条件下,贮藏前2 d水牛肉蒸煮损失显著上升(P<0.05),其增加幅度达14.93%,这可能是加热后肌原纤维中肌球蛋白、肌动蛋白等蛋白质变性所致[20-21];当贮藏第10 d时,水牛肉蒸煮损失率达36.32%,显著(P<0.05)高于贮藏第4和第6 d的蒸煮损失率,分别为34.62%和34.99%;随后水牛肉蒸煮损失率趋于平缓。在-18、-60 ℃冻藏条件下,至贮藏第5 d,水牛肉蒸煮损失率显著增加(P<0.05),蒸煮损失率分别为33.78%和32.32%,增加幅度分别达13.55%和12.00%;当贮藏第10 d,水牛肉蒸煮损失率分别为34.28%和32.21%,低于4 ℃冷藏水牛肉的蒸煮损失率(36.32%);当贮藏第25 d,水牛肉蒸煮损失率分别达37.73%和35.47%,显著高于第20 d的蒸煮损失率(P<0.05);且冻藏过程中-18 ℃冻藏的水牛肉蒸煮损失率高于-60 ℃冻藏的水牛肉,这可能是由于冻藏温度越高,贮藏过程中肌肉水分形成冰晶越大,冷冻解冻后浓缩效应使蛋白质发生变性,且热处理使肌肉进一步产生热变形,造成蛋白质发生聚集,肌原纤维发生严重收缩[22],从而导致肌肉持水力降低。因此,低温贮藏过程中,随着贮藏时间的延长,水牛肉蒸煮损失逐渐升高。
2.3 低温贮藏过程中水牛肉滴水损失变化
滴水损失是另一个反映水牛肉保水性的重要品质指标,该指标与肉的口感密切相关[23]。由于滴水损失使肉品失水,导致肉品的口感变差。因此,滴水损失是影响肉品质量的关键评价指标之一。由图3可知,随着贮藏时间的延长,低温贮藏过程中水牛肉滴水损失不断增加。4 ℃冷藏期间,水牛肉滴水损失的增加速率基本一致;但-18、-60 ℃冻藏前15 d,水牛肉滴水损失快速上升(P<0.05),随后其变化趋势趋于平缓,且-18 ℃冻藏的水牛肉滴水损失高于-60 ℃冻藏的水牛肉。低温贮藏过程中水牛肉滴水损失不断增加,这可能主要是由于肌肉中肌球蛋白、肌动蛋白等肌原纤维蛋白发生氧化降解,使得肌肉中蛋白质与水分子之间的氢键、静电斥力和毛细管引力等分子间作用力发生变化,蛋白质分子之间发生聚集进而限制蛋白质与水分子结合,造成蛋白质的水合能力降低,从而导致水牛肉滴水损失增加[24]。同时,-18、60 ℃冻藏水牛肉在解冻时会发生解冻僵直,使得肌动蛋白与肌球蛋白交联,进而导致肌原纤维发生明显收缩,肌束间的空隙增大,肌内膜破裂,肌肉组织的致密结构被破坏,导致肌肉汁液流失,造成肌原纤维的持水力下降[25-26],故低温贮藏过程中4 ℃冷藏水牛肉的滴水损失较-18、-16 ℃冻藏水牛肉更低。

图3 低温贮藏过程中水牛肉滴水损失变化Fig.3 Variation of drip loss of buffalo meat during low temperature storage
2.4 低温贮藏过程中水牛肉pH变化
pH是反映肉品质优劣的重要指标之一[27]。由图4可知,贮藏过程中水牛肉pH呈先下降后上升趋势。在冷藏4 ℃条件下,贮藏前2 d水牛肉pH急剧下降(P<0.05),随后第2~5 d下降速度减缓,第6 d pH开始缓慢回升。这可能是由于水牛肉宰后肌肉发生僵直,肌糖原的无氧酵解产生乳酸,以及ATP的分解产生磷酸根等,导致水牛肉的pH发生快速下降[28-29];但随着肌肉成熟时间的延长,肌肉蛋白质发生降解,肌肉自溶产生氨、胺等碱性物质,故使得肌肉pH缓慢回升。在冻藏(-18和-60 ℃)条件下,贮藏第15 d时,水牛肉pH最低,随着肌肉蛋白质分解产生氨、胺等物质,肌肉pH逐渐回升。而且,冻藏-18 ℃比冻藏-60 ℃水牛肉pH低,这可能是由于-18 ℃水牛肉冻藏过程中形成冰晶颗粒较大,解冻时肌肉汁液流失比较严重,解离出更多的氢离子(H+)。因此,贮藏过程中-60 ℃水牛肉pH稳定性较好。

图4 低温贮藏过程中水牛肉pH变化Fig.4 Variation of pH value of buffalo meat during low temperature storage
2.5 低温贮藏过程中水牛肉双烯值的变化
双烯值是评价肉品中不饱和脂肪酸氧化形成共轭双键数量的重要指标。由图5可知,随着贮藏时间的延长,不同贮藏温度条件下水牛肉的双烯值呈不断上升趋势。在4 ℃冷藏前2 d,水牛肉双烯值增加缓慢,随后水牛肉双烯值快速上升;当贮藏第10 d,水牛肉双烯值显著上升(P<0.05),其值达0.82,增幅达41.38%;随后水牛肉双烯值增加减缓;当贮藏第12 d,水牛肉双烯值达0.84(P<0.05),增幅达44.83%。-18、-60 ℃冻藏条件下,当贮藏第10 d,水牛肉双烯值增加缓慢,其增幅分别为8.62%和6.89%;随后水牛肉双烯值增幅加快,当贮藏第30 d,-18、-60 ℃冻藏水牛肉的双烯值增幅分别为32.76%和31.03%(P<0.05);而且,贮藏过程中-18 ℃水牛肉的双烯值始终高于-60 ℃水牛肉。章建浩等[16]研究了金华火腿加工过程中脂质氧化变化,研究发现金华火腿原料肉中的双烯值为0.32,经腌制水分流失略有降低,但晒后和进入高温成熟阶段其双烯值迅速增加,成熟阶段双烯值达0.51,增幅达59.38%,且其双烯值与温度呈正相关。由此可见,升高温度对贮藏加工过程中肉品的双烯值具有促进生成作用,且温度越高对肉品的双烯值增加越大。
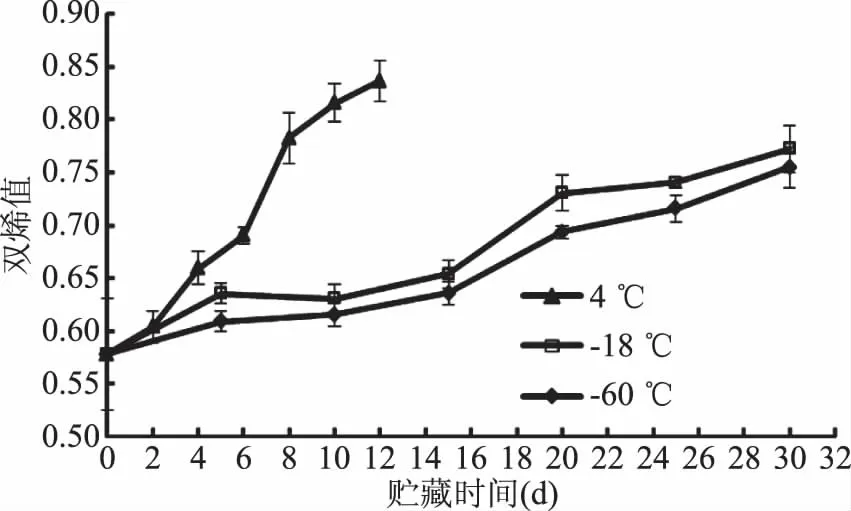
图5 低温贮藏过程中水牛肉双烯值变化Fig.5 Variation of diene value of buffalo meat during low temperature storage
2.6 低温贮藏过程中水牛肉挥发性盐基氮的变化
挥发性盐基氮(TVB-N值)是衡量肉品贮藏或加工过程中腐败变质的一个重要评价指标。根据国家标准[30]规定:新鲜牛肉中挥发性盐基氮含量不超过20 mg/100 g。由图6可知,随着贮藏时间的延长,低温贮藏过程中水牛肉TVB-N值不断增加。在冷藏4 ℃条件下,水牛肉TVB-N值从最初的3.10 mg/100 g,贮藏第8 d达18.5 mg/100 g;贮藏10 d后其TVB-N值显著上升(P<0.05),达20.08 mg/100 g,超过国家标准限定值(20 mg/100 g),失去食用价值。在冻藏温度-60、-18 ℃条件下贮藏30 d,水牛肉TVB-N值分别为17.98、18.94 mg/100 g,均在卫生标准范围内,具有较高的食用价值。Ye等[31]和Hong等[32]研究了冷藏过程中黄牛里脊肉新鲜度的变化,研究发现黄牛肉TVB-N值从起初的6.9 mg/100 g,贮藏8 d后快速上升达19.9 mg/100 g,TVB-N值增加3倍。李升升等[33]研究了运输温度(4 ℃)对牦牛肉品质及货架期的影响,结果发现随着贮藏时间的延长,牦牛肉的TVB-N值显著增加,贮藏第8 d时牦牛肉的TVB-N值达14.36 mg/100 g,仍然符合鲜肉的卫生标准(GB 2707-2016[34])。低温贮藏过程中,随着贮藏时间的延长,水牛肉TVB-N值不断增加,这可能主要是由于水牛肉在内源性蛋白酶的作用下,肌肉蛋白发生降解成肽、胨和氨基酸,同时产生氨、胺类等碱性含氮物,进一步分解成腐胺、尸胺、亚精胺、酪胺和色胺等盐基态氮类物质[35]。

图6 低温贮藏过程中水牛肉挥发性盐基氮变化Fig.6 Variation of total volatile basic nitrogen of buffalo meat during low temperature storage
2.7 低温贮藏过程中水牛肉微生物指标的变化
2.7.1 低温贮藏过程中水牛肉菌落总数的变化 菌落总数衡量肉品贮藏过程中腐败变质的重要微生物指标之一。根据相关规定:一级鲜肉的菌落总数<104CFU/g,二级鲜肉菌落总数为104~106CFU/g,变质肉菌落总数>106CFU/g[36]。由图7可知,随着贮藏时间的延长,低温贮藏过程中水牛肉的菌落总数呈上升趋势。4 ℃冷藏前4 d,水牛肉菌落总数增加缓慢,达3.83lg(CFU/g),均在一级鲜度范围内;随后水牛肉菌落总数随着贮藏时间的延长呈显著上升的趋势(P<0.05);当贮藏第8 d时,菌落总数达5.91lg(CFU/g),属于二级鲜度范围;当贮藏第10 d,菌落总数达6.70lg(CFU/g),超过鲜肉菌落总数限量值。这可能主要是由于肌肉中假单胞菌、不动杆菌和肉食杆菌等腐败菌大量繁殖所致。李升升等[33]研究了运输温度(4 ℃)对牦牛肉菌落总数的影响,结果发现运输温度对菌落总数有显著影响。贮藏前2 d,水牛肉菌落总数达4.41lg(CFU/g),随后菌落总数显著增长;当贮藏第8 d,菌落总数达5.99lg(CFU/g),接近腐败程度。徐宏蕾等[37]研究了4 ℃冷藏条件下黄牛肉菌落总数的变化,研究发现贮藏前2 d菌落总数变化不大,其值达3.5lg(CFU/g);随后菌落总数迅速增长,第8 d菌落总数达5.50lg(CFU/g);当第12 d菌落总数高达5.96 lg(CFU/g),接近鲜肉的限定值。在-18、-60 ℃冻藏过程中,水牛肉的菌落总数始终维持在肉品一级鲜度范围内,且-60 ℃冻藏的水牛肉菌落总数低于-18 ℃冻藏水牛肉,这可能是由于降低温度更有利于抑制肉样中假单胞菌等细菌的正常生长繁殖。

图7 低温贮藏过程中水牛肉菌落总数的变化Fig.7 Variation of total number of colonies in buffalo meat during low temperature storage

图8 低温贮藏过程中水牛肉大肠菌群数的变化Fig.8 Variation of the number of coliform bacteria in buffalo meat during low temperature storage
2.7.2 低温贮藏过程中水牛肉大肠菌群数的变化 大肠菌群是评价肉品质量安全的重要品质指标之一,其数值越大说明肉品污染越严重,但目前国标中尚未规定鲜牛肉中的大肠菌群数的限量值[38]。由图8可知,随着贮藏时间的延长,不同低温贮藏条件下(4、-18和-16 ℃)水牛肉大肠菌群数总体上呈不断增加趋势。在4 ℃冷藏前2 d,水牛肉中的大肠菌群数从初始的3.0 MPN/g增加至6.23 MPN/g;贮藏第4 d开始,水牛肉中的大肠菌群数上升趋势几乎呈几何级数增长(P<0.05);贮藏第10 d,水牛肉中的大肠菌群数高达93.0 MPN/g,显著超过-18、-60 ℃冻藏水牛肉中的大肠菌群数(P<0.05),分别为7.4和3.6 MPN/g。-18、-60 ℃冻藏前20 d,水牛肉中的大肠菌群数增长缓慢,且数量均在16.0 MPN/g范围内;随后,水牛肉中的大肠菌群数增长速度加快。由此可见,降低贮藏温度,可以有效控制大肠菌群数量的增长速度,减缓水牛肉受大肠菌群的污染程度。
3 结论
低温贮藏过程中,随着贮藏时间的延长,水牛肉的a*值、L*值显著下降(P<0.05),但水牛肉的滴水损失、蒸煮损失、b*值、双烯值、挥发性盐基氮(TVB-N值)、菌落总数、大肠菌群数呈显著上升(P<0.05),pH呈先下降后上升的动态变化。三种不同低温贮藏下,4 ℃冷藏的水牛肉TVB-N值、菌落总数比-18、-60 ℃冻藏的水牛肉增长速度快,贮藏第10 d时水牛肉的TVB-N值和菌落总数分别为20.08 mg/100 g和6.7lg(CFU/g),超过卫生标准限定值,但-18、-60 ℃冻藏水牛肉均在卫生标准范围内。因此,水牛肉冷链贮藏运输过程中,4 ℃冷藏适合水牛肉的短期贮藏保鲜且品质下降较快,而-18 ℃冻藏适合水牛肉的长期保藏,且-60 ℃冻藏更有利于保持水牛肉品质稳定,延长产品的货架期。
