发酵对黄精主要活性成分及其抗氧化活性和刺激性的影响
2020-02-18杨婧娟马雅鸽杜雯霞赵声兰
杨婧娟,张 希,马雅鸽,杨 薇,陈 伟,杜雯霞,赵声兰
(云南中医药大学,云南昆明 650500)
黄精为百合科黄精属多年生草本植物,是我国药食两用资源。黄精含有黄精多糖、皂苷、黄酮、生物碱等活性成分,具有抗氧化、抗炎、调节血糖血脂、提高免疫和肿瘤抑制等作用[1]。但生黄精对咽喉、皮肤等有刺激性,食用时有口舌麻木感,因此,黄精一般经加工后使用,近年来在食品行业的开发应用越来越广泛。黄精的传统加工方法以蒸煮法为主,包括单蒸、重蒸、加辅料蒸等,如目前市场上推出的即食黄精为九蒸九晒加工所得,直接食用或泡水泡茶,口感大大改善。然而,由于黄精中含有较多糖类成分,传统加工方法长时间的高温加热会因美拉德反应产生过多5-羟甲基糠醛,研究显示该成分对人体横纹肌和内脏有毒副作用[2]。因此,寻找更有效的方法合理加工黄精具有重要意义。
应用微生物发酵天然植物资源可改变原料活性或降低其毒副作用。发酵过程反应条件温和,而且在微生物代谢产酶作用下,可起到破壁促进活性物质溶出或实现对底物某些活性成分的结构修饰和转化作用[3-5]。有研究显示应用黑曲霉发酵虎杖可转化虎杖苷为白藜芦醇[6];茵陈蒿叶被灵芝菌固态发酵后抗炎症作用显著增强[7];以酿酒酵母和赤红曲霉共发酵番石榴后,番石榴榭皮素和总酚含量及抗氧化活性显著提高[8];蕨菜以木蹄层孔菌、灵芝和裂褶菌发酵后抗炎作用也得到增强[9]。发酵可降解原料中的毒性成分或将其转化为低毒物质,如银杏叶经发酵后银杏酸被分解与转化,毒副作用减弱[10]。此外,植物资源作为底物可诱导微生物产生有益次级代谢产物如真菌多糖、红曲Monacolin类化合物[11]等起到协同增效作用的物质。
本研究应用前期实验筛选出的药(食)用菌凸圆灵芝固态发酵生黄精,比较发酵前后其抗氧化活性及刺激性的差异,并探讨这些变化与发酵引起主要活性成分改变的联系,为发酵法进一步应用于黄精加工提供科学依据。
1 材料与方法
1.1 材料与仪器
黄精根茎 50 ℃干燥,粉碎后过40目筛备用,云南新世纪药业有限公司;凸圆灵芝(白芝)GIM5.6 广东省微生物菌种保藏中心(接种于玉米粉20 g/L、麸皮10 g/L、豆粕10 g/L、葡萄糖20 g/L、KH2PO41.5 g/L、MgSO41 g/L的液体培养基中,150 r/min,28 ℃培养7 d制成液体种子备用);HUVEC人脐静脉内皮细胞、SIRC兔角膜上皮细胞 华拓生物科技有限公司;高糖DMEM培养基 美国Gibco公司;胎牛血清 杭州四季青试剂公司;胰蛋白酶、双抗、人参皂苷Rb1北京索莱宝科技有限公司;所用其他试剂 均为分析纯。
SW-CJ-2D型超净工作台 苏州净化设备有限公司;L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;INFINITE M200 PRO酶标仪 瑞士Tecan;LRH-250生化培养箱 上海医疗器械五厂;CO2培养箱311型 美国Thermo Fisher;倒置显微镜CKX31 日本Olympus;高效液相色谱仪、Thermo ODS-2 C18柱(4. 6 mm×250 mm,5 μm) 安捷伦1260 Infinity II。
1.2 实验方法
1.2.1 黄精的加工 发酵法加工黄精:取一定量干燥粉碎生黄精与辅料小麦麸皮按照质量比3∶1比例混匀后灭菌备用(121 ℃灭菌20 min),在无菌条件下接种10%凸圆灵芝液体种子,于28 ℃固态发酵12 d,60 ℃干燥12 h即得黄精发酵样。取5 g发酵样以蒸馏水按1∶20料水比95 ℃回流浸提,收集上清液,定容至250 mL,于4 ℃保存备用。
蒸制法加工黄精:取一定量干燥粉碎生黄精,用蒸馏水按料水比1∶20浸润6 h后取出,置于蒸锅中蒸制6 h,停火焖润6 h,60 ℃干燥12 h即得黄精蒸制样[12]。取5 g蒸制样以蒸馏水按1∶20料水比95 ℃回流浸提,收集上清液,定容至250 mL,于4 ℃保存备用。
酒制法加工黄精:取一定量干燥粉碎生黄精,按每100 kg黄精用20 kg黄酒的比例,将其闷润直至酒吸尽,置于蒸锅中蒸10 h,60 ℃干燥12 h即得黄精酒制样[13]。取5 g酒制样以蒸馏水按1∶20料水比95 ℃回流浸提,收集上清液,定容至250 mL,于4 ℃保存备用
1.2.2 黄精的抗氧化活性测定
1.2.2.1 DPPH自由基清除率的测定 取1.2.1加工所得不同黄精样液,参照文献[14]中DPPH法测定抗氧化能力。设不同质量浓度(0.005、0.01、0.02、0.04、0.06、0.08 mg/mL)抗坏血酸(VC)同法操作,以VC浓度为横坐标,DPPH自由基清除率为纵坐标绘制标准曲线(y=15.45x+0.3335,R2=0.9935),计算样品的VC当量抗氧化能力(ascorbic acid equivalent antioxidant capacity,AEAC)。
1.2.2.2 铁离子还原能力的测定 取1.2.1加工所得不同黄精样液,参照文献[15]中铁离子还原能力法测定抗氧化能力。设不同质量浓度(0.01、0.02、0.04、0.06、0.08、0.10 mg/mL)VC同法操作,以VC浓度为横坐标,吸光度值为纵坐标绘制标准曲线(y=6.5815X+0.0304,R2=0.9972),计算样品的VC当量抗氧化能力(AEAC)。
1.2.2.3 氧化损伤的HUVEC的保护作用 利用过氧化氢建立人脐静脉内皮细胞(HUVEC)氧化损伤模型评价黄精的抗氧化作用[16]。取对数生长期的HUVEC细胞,以105个/孔细胞密度接种于96孔板,37 ℃,CO2培养约24 h。将细胞分为正常对照组:用完全培养液(89%高糖DMEM培养液+10%胎牛血清+1%双抗)培养细胞,每隔24 h换1次液;过氧化氢氧化损伤组:以完全培养液继续培养24 h后,加入H2O2溶液使其在孔内终浓度为1.1 mmol/L(建模实验筛选浓度),诱导损伤4 h;黄精样品组:预先加入1.2.1加工黄精样品(调整样液在孔内浓度为原料质量浓度10 mg/mL)培育24 h后,再加入1.1 mmol/L H2O2诱导损伤4 h。MTS法检测细胞存活率。
1.2.3 黄精的刺激性评价实验 应用兔角膜上皮细胞(SIRC)短时暴露法评价黄精的刺激性[17-18]。选择具有明确眼刺激性的十二烷基硫酸钠(SDS,5 mg/mL)为阳性对照,甘油(10 mg/mL)为阴性对照。取对数生长期SIRC细胞,以105个/孔的细胞密度接种于96孔板,每孔100 μL,待细胞生长融合后,用SDS、甘油和1.2.1不同加工方法所得黄精样品(原料质量浓度10 mg/mL)分别处理细胞5 min,每个样品做6个复孔。除去样品后用PBS洗3次,每孔中加入100 μL H-DMEM培养基和10 μL MTS溶液,放入37 ℃ CO2培养箱中培养3 h左右,于490 nm测定吸光度,计算细胞存活率。
1.2.4 黄精主要活性成分提取及含量测定 黄精多糖提取及含量测定:以葡萄糖为标准品,按苯酚硫酸法[19]操作绘制标准曲线(y=45.238x-0.0444,R2=0.9975)。取加工黄精样品,按料液比1∶10 (w/v)加入80%乙醇70 ℃回流提取1次(1 h),过滤后滤渣加入10倍量蒸馏水95 ℃回流提取1次(1 h),过滤收集上清液,滤渣再加入7倍量蒸馏水重复提取1 h,收集上清液,合并两次水提液,减压浓缩至原体积1/10,加入乙醇使含醇量达75%,于4 ℃放置过夜,3000 r/min离心10 min收集沉淀,依次用无水乙醇、丙酮、乙醚洗,将洗涤处理后的沉淀于40 ℃烘干,即得黄精多糖粗提物。将不同加工黄精样品按上述步骤制备多糖粗提物后用热蒸馏水定容至100 mL同标准物质测定方法操作,计算样品中多糖含量。
多糖含量(mg/g)=nCV1V3/WV2
式中,n为测量稀释倍数,C为根据标准曲线计算所得浓度,V1为测定反应体系总体积,V2为测定取用受试样液体积,V3为测定样品定容总体积,W为样品称量质量。
黄精皂苷提取及含量测定:以人参皂苷Rb1为标准品,按香草醛高氯酸比色法[20]操作,绘制标准曲线(y=254.45x-0.0332,R2=0.9952)。取加工黄精样品按料液比1∶10 (w/v)加入80%乙醇70 ℃回流提取1 h,重复提取2次后3000 r/min离心10 min收集上清液,减压浓缩成固形物,用蒸馏水溶解后按1∶1的体积比用水饱和正丁醇萃取3次,取正丁醇相收集减压浓缩成固形物为黄精皂苷粗提物。取0.5 g皂苷粗提物用甲醇定容至100 mL同标准物质测定方法操作,计算样品中皂苷含量。
皂苷含量(mg/g)=nCV1V3/WV2
式中,n为测量稀释倍数,C为根据标准曲线计算所得浓度,V1为测定反应体系总体积,V2为测定取用受试样液体积,V3为测定样品定容总体积,W为样品称量质量。
黄精多糖组分含量分析:以混合单糖(甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖、葡萄糖醛酸、半乳糖醛酸、木糖、岩藻糖)为标准参照物质,按照文献[21]采用柱前PMP衍生化HPLC法分析黄精多糖的单糖组成。色谱条件Thermo ODS-2 C18柱(4. 6 mm×250 mm,5 μm),流动相:乙腈-0.05 mol/L pH6.7磷酸盐缓冲液(19∶81),流速1 mL/min,检测波长:250 nm,柱温30 ℃,进样量10 μL。
1.2.5 发酵对黄精抗氧化活性及刺激性的影响
1.2.5.1 发酵黄精多糖及皂苷粗提物的抗氧化活性评价 按照1.2.4方法制备发酵黄精多糖和皂苷粗提物,设置生黄样、发酵样、发酵空白对照样、单菌对照样进行抗氧化活性评价:分别取不同处理所得黄精多糖和皂苷样液,按照1.2.2.1操作测定DPPH自由基清除率、按照1.2.2.2操作测定铁离子还原力。通过上样浓度筛选实验后分别取黄精多糖(0.6 mg/mL)、黄精皂苷(0.4 mg/mL)按照1.2.2.3操作,评价各样品组对HUVEC氧化损伤的保护作用。
其中,发酵空白对照样的设置是为排除发酵过程中辅料麸皮加入对活性评价造成干扰,在黄精及辅料麸皮混合灭菌后去除“接种凸圆灵芝”步骤,其余同发酵加工法操作制备所得样品;单菌对照样的设置是为排除凸圆灵芝发酵产生次级代谢产物对活性评价造成干扰,以未添加黄精的麸皮基质同发酵加工法操作制备所得样品。
1.2.5.2 发酵黄精多糖及皂苷粗提物的刺激性评价 按照1.2.4方法制备发酵黄精多糖和皂苷粗提物,为排除发酵过程中辅料麸皮加入和凸圆灵芝发酵代谢产物对黄精刺激性评价造成的干扰,同1.2.5.1设置生黄精、发酵黄精、发酵空白对照样(黄精+麸皮辅料,但不接种药用菌发酵)、单菌对照样(辅料麸皮+凸圆灵芝单独发酵),同时,以十二烷基硫酸钠(SDS,5 mg/mL)为阳性对照,甘油(5 mg/mL)为阴性对照,取各样品组黄精多糖和皂苷粗提物(5 mg/mL)按照1.2.3操作进行刺激性评价。
1.3 数据处理
每个试验至少独立重复3次,数据以均数±标准差表示。使用SPSS 20.0软件对数据进行统计处理(ANOVA,Dunnett’s method),*表示具有显著性差异(P<0.05),**表示具有极显著性差异(P<0.01)。
2 结果与分析
2.1 不同加工方法的黄精的抗氧化活性
由表1测定结果可知,黄精经过加工后抗氧化活性发生了改变。其中,黄精对DPPH自由基的清除能力在经过各种方法加工后均得到了提高,且蒸制法效果较好。发酵法加工黄精后其铁离子还原力得到了提高,蒸制及酒制黄精反而显示出还原能力的降低,这可能与不同加工方法造成黄精中的主要活性成分如多糖、皂苷含量及其组分比例改变差异有关[13]。生黄精和加工所得黄精对氧化损伤的HUVEC细胞均有一定保护作用,但蒸制和发酵黄精的保护效果较好。其中,相比于生黄精组,发酵处理组的保护作用提高达显著水平(P<0.05),HUVEC经发酵黄精处理后对过氧化氢氧化损伤有良好的预防作用,细胞存活率提高到78.13%±4.25%,且效果优于蒸制和酒制加工样品。出现该趋势主要跟发酵处理伴随的生物转化作用及可能产生某些活性代谢产物有关[22]。综合三项考察指标,发酵法加工对提高黄精抗氧化活性更具优势。

表1 不同加工方法所得黄精的抗氧化活性Table 1 Antioxidant activities of Polygonati sibiricum treated by different methods
注:HUVEC过氧化氢氧化损伤模型组的细胞存活率为54.66%±4.12%;同列不同上标字母表示数据差异显著,P<0.05。
2.2 不同加工方法的黄精的刺激性
图1结果显示,相比于甘油(阴性对照),生黄精表现出一定程度的刺激性,但SIRC细胞存活率显著高于SDS(阳性对照)。蒸制、酒制和发酵加工后黄精刺激性均有改善。其中,相比生黄精处理组SIRC细胞存活率(68.55%±5.23%),发酵样细胞存活率提高到90.60%±3.55%,说明发酵处理能显著(P<0.05)降低生黄精的刺激性,在三种加工方法中刺激性改善效果最显著。
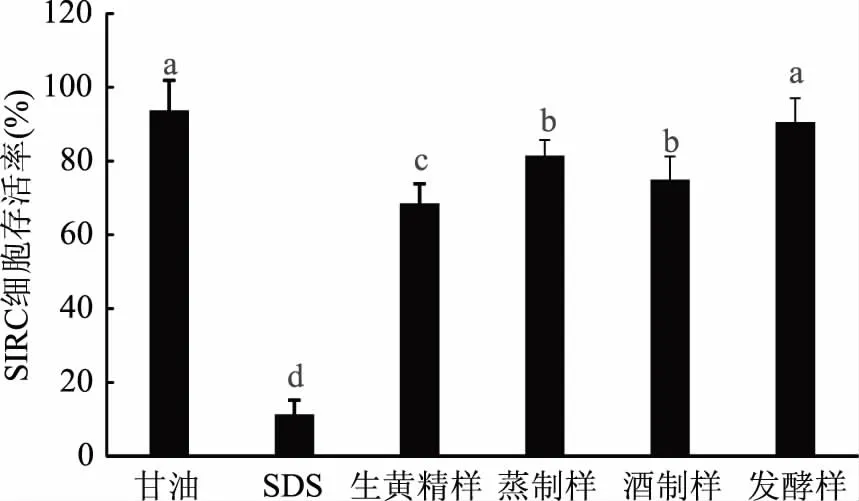
图1 不同加工方法所得黄精的刺激性Fig.1 Irritation of Polygonatum sibiricum treated by different methods注:不同上标字母表示数据差异显著,P<0.05。
2.3 不同方法加工的黄精中主要活性成分含量测定结果
如图2结果显示,传统热加工为主的方法与发酵法处理后黄精中的多糖及皂苷含量均有所下降。相比于生黄精,传统蒸制和酒制加工后出现活性物质含量减少的主要原因是由于较长时间的高温蒸制,会引起其中活性成分一定程度的分解,而且伴随蒸气冷凝后的流失也会带走部分活性物质,造成多糖和皂苷含量减少相对较多。发酵加工引起的成分变化相对复杂。由于底物中加入促进菌体生长的辅料麸皮中含有一定多糖成分,因此相比于生黄精,发酵前原底物多糖含量先增加,但发酵过程微生物作用下对活性成分有分解或转化作用会引起含量减少,而药用菌代谢可能会产生出新的活性物质如真菌多糖或皂苷成分,对相应活性物质含量变化产生一定影响[23]。
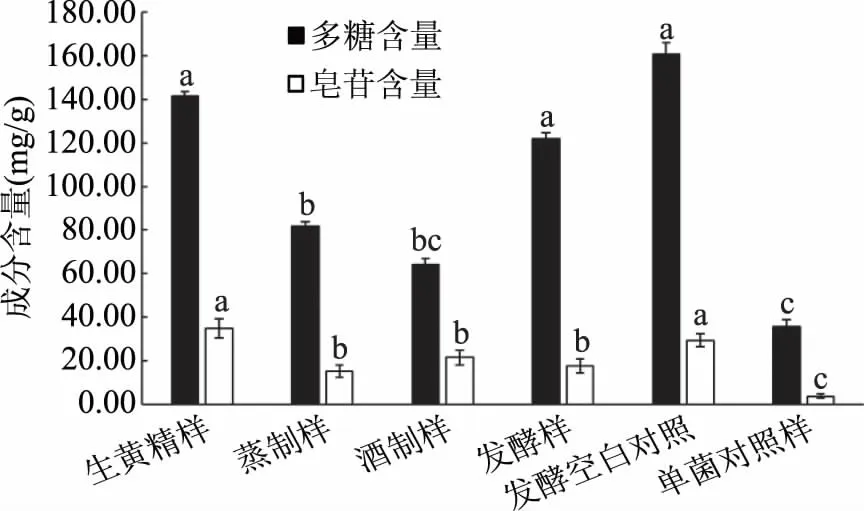
图2 不同加工方法所得黄精多糖及皂苷含量Fig.2 Concentation of total polysaccharide and and saponins of Polygonatum sibiricum treated by different methods注:不同小写字母表示同一指标不同样品间 数据差异显著(P<0.05)。
另外,不同的加工方法除了引起黄精中多糖和皂苷总含量的变化外,还会对这些活性成分的组分造成影响。实验选择多糖中常见组分葡萄糖、半乳糖、甘露糖、鼠李糖等为单糖标准参照物质(图3),分析了黄精加工物中多糖的构成组分,结果见表2。
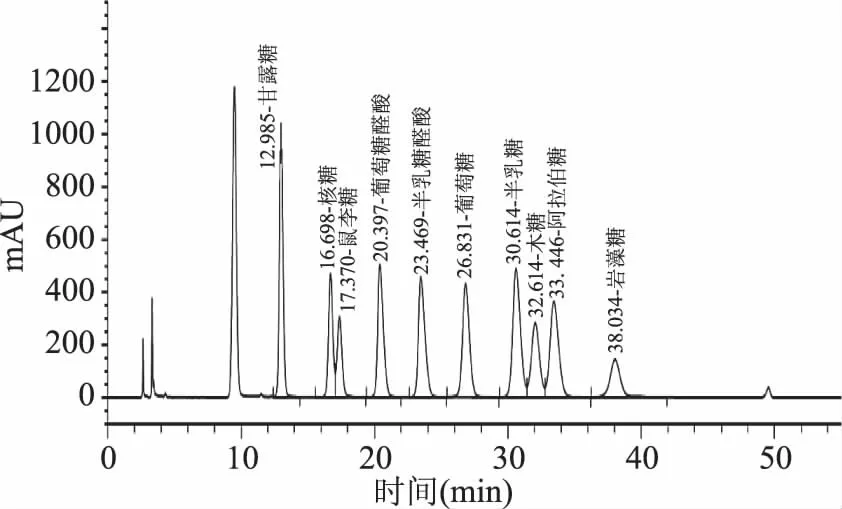
图3 标准混合单糖的HPLC图Fig.3 HPLC spectrogram of standard mixed monosaccharide

表2 不同加工方法所得黄精总多糖粗提物的单糖组分含量(mg/g固形物)Table 2 Contents of monosaccharide components in total polysaccharide and of Polygonatum sibiricum treated by different methods(mg/gsolids)
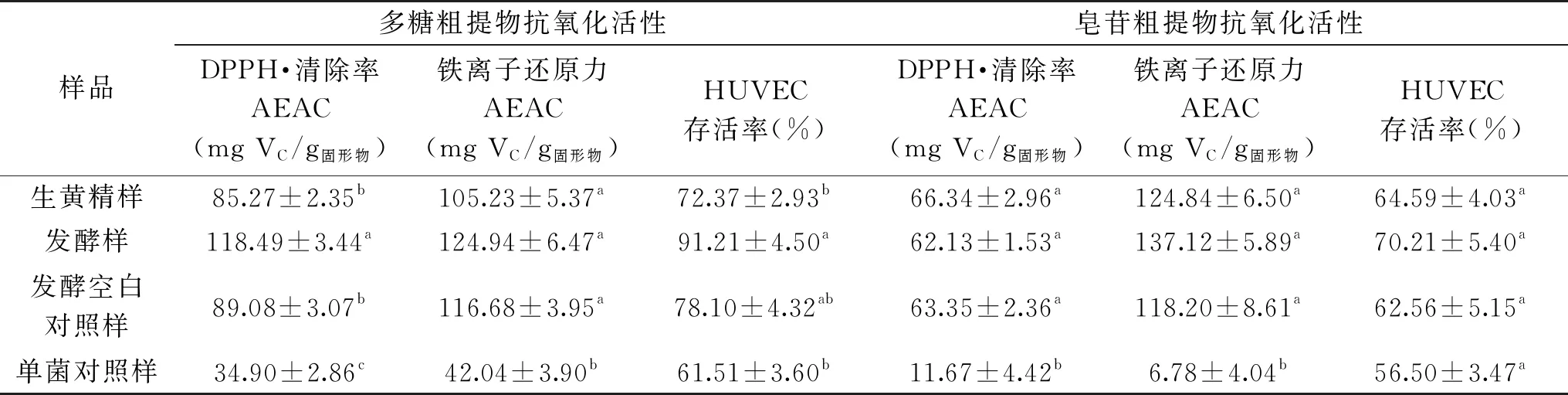
表3 不同处理组多糖粗提物和皂苷粗提物的抗氧化能力Table 3 Antioxidant activities of polysaccharide and and saponins from different samples
注:HUVEC过氧化氢氧化损伤模型组的细胞存活率为57.02%±3.71%;同列不同上标字母表示数据差异显著,P<0.05。
由HPLC实验结果可知,生黄精多糖中含量最高的单糖组分为甘露糖、葡萄糖、半乳糖和阿拉伯糖。三种方法加工后所得多糖粗提物中甘露糖和阿拉伯糖含量均减少;蒸制和酒制加工引起半乳糖含量增加,而发酵处理后该成分含量降低。相比生黄精和传统加工方法,发酵处理后多糖组分变化最大的区别即是鼠李糖含量增加,半乳糖醛酸含量减少;此外,生黄精中含量极少的核糖、葡萄糖醛酸、岩藻糖在发酵样中含量均较高。参照发酵空白组和单菌发酵组的测试结果,推测发酵组鼠李糖组分含量的增加并不是由生黄精和麸皮组分、菌代谢物的简单叠加引起的,因为单菌对照样中该单糖含量仅为(0.89±0.01) mg/g,而发酵样中为(20.92±0.00) mg/g,发酵过程微生物引起的组分转化是最可能原因。甘露糖6位的羟基被氢取代后得到的衍生物即为鼠李糖;半乳糖醛酸的减少可能由菌分解所致;发酵粗多糖中增加的核糖推测是由凸圆灵芝代谢产生的多糖组分[24],因为生黄精和空白对照样中该成分含量极低。木糖和岩藻糖的升高可能跟麸皮多糖组分或菌代谢产生多糖组分的引入有关。
2.4 发酵对黄精抗氧化活性及刺激性的影响
2.4.1 发酵黄精多糖及皂苷粗提物的抗氧化活性 生黄精经发酵加工后抗氧化活性得到提高,刺激性降低,同时其中主要活性成分多糖和皂苷的总含量发生了改变,多糖组分也随之变化。这提示黄精活性与刺激性的改变与加工引起的多糖和皂苷成分变化有一定联系。因此,将发酵黄精中多糖和皂苷成分分离出来,分别测试其抗氧化活性及对刺激性的影响,有助于阐明其中的内在联系。
表3实验结果显示,相比于生黄精,发酵黄精皂苷粗提物活性变化不明显,而发酵黄精多糖粗提物组的DPPH自由基清除率和HUVEC存活率指标显著(P<0.05)提高,提示黄精发酵加工后抗氧化活性的增强主要与多糖变化有关。实验考虑到发酵底物中辅料麸皮成分及微生物代谢产物可能给活性带来的影响,增设了发酵空白对照样和单菌对照样加入分析。在多糖粗提物活性测试组中,发酵空白对照样相比生黄精样活性略有提高,推测麸皮中的溶出物的产生或短时间高温灭菌操作对多糖的抗氧化活性和刺激性有略微影响;单菌对照样也显示出一定程度的抗氧化活性,推测其为发酵黄精总活性的提高起到协同增效作用。成分分析结果显示,发酵黄精多糖含量(121.84±2.94) mg/g相比生黄精含量(141.44±2.25) mg/g有所减少,但抗氧化活性反而提高,这可能与发酵过程微生物对生黄精中原本的多糖组分转化有关[25]。
生黄精多糖中含量较高的单糖组分甘露糖、葡萄糖、半乳糖和阿拉伯糖经发酵后含量减少,而鼠李糖含量增加,多糖中的这些主要组分单糖含量及相互间比例的改变,可能对多糖的活性造成影响。刘柳等[26]对从黄精中分离纯化的多糖进行组分分析,发现其中的两种多糖PSW4A和PSW2A-1均由鼠李糖、阿拉伯糖和半乳糖醛酸组成,但各种类之间比例的差异却显示出仅有PSW4A具明显的促进免疫功能活性。因此,发酵加工黄精抗氧化活性的提高与生黄精中原多糖组分的变化及真菌多糖等成分的引入有关。
2.4.2 发酵黄精多糖及皂苷粗提物的刺激性 由图4结果可以看出,生黄精样皂苷提取物处理SIRC细胞存活率为50.13%±6.35%,生黄精样多糖提取物细胞存活率为67.21%±6.34%,黄精皂苷粗提物表现出比黄精多糖更强的刺激性,可能黄精是刺激性的最关键成分。经发酵后黄精多糖粗提物组及皂苷粗提物组的细胞存活率均得到提高,表明其刺激性降低。单菌对照样对比阴性对照(甘油)显示无刺激性,可排除辅料麸皮及微生物代谢物对刺激性的影响。空白对照样相比生黄精样刺激性有一定改善,可能与灭菌的短时间高温处理造成多糖和皂苷含量少量减少有关。而发酵后刺激性减弱伴随黄精中多糖和皂苷含量的进一步降低,尤其皂苷含量显著降低,相对生黄精减少49.8%。

图4 不同处理组多糖粗提物和皂苷粗提物的刺激性Fig.4 Irritation of polysaccharideand and saponins from different samples注:不同字母表示同种粗提物不同 样品间数据差异显著,P<0.05。
皂苷虽然具有多种功能活性,但该成分本身对黏膜有刺激性,还具有一些毒副作用[27]。有研究显示以一定剂量茶皂苷连续灌胃处理3个月的Wistar大鼠,出现了消化道内腔明显膨胀,贲门窦粘膜上皮组织异常增生,吼黏膜坏死,气管糜烂的现象[28]。皂苷苷元母核的类型或苷元上连接的糖链不同等会对皂苷毒性大小造成影响[29]。如有研究显示甾体皂苷C-3位糖链的α-1,2连接的末端鼠李糖基是其细胞毒性的重要活性片断。利用新月弯孢霉特异性地将其定向水解后可减轻其毒副作用[30]。钟凌云等[31]研究发现,酒蒸制黄精后其中的薯蓣皂苷元含量下降,而薯蓣皂苷元是其他许多皂苷元的前体,是否在加工处理后转化为其他皂苷元尚未明确。这些研究提示黄精中的皂苷成分可能是关联其刺激性的一个关键指标,发酵处理后引起其含量降低及皂苷组分结构改变,从而刺激性减弱。此外,生黄精加工后总多糖及一些挥发性成分如正己醛、莰烯等的减少也可能对黄精毒性降低发挥了作用,这有待进一步研究。
3 结论
研究结果显示,发酵法相比于传统蒸制及酒制加工方法,对提高黄精抗氧化活性及降低刺激性表现出更突出的效果。发酵黄精活性的提升主要与其中的多糖在发酵后变化有关,虽然多糖总含量降低,但多糖组分单糖相比生黄精发生了变化,含量较高的单糖组分甘露糖、葡萄糖、半乳糖和阿拉伯糖经发酵后含量减少,而鼠李糖含量显著(P<0.05)增加,且这些单糖间的比例也发生了变化;此外,生黄精中含量极少的核糖、葡萄糖醛酸、岩藻糖在发酵黄精中含量也提高。黄精刺激性主要受皂苷成分影响更大,发酵后刺激性减弱与总皂苷含量显著(P<0.05)降低有一定联系,其原因可能与皂苷组分含量及结构改变等有关,同时也不排除多糖及挥发性成分如正己醛、莰烯等的影响,但其具体变化有待进一步研究,实验表明应用发酵法加工黄精反应条件温和,能更好的保留活性成分,而且发酵过程引起活性物质发生组分转化等可进一步提高黄精生物活性及降低其刺激性,具有重要的实际应用价值。
