不同产地泽泻HPLC 指纹图谱建立及模式识别
2020-02-18金立阳汪英俊叶淑青李存玉彭国平郑云枫
金立阳,汪英俊,叶淑青,李存玉,彭国平,郑云枫
(南京中医药大学药学院,江苏 南京 210023)
泽泻是泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎[1],其传统主产地为四川、福建与江西。然而根据近几年文献报道与实地考察发现,四川产量最大,广西次之,福建与江西由于市场因素影响已逐渐退出主产区[2]。目前,已有泽泻指纹图谱的相关报道[3-7],但针对四川、广西产地泽泻指纹图谱与差异性成分的研究较少。
本研究收集了19 批四川产地泽泻、11 批广西产地泽泻,通过指纹图谱结合模式识别(聚类分析、主成分分析和正交最小二乘法判别分析)进行综合分析[8-11],将这2 个产地药材进行区分,并探讨它们之间成分的差异,以期为其质量控制与评价、制剂生产、临床应用提供依据。
1 材料
Waters e2695 型高效液相色谱仪(配置2998PDA 二极管阵列检测器,美国Waters 公司);Triple TOFTM5600 型质谱仪(美国AB Sciex 公司);KH-250B 型超声波清洗器(昆山市超声仪器有限公司);AL210 型电子分析天平(万分之一,瑞士梅特勒-托利多公司);HP-02 型多功能粉碎机(永康市帅通电器厂)。
对照品泽泻醇A(批号JBZ-1648)、24-乙酰泽泻醇A(批号JBZ-1665)、泽泻醇B(批号JBZ-1649)、23-乙酰泽泻醇B(批号JBZ-1419)质量分数均大于98.0%,均购于南京金益柏生物技术有限公司。乙腈(色谱纯,美国Tedia 公司);甲酸(色谱纯,德国Merck 公司);冰醋酸为分析纯。30 批泽泻分别收购于四川和广西,具体见表1,经南京中医药大学药学院严辉副教授鉴定为泽泻科植物泽泻Alisma orientale(Sam.)Juzep.的干燥块茎。

表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 对照品溶液制备 精密称取泽泻醇A、24-乙酰泽泻醇A、泽泻醇B、23-乙酰泽泻醇B 对照品适量,加乙腈溶解,即得。
2.2 供试品溶液制备 称取泽泻粉末(过5 号筛)2.0 g,置于具塞锥形瓶中,加入10 mL 乙腈,称定质量,超声提取(功率250 W、频率40 kHz)30 min,放冷,乙腈补足减失的质量,摇匀,过0.22 μm 微孔滤膜。精密吸取1 mL 续滤液,加入2 μL 冰醋酸,摇匀,即得。
2.3 色谱条件 Hanbon Hedera ODS-2 C18柱(250 mm×4.6 mm,5 μm);流动相为水(A)-乙腈(B),梯度洗脱(0~15 min,60%~45%A;15~32 min,45%~5%A;32~50 min,5%~3%A;50~55 min,3%A);体积流量1.0 mL/min;柱温35 ℃;检测波长210 nm;进样量10 μL。
2.4 质谱条件 电喷雾离子源(ESI);正离子模式检测;扫描范围m/z50~2 000;喷雾电压5 500 V;解簇电压100 V;碰撞电压40、20 V;离子源温度600 ℃;雾化器压力413.7 kPa;辅助加热器压力413.7 kPa;气帘气压力275.8 kPa。
3 方法学考察
3.1 精密度试验 取泽泻1 份,按“2.2”项下方法制备供试品溶液,在“2.3”项条件下连续进样6 次。以泽泻醇B 为对照峰,测得各共有峰相对保留时间、相对峰面积RSD 均小于2.08%,表明仪器精密度良好。
3.2 重复性试验 取同一泽泻6 份,按“2.2”项下方法制备供试品溶液,在“2.3”项条件下进样,以泽泻醇B 为对照峰,测得各共有峰相对保留时间、相对峰面积RSD 均小于2.93%,表明该方法重复性良好。
3.3 稳定性试验 取泽泻1 份,按“2.2”项下方法制备供试品溶液,在“2.3”项条件下于0、2、4、8、12、24 h 进样,以泽泻醇B 为对照峰,测得各共有峰相对保留时间、相对峰面积RSD 均小于2.53%,表明供试品溶液在24 h 内稳定性良好。
4 不同产地泽泻指纹图谱建立
4.1 相似度分析 30 批泽泻按“2.2”项下方法制备供试品溶液,在“2.3”项条件下进样,记录55 min 色谱图。将30 批图谱数据导入“中药色谱指纹图谱相似度评价系统软件(2012 版)”,计算各批泽泻与对照图谱的相似度。结果,四川产地泽泻相似度为0.937~0.968,广西产地泽泻相似度为0.240~0.364,表明两地药材成分差异性较大,而同一产地差异较小。因此,不能建立同一指纹图谱,而应各自进行分析。
4.2 指纹图谱建立 分别将19 批四川产地泽泻(S1~S19)、11 批广西产地泽泻(S20~S30)图谱数据导入“中药色谱指纹图谱相似度评价系统软件(2012 版)”进行分析,结果见图1。S1~S19的相似度分别为0.995、0.995、0.975、0.976、0.995、0.977、0.997、0.967、0.994、0.973、0.990、0.991、0.992、0.987、0.997、0.996、0.993、0.996、0.992,而S20~S30 分别为0.982、0.960、0.987、0.978、0.963、0.980、0.994、0.948、0.976、0.998、0.990,两地均在0.94 以上,表明同一产地泽泻成分接近,稳定性较好。

图1 不同产地样品HPLC 指纹图谱Fig.1 HPLC fingerprints of samples from different growing areas
4.3 共有峰标定与分析 根据指纹图谱分析结果,分别从19 批四川产地泽泻中标定了17 个共有峰,11 批广西产地泽泻中标定了12 个,按保留时间进行排序,共有21 个色谱峰,见图2。由此可知,峰1、2、11、13~14、16、18~19 为两地共有,峰3~7、9~10、20~21 为四川独有,而峰8、12、15、17 为广西独有;四川峰14、16、18 较高,而广西峰11 较高。根据对照图谱可以直观看出,四川、广西产地泽泻成分差异明显。

图2 不同产地样品对照图谱Fig.2 Reference chromatograms of samples from different growing areas
5 化学模式识别
5.1 聚类分析 将不同产地、批次样品指纹图谱标定的21 个色谱峰峰面积导入SPSS 24.0 软件(若在该保留时间下无对应色谱峰,则将峰面积定为0),峰面积数据进行Z 得分标准化后以平方Euclidean 距离为度量标准,采用组间联接法,对标准化的数据进行系统聚类,结果见图3。根据聚类分析结果,在度量距离为10 时,30 批泽泻可聚为2 类,其中S1~S19 聚合为一类,S20~S30 聚合为一类,不同批次样品按产地聚合,与相似度分析结果一致。

图3 30 批样品聚类树状图Fig.3 Dendrogram of thirty batches of samples
5.2 主成分分析 将不同产地、批次样品指纹图谱标定的21 个色谱峰峰面积导入SIMCA14.1 软件(若在该保留时间下无对应色谱峰,则将峰面积定为0),采用无监督模式识别-主成分分析,用前2个主成分进行区分。建立模型的R2Y(累计解释参数)为0.863,Q2(预测能力参数)为0.751,表明其区分与预测能力良好,可进行产地区分。主成分分析得分图见图4,以中轴为界限,左边为广西产地泽泻,右边为四川产地泽泻。

图4 30 批样品主成分分析图Fig.4 Principal component analysis plot for thirty batches of samples
5.3 正交最小二乘法判别分析 相似度分析、聚类分析、主成分分析都可以发现2 个产地泽泻差异性较大,为了进一步探究它们之间成分的差异性,使用正交最小二乘法判别分析,生成变量重要投影,见图5,得出各标定峰对于区分两地泽泻的贡献程度。以VIP 大于1 作为标准,筛选出了6 个对区分2 个产地泽泻贡献较大的变量,按影响大小排列依次为峰16、峰11、峰19、峰18、峰14、峰13,两地共有峰中都包括这6 种成分。
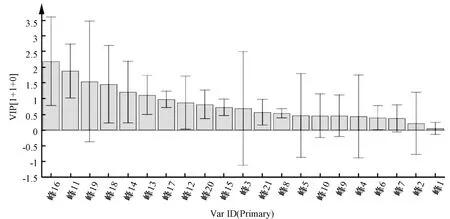
图5 变量重要性投影图Fig.5 VIP plot of OPLS-DA
以上结果表明,四川、广西产地泽泻中这6 种成分区别较大,可能是导致其相似度较差的主要原因,可据此对2 个产地样品进行鉴别。
5.4 共有峰定性分析 为了确认四川、广西产地泽泻之间的差异性成分,采用HPLC-MS/MS 结合对照品比对,对上述标定的21 个色谱峰进行鉴定,在“2.3”“2.4”项条件下进样(为了提高检出灵敏度,流动相中的水换为0.1%甲酸[12]),结果见表2。

表2 样品成分二级质谱鉴定结果Tab.2 MS/MS identification results of constituents in samples
除11~13 号峰外,各成分均存在准分子离子[M+H]+。以11 号峰为例,正离子模式下扫描显示m/z473[M +H-H2O]+,455[M +H-2H2O]+,437[M+H-3H2O]+,383[M+H-H2O-C4H10O2]+,339[M+H-H2O-C6H14O3]+。依据文献[14]中泽泻醇A 裂解数据结合相应对照品,鉴定11 号峰为泽泻醇A。其余成分按该方法,依照相关文献数据[13-15]及对照品,结合一级、二级离子碎片信息进行鉴定。
6 讨论
本实验用甲醇、80%乙腈、90%乙腈、乙腈进行超声提取,结果发现乙腈提取时较甲醇基线更稳定,较80%、90% 乙腈出峰多,峰形好,此外2015 年版《中国药典》中泽泻也采用该溶剂提取[1]。因此,本实验选择乙腈。
泽泻作为常用的传统中药,其产地在不断变迁,由内陆向沿海地区扩张[16]。自从清代以来,其道地产区一直是福建,但目前当地种植面积与市场占有率严重下降[2],故对比四川、广西这2 个主要产区的泽泻更具有实际意义。
结果显示,四川、广西产地泽泻成分差异较大,通过化学模式识别结合HPLC-MS/MS,筛选并鉴定出6 种主要差异性成分,按影响大小排列依次为泽泻醇B、泽泻醇A、11-去氧泽泻醇C、23-乙酰泽泻醇B、泽泻醇O、24-乙酰泽泻醇A。今后,可进一步以这6 种成分为指标,对两地泽泻进行区分,如针对其中差异性最大的泽泻醇B 进行含有量测定;制定两地泽泻醇B 含有量限度标准以判别药材产地。
四川、广西产地泽泻成分的差异性可能是由种质差异与生长环境差异造成的,四川种质来源于当地,并进行了杂交留种实验;广西种质来源于福建,后为当地留种,并且未经过择优选育[2];由于地理位置不同,导致两地水质、土壤、日照、温度等方面存在差别。有研究针对泽泻根际土壤与块茎中无机元素进行相关性分析,发现块茎中部分元素积累受土壤影响明显[17],表明不同土壤背景也可能是导致泽泻成分变化的原因之一。
现代研究表明,泽泻中24-乙酰泽泻醇A、23-乙酰泽泻醇B、泽泻醇A 都具有降血脂活性,但泽泻醇B 却不能抑制血脂升高[18],表明四川、广西产地泽泻成分的明显差异可能会导致其药理作用区别较大。本研究筛选出的6 种主要差异性成分需要作进一步药理分析,结合与药效之间的关系探究可能导致的药效差别。在当前成分与药效之间关系还不明确的情况下,制剂生产与临床应用时应注意泽泻来源,并使用固定产地的药材以保障质量稳定、疗效确切。
