表面活性剂对气-液界面纳米颗粒吸附规律的影响*
2020-02-18张旋张天赐葛际江蒋平张贵才
张旋 张天赐 葛际江 蒋平 张贵才
(中国石油大学(华东)石油工程学院,青岛 266580)
通过测定及分析纳米颗粒和表面活性剂-纳米颗粒复配体系在自由吸附过程与动态收缩过程中表面张力的变化,总结了纳米颗粒在气-液界面的吸附排布规律以及表面活性剂对其吸附规律的影响.实验结果表明,自由吸附过程中,随矿化度增加、阳离子活性剂浓度增加,平衡表面张力降低,这与颗粒吸附密度增加及颗粒润湿性改变有关.浓度低于临界胶束浓度(CMC)时,阳离子活性剂体系与混合体系的表面张力差异证明了阳离子活性剂可以通过静电作用吸附于纳米颗粒表面,进而部分溶解于水相;而阴离子活性剂与纳米颗粒相互作用力较弱,对表面张力影响较小.纳米颗粒体系在液滴收缩过程中,表面张力从自由吸附平衡态进一步降低大约9 mN/m,说明自由吸附过程中纳米颗粒不能达到紧密排布;同时表面张力呈现为缓慢降低、快速降低和达到平衡三部分,表面压缩模量可达70 mN/m,满足了液膜Gibbs稳定准则,这将有助于提高泡沫或者乳液稳定性.纳米颗粒-表面活性剂体系在液滴收缩过程中表面张力降低值随活性剂浓度增加而减小;表面压缩模量由高到低依次为:纳米颗粒>阳离子活性剂-纳米颗粒>阴离子-纳米颗粒>表面活性剂.
1 引 言
纳米颗粒在食品化学[1]、生物医学[2]、日化行业[3]、能源开发[4]等行业应用愈加广泛,尤其在石油开发中通过稳定泡沫或乳液[5,6]以达到调剖堵水、提高采收率效果.具有一定界面活性的纳米颗粒可以在气-液或油-水界面自发吸附,且不同于活性剂吸附的是纳米颗粒在界面的吸附基本属于不可逆吸附过程,这使其可以进一步提高泡沫或乳液稳定性.由于界面扩张模量提高、界面剪切模量提高、液膜间分离压增加[7]以及液相黏度增加等机理,纳米颗粒稳定的泡沫或乳液稳定性远高于表面活性剂的稳定效果.
Binks[8]提出了纳米颗粒在界面吸附能,ΔE=-πr2γ(1-|cosθ|)2,其中 θ为纳米颗粒在界面的三相接触角,γ为界面张力,r为纳米颗粒半径.Bizmark等[9]认为当吸附能高于20—50 kT时,可认为该吸附过程为不可逆吸附.界面吸附能为纳米颗粒自发吸附于界面提供了动力,但同时吸附过程也需要克服一定的吸附能垒,如:带负电的纳米二氧化硅颗粒吸附于气-液界面时,由于气-液界面同样带负电[10],所以需克服一定的静电斥力;当界面已存在纳米颗粒后,颗粒间的复杂相互作用力是制约其紧密排布的主要原因[11].Zang等[12]通过Langmuir槽压痕测试证实了表面张力变化与颗粒间距和颗粒疏水性有关,在62% SiOH时得到的表面张力差值最大.无机盐离子影响了纳米颗粒在界面吸附过程中的静电力,且二价离子的架桥作用也会影响纳米颗粒的吸附层,但目前该方面研究很少.Zhang等[13],Du等[14],Hua等[15]根据纳米颗粒吸附的界面收缩过程中界面张力的变化,对纳米颗粒在界面的吸附量进行了定量分析,从而详细描述了液膜变化过程中的颗粒在界面吸附状态变化;Rusell等[16]和Maestro等[17]将纳米颗粒在气-液/油-水界面的吸附过程按照由低密度到高密度分成三部分:类气体分布状态,此时纳米颗粒在界面自由排布,颗粒间相互作用力可以忽略;类液体分布状态,此时纳米颗粒间相互作用力逐渐体现;类固体分布状态,此时颗粒在界面紧密排布,排布密度达到最大,界面张力达到最低.Zang等[18]通过分析不同压缩过程中表面张力的变化以及表面剪切模量的变化,认为表面剪切模量略低于压缩模量,同时自由吸附界面与压缩界面中纳米颗粒排布结构差别导致了其表面性质的差异.界面剪切储能模量高于损耗模量时,界面刚性增强,呈现类固态,此时界面层吸附的纳米颗粒可能出现弱交联状[19,20],有研究证明这种状态下,泡沫通过降低排液速率、减缓泡沫聚并等机理而增强了泡沫稳定性[21,22].
目前对表面活性剂改性纳米颗粒的研究较多,但由于活性剂通过物理静电吸附作用吸附于纳米颗粒表面的过程,受温度和盐含量制约,从而不能在苛刻条件下得以推广应用,而通过硅烷化学改性的纳米二氧化硅溶液可以在高温、高盐环境下稳定.本文以γ-缩水甘油醚氧丙基三甲氧基硅烷(GL)改性的纳米二氧化硅为例,通过二甲基二甲氧基硅烷(DM)调整亲/疏水性,以液滴外形分析方法测定了气-液平衡表面张力,并计算了液滴收缩过程中的表面压缩模量,讨论了表面活性剂存在与否对纳米颗粒在气-液界面吸附排布规律的影响.
2 实验部分
实验所用纳米二氧化硅溶胶(20 wt.%,500 m2/g,10 nm)购于Nyacol Nano Technologies公司;γ-缩水甘油醚氧丙基三甲氧基硅烷(GL)、二甲基二甲氧基硅烷(DM)、十四烷基三甲基溴化铵(TTAB)、α-烯烃磺酸盐(AOS)及无机盐购买自Sigma-Aldrich公司.所有溶液pH均以盐酸或氢氧化钠溶液调整至6.5.前期研究结果表明[23],GL改性的纳米二氧化硅可以增强其耐温耐盐性,但仍是强亲水颗粒,在此基础上通过添加DM以调整颗粒亲/疏水性,GL覆盖率(假定改性合成产率为100%)固定为2 μmol/m2,DM覆盖率分别为0.8,1.2,1.5 μmol/m2.各溶液以三种盐水配制:1)超纯水,2) 2.5 M NaCl盐水 (1 M=1 mol/L),3) 2 M NaCl+0.25 M CaCl2盐水,2)与3)离子强度相当.
通过滴外形分析仪 (OneAttension,瑞典)采集常温常压下溶液液滴悬挂时的形状参数,由(1)式计算得到了不同时刻的表面张力.通过自动单液分配器(OneAttention,C201,瑞典)控制液滴的扩张与收缩,待液滴初始体积达到28 μL后,以0.1 μL/s速率将液滴收缩,并同时以10帧/s速率采集图像、分析表面张力随液滴体积/表面积的变化,直至表面张力不再变化结束实验.
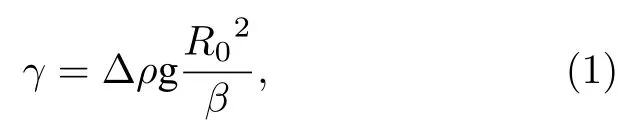
其中γ为表面张力值,Δρ为气-液两相密度差,g为重力加速度,R0为液滴顶端的曲率半径,β为形状因子.
3 实验结果与讨论
3.1 表面张力测定及影响因素分析
3.1.1 不同疏水性纳米颗粒溶液
未改性的纳米二氧化硅颗粒由于其强亲水性,不能自发吸附于气-液界面,因此不能稳定泡沫或者乳液[24],同时溶液稳定性主要依靠颗粒间的静电斥力,当盐含量增加时,二氧化硅颗粒发生团聚.当GL枝接于纳米颗粒表面后,由烷基醇基团替代了硅羟基,大大提高了颗粒间的空间斥力,根据DLVO理论,GL改性的纳米二氧化硅溶液可以在高温、高盐水中仍然稳定[23].
表面活性剂吸附于界面时,通常为扩散控制可逆吸附过程,常用Frumkin吸附公式进行描述,而对于纳米颗粒作为活性物质吸附于界面时,Du等[14]认为由于颗粒相对于活性剂分子大的多,因此还需要考虑固体颗粒取代原有气-液界面后,新产生的固-液以及固-气界面的性质,从而分析了由于纳米颗粒润湿性引起的界面张力改变:γ=γ0-|ΔE|Γ,其中|ΔE|为纳米颗粒在界面的吸附能,Γ为纳米颗粒吸附于界面的覆盖率或单位面积的纳米颗粒吸附量,而 Δ E=-πr2γ(1-|cosθ|)2,因此当纳米颗粒润湿角逐渐增加趋近于90°时,纳米颗粒界面活性增强,表面压更大.图1表明随溶液盐含量升高,表面张力平衡值由70.5降至59.5 mN/m,这主要是因为纳米颗粒在气-液界面吸附量增加导致,改性纳米颗粒表面仍带有一定负电性,其Zeta电位为—10——5 mV,随着盐含量增加,在气-液界面层中颗粒间的静电斥力以及颗粒与气-液界面的负电性斥力均降低,从而纳米颗粒在界面吸附密度增加;此外有研究表明,盐含量增加也使得颗粒接触角增加[25],更趋近于90°,因此随溶液盐含量增加,表面张力降低明显.且在相同离子浓度下,添加钙离子后,平衡表面张力略有降低但相差不大,这说明高盐条件下单价/二价离子的静电屏蔽作用效果相近.图2表明当纳米颗粒表面疏水基团覆盖率由0.8增加至1.5 μmol/m2,平衡表面张力由66.8降低至58.7 mN/m,当DM覆盖率增加后,纳米颗粒表面的甲基基团比例增加,即纳米颗粒疏水性增强,从而降低表面张力能力增加;此外,随DM覆盖率的增加,纳米颗粒表面呈负电的硅羟基被不带电荷的DM覆盖,颗粒间的静电斥力大大降低,从而纳米颗粒在界面的吸附密度增大,因此随着纳米颗粒由亲水变为部分疏水时,表面张力随DM覆盖率增加而降低.这与Zang等[12,18]的研究结果一致,纳米颗粒的疏水程度及其在界面的吸附量对表面张力降低具有决定作用.

图1 1.5 μmol/m2 DM 纳米颗粒(1.0 wt.%)在不同浓度盐水中的动态表面张力Fig.1.Salinity effects on the dynamic and steady state IFT when the DM coverage is 1.5 μmol/m2 with the NPs concentration is 1.0 wt.%.
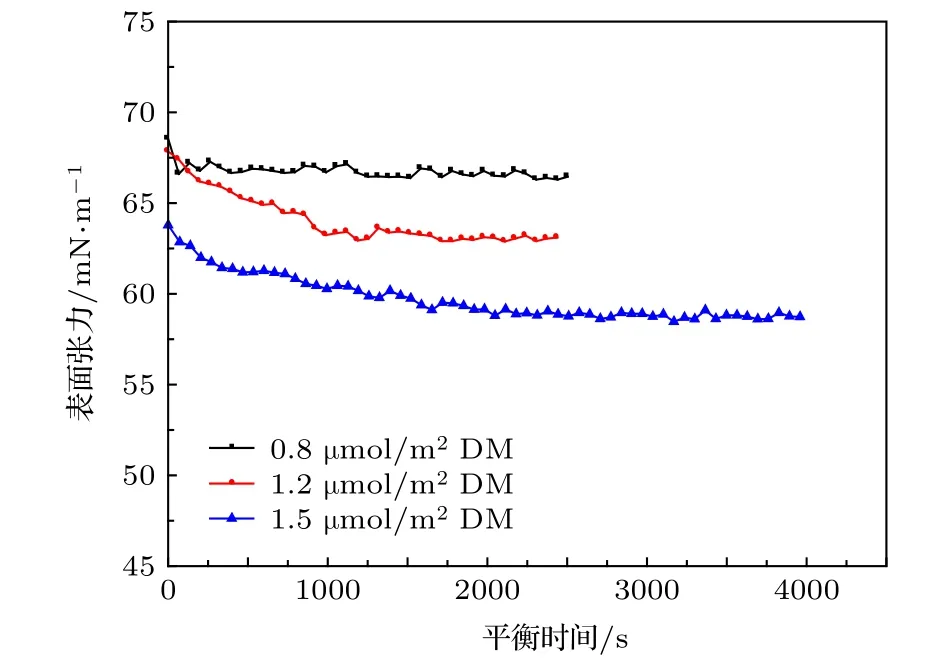
图2 不同改性纳米颗粒 (1.0 wt.%) 在2 M NaCl+0.25 M CaCl2盐水中的动态表面张力Fig.2.Effects of the DM coverage on the dynamic and steady state IFT with 1.0 wt.% concentration in the brine of 2 M NaCl+0.25 M CaCl2.
3.1.2 表面活性剂-纳米颗粒溶液
改性纳米颗粒表面仍带有不同程度的负电,由于不同类型表面活性剂带电性差异导致活性剂与纳米颗粒间的静电作用力不同.图3可以看出阳离子活性剂TTAB浓度低于0.006 mmol/L、阴离子活性剂浓度低于0.004 mmol/L时,混合体系的表面张力与单独改性纳米颗粒溶液相近,约为59 mN/m,这说明此时表面张力主要由改性纳米颗粒所决定,表面活性剂由于浓度过低而对纳米颗粒溶液表面张力几乎无影响.随活性剂浓度增加,阳离子活性剂-纳米颗粒体系表面张力高于同浓度活性剂溶液表面张力,但低于单独改性纳米颗粒溶液的表面张力,这是由于静电吸引力作用,部分活性剂吸附于纳米颗粒表面,继而溶解于体相,导致气-液表面吸附的活性剂浓度降低,同时部分纳米颗粒吸附有TTAB后,疏水性进一步增强,降低界面张力能力增加,并且气-液表面有部分自由活性剂存在,因此复配体系表面张力有所降低;而阴离子活性剂-纳米颗粒体系表面张力与单独活性剂溶液相近,这说明阴离子活性剂与纳米颗粒相互作用力较小,基本可以忽略,在低活性剂浓度下,表面张力等同于改性纳米颗粒溶液表面张力值,较高浓度时,表面活性剂吸附密度增加,表面张力近似于活性剂溶液表面张力值.
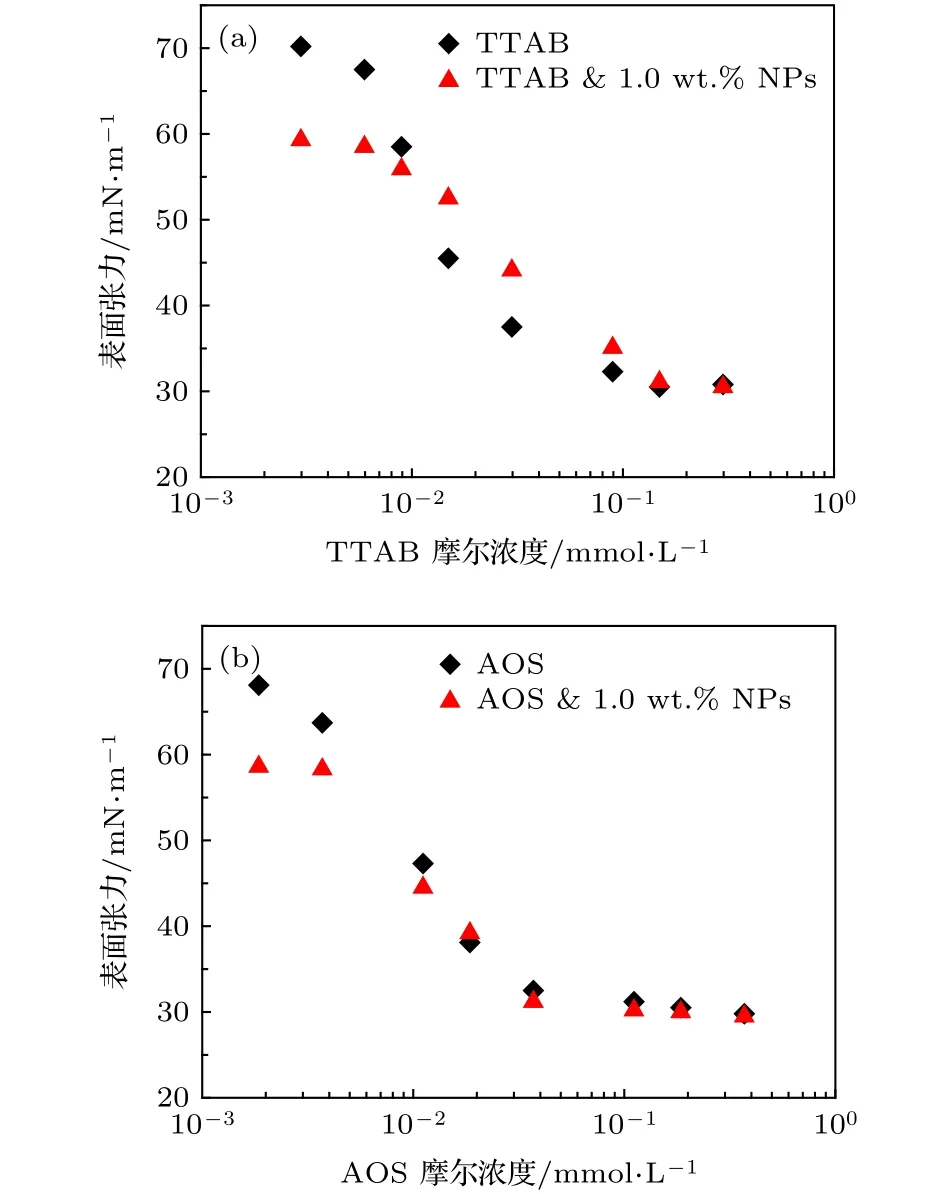
图3 阴、阳离子活性剂与改性纳米颗粒复配体系表面张力 (a) 1.5 μmol/m2 DM纳米颗粒溶液中加入不同浓度TTAB;(b) 1.5 μmol/m2 DM纳米颗粒中加入不同浓度AOSFig.3.The IFT of mixing solution of different surfactant with 1.0 wt.% NPs:(a) 1.5 μmol/m2 DM NPs solutions with different concentrations of TTAB;(b) 1.5 μmol/m2 DM NPs solutions with different concentrations of AOS.
3.2 液滴收缩过程中气-液表面压缩模量变化规律
3.2.1 不同疏水性纳米颗粒溶液
为进一步确定液膜收缩对纳米颗粒在气-液界面吸附规律的影响,对液滴持续收缩过程中表面张力的变化进行了采集分析,这也可以更直观解释泡沫稳定过程中界面膜性质的变化规律.不同于表面活性剂的吸附,由于纳米颗粒在界面的吸附/脱附能一般可达几百甚至几千kT[19],因此纳米颗粒的吸附过程绝大多数属于不可逆吸附.在液滴收缩过程中,纳米颗粒吸附总量不变,但随着气-液界面表面积的降低,纳米颗粒吸附密度增加,因此导致表面张力可以进一步降低.Rusell等[16]和Maestro等[17]发现在纳米颗粒吸附密度增加过程中,根据表面张力的变化可分为明显三段,首先是颗粒间相互作用可以忽略阶段(类气体分布状态),其次是颗粒间相互作用增强阶段(类液体分布状态),最后是颗粒在界面密堆积阶段(类固体分布状态).由表面压缩模量定义公式 εc=dγ/(dA/A),可知当表面积变化量很小或者表面张力随表面积变化率呈线性关系时,可由 γ-γ0≈ εc(1-A0/A) 进行近似计算表面压缩模量εc,其中A0为某时刻液滴表面积,γ0为液滴表面积为A0时的表面张力,因此可以通过表面张力和表面积的变化曲线定量分析界面压缩模量在液滴收缩过程中的变化[17].
图4为 1.0 wt.%质量浓度的 1.5 μmol/m2DM纳米颗粒溶液在表面张力达到平衡后收缩以及液滴生成后立即收缩两种方式下表面张力与表面积变化率的相关性曲线,但根据图4(a)结果发现,两种方式曲线并不重合,这主要是由于平衡前后纳米颗粒在液滴表面吸附总量不同,因此以纳米颗粒最紧密排布时的表面积Aw对面积变化率进行归一化,得到图4(b)所示曲线,在Aw/A>1时,表面张力不再降低,即表面压缩模量几乎为0.通过未平衡液滴收缩过程可以看出,在初始阶段(0.80<Aw/A<0.84),表面张力变化率较低,这对应于纳米颗粒在液滴表面类气体分布状态,颗粒之间几乎无相互作用力,因此压缩模量较小;在中间阶段(0.85<Aw/A<1.00),表面张力变化率明显增大且基本呈线性降低,初始及结束均具有较明显的转折点,这对应于纳米颗粒吸附密度增加导致相邻颗粒间相互作用力增加,导致纳米颗粒压缩过程中在界面上出现了不可逆聚集和组织[26],从而表面张力降低更明显,表面压缩模量较高;在最后阶段(Aw/A>1),表面张力变化率几乎为0,此时可以认为纳米颗粒在表面排布达到密堆积,排布密度可近似认为0.91(二维最密堆积密度),因此表面积继续降低后,颗粒吸附密度不再增加,纳米颗粒被挤出表面层,再次溶于水相.平衡前后的收缩过程曲线重合证明吸附时间或吸附速率对纳米颗粒在界面的排布规律影响不大,在持续收缩后均能达到密堆积.

图4 液滴平衡前后收缩过程表面张力变化曲线(2 M NaCl+0.25 M CaCl2,溶液质量密度为1.0 wt.%)Fig.4.IFT in the shrinking process versus the surface area change (in the 2 M NaCl+0.25 M CaCl2 brine with 1.0 wt.%concentration).
由于平衡前的液滴收缩过程可以更全面反应纳米颗粒的排布变化,同时也更接近于泡沫迅速生成稳定的过程,因此图5为液滴平衡前不同体系液滴收缩时表面张力随表面积的变化规律.图5(a)中0.8 μmol/m2DM纳米颗粒溶液的表面张力在A0/A=1.27时达到平衡,低于疏水性更强的纳米颗粒体系,说明即使弱疏水性纳米颗粒的初始吸附量较低,其在液滴变形量相对较小时即可达到最紧密排布,这可能是由于0.8 μmol/m2DM纳米颗粒分子间斥力较大,在最紧密排布时的排布密度低于0.91;图5(b)可以看出当纳米颗粒在液滴表面达到最紧密排布(Aw/A=1.0)时,颗粒疏水性越强则表面张力越低,这使得体系更易于满足Gibbs准则 (ε>0.5γ),由曲线斜率可计算表面压缩模量,如表1、表2所列,在表面张力降低超过第一转折点后,表面压缩模量明显增加,最高可达70 mN/m,远远满足于Gibbs准则,从而为泡沫稳定提供了可能性;且随着纳米颗粒疏水性增加,表面压缩模量也升高,这与Zang等[12,18]通过压缩变形-自由恢复过程研究得出的表面模量变化规律一致,证明表面刚性也增强,界面剪切储能模量高于了损耗模量.图5(c)和图5(d)证明了纳米颗粒在超纯水-空气界面的吸附量可以忽略,在有限收缩过程中,吸附密度并无有效增加;相近离子浓度溶液中,Ca2+使纳米颗粒达到最紧密排布所需表面积压缩值(A0/A)更大且转折点处表面张力更低,这可能与二价离子的架桥作用有关[27],从而减小了紧密排布时纳米颗粒间距离,增加了颗粒吸附/脱附能垒,从而随界面压缩纳米颗粒排布密度可以进一步增加,表现为表面张力值更低.
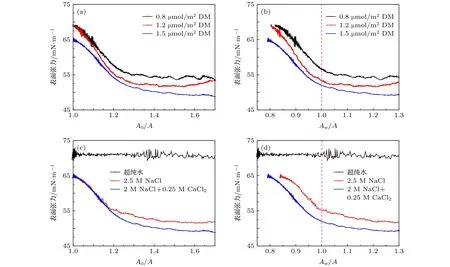
图5 不同体系液滴收缩过程中表面张力的变化,溶液质量密度为1 wt.% (a),(b) 不同疏水性纳米颗粒溶液,盐含量2 M NaCl+0.25 M CaCl2;(c),(d) 不同盐浓度溶液,1.5 μmol/m2 DM纳米颗粒Fig.5.IFT at different Aw/A ratios during droplet shrinking for (a) and (b) NPs with difference DM coverage at the fixed concentration of 1 wt.% in 2 M NaCl+0.25 M CaCl2 brine;for (c) and (d) 1 wt.% 1.5 μmol/m2 DM NPs solutions with various salinities.
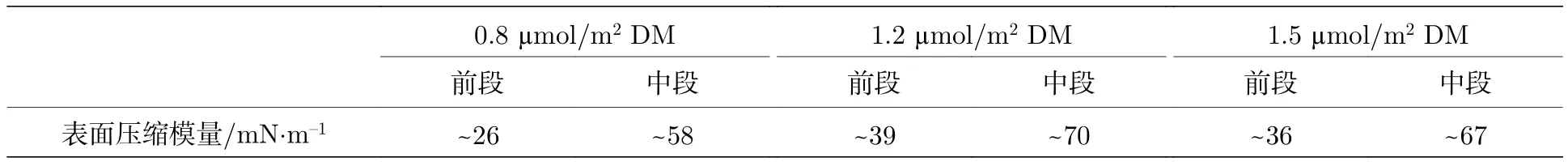
表1 液滴持续收缩过程中不同改性纳米颗粒溶液体系的平均表面压缩模量Table 1.The compression modulus of various hydrophobic NPs solutions in 2 M NaCl+0.25 M CaCl2 brine with continuous shrinking droplet.

表2 液滴持续收缩过程中改性纳米颗粒溶液在不同盐含量条件下的表面压缩模量Table 2.The compression modulus of 1.5 μmol/m2 DM NPs solutions in various salinity brine with continuous shrinking droplet.
3.2.2 表面活性剂-纳米颗粒溶液
表面活性剂对纳米颗粒在气-液界面的吸附有重要影响,通过体系中加入阳离子活性剂TTAB和阴离子活性剂AOS研究了活性剂对1.5 μmol/m2DM纳米颗粒在超纯水-空气界面吸附的影响规律.图6实验结果表明在TTAB浓度较低时,液滴收缩过程中存在较明显的表面张力转折点,而在高浓度时,即体系初始表面张力低于纳米溶液转折点表面张力值时,液滴收缩过程中表面张力缓慢降低无明显转折点.TTAB活性剂带有正电荷而纳米颗粒带弱负电,因此静电引力可以使TTAB吸附于纳米颗粒表面,同时当TTAB吸附于液滴表面后,纳米颗粒吸附于界面阻力降低,因此在低浓度活性剂体系中,液滴收缩过程中,吸附于液滴表面的纳米颗粒排布密度增加导致出现转折点,Meastro等[17]研究认为收缩过程中活性剂浓度仅对初始表面张力有影响,而对表面张力曲线变化无关,表面张力曲线变化规律只与纳米颗粒在气-液界面的吸附密度有关,但图6(a)中表面张力变化曲线并不能完全重合,可能是由于本文中活性剂吸附于纳米颗粒表面后,进一步增强了纳米颗粒的疏水性,从而使转折点处表面张力值略有降低.而在高活性剂浓度区域,存在两种可能性:一是由于纳米颗粒降低表面张力能力弱于活性剂并且吸附速率较慢,依据界面最低能量排布规律纳米颗粒可能难以吸附于界面,此时体系表面张力的变化近似于单独表面活性剂溶液;二是即使纳米颗粒吸附于气-液界面,但由于其降低表面张力能力低于表面活性剂,因此在表面张力变化曲线中并不能反映出来,该分析方法不再适用.阴离子活性剂AOS和阳离子活性剂TTAB对体系对表面张力变化曲线的影响如图6(b),结果表明相对于TTAB-纳米颗粒体系,AOS-纳米颗粒体系的表面张力变化曲线转折点更不明显,这可能是由于初始阶段带相同负电荷的AOS抑制了纳米颗粒在气-液界面的吸附,液滴表面的较低纳米颗粒吸附量导致曲线类似于单独表面活性剂溶液的液滴收缩过程.
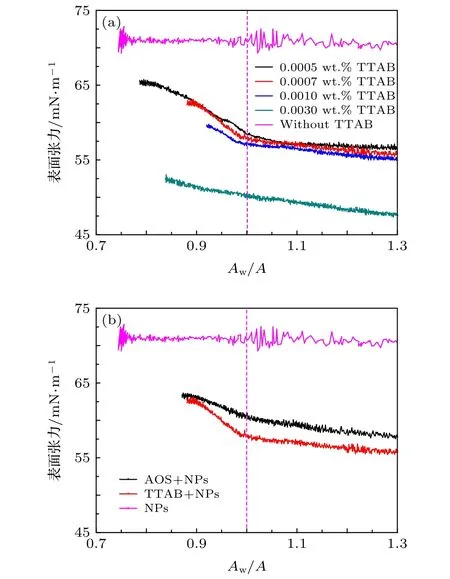
图6 质量浓度为1.0 wt.%的不同纳米颗粒-活性剂体系液滴收缩过程中表面张力的变化 (a) 1.5 μmol/m2 DM纳米颗粒中加入不同浓度TTAB;(b) 1.5 μmol/m2 DM纳米颗粒中加入TTAB或AOS,表面张力初始值相近Fig.6.IFT at different Aw/A ratios during droplet shrinking in DI water with 1.0 wt.% NPs:(a) 1.5 μmol/m2 DM NPs solutions with different TTAB concentrations;(b) 1.5 μmol/m2 DM NPs solutions with TTAB and AOS with same beginning IFT.
4 结 论
通过滴外形分析方法得到了在不同时刻、不同状态下的表面张力及表面压缩模量,以此分析了纳米颗粒在气-液界面的排布规律及影响因素,主要得到以下结论.
1) 随着溶液盐含量增加、纳米颗粒的疏水性增强,体系的平衡表面张力降低、表面扩张模量增加.这主要是纳米颗粒在界面吸附密度及颗粒界面活性共同作用的结果,溶液高盐含量降低了纳米颗粒间、颗粒与表面间的静电斥力从而大幅增加了纳米颗粒吸附密度,纳米颗粒高疏水性增加了颗粒间相互作用力及脱附能,使得界面膜强度增加.
2) 滴液在大幅收缩过程中,表面张力变化分为三部分:缓慢降低区域、迅速降低区域以及稳定区域,表面张力变化反映了纳米颗粒在气-液界面排布密度变化过程[16],即“类气态自由排布”、“类液态均匀排布”和“类固态紧密排布”.随液滴的收缩,表面压缩模量明显增加,最高达70 mN/m左右,明显满足 Gibbs准则 (ε>0.5γ),为提高泡沫稳定性提供了可能性.
3) 表面活性剂影响了纳米颗粒在气-液界面的吸附.阳离子活性剂与改性纳米颗粒之间存在吸引力,表面张力变化较大;而阴离子活性剂与改性纳米颗粒间相互作用力较弱,对表面张力影响较小.同时,在低活性剂浓度时,纳米颗粒-阳离子活性剂体系由于静电吸附作用增加了气-液界面模量,高浓度活性剂体系中,表面性质由活性剂主导,表面模量大大降低.
