经尿道钬激光切除术对非肌层浸润性膀胱癌患者氧化应激因子和肿瘤相关因子的影响
2020-02-18马进华魏红兵李先林陈德红
马进华, 魏红兵, 李先林, 潘 峰, 陈德红
(1湖北省第三人民医院/湖北省中山医院泌尿外科, 武汉 430030; 2华中科技大学同济医学院附属协和医院泌尿外科, 武汉 430022;3湖北文理学院附属医院/襄阳市中心医院泌尿外科, 湖北 襄阳 441021)
膀胱癌为恶性肿瘤的重要类型,具有易浸润、易转移及易复发等特征[1]。按膀胱癌浸润程度分为非肌层浸润性膀胱癌(NMIBC)与肌层浸润性膀胱癌(MIBC),其中,非肌层浸润性膀胱癌(NMIBC)约占膀胱癌的70%[2]。经尿道膀胱肿瘤电切术(TURBT)为临床治疗NMIBC的重要术式,尽管该术式可有效切除病灶,但对于较大的病灶常易因切割过度,导致闭孔神经反射,严重者甚至导致膀胱穿孔,增加手术风险[3]。已有研究证明,经尿道钬激光切除术(HOLRBT)可在切除病灶的同时避免发生闭孔神经反射(ONR)及膀胱穿孔,已逐渐应用于NMIBC的临床治疗[4]。湖北省第三人民医院于2014年1月-2017年12月将HOLRBT应用于NMIBC的临床治疗,以评价其疗效,并探究其对氧化应激因子、肿瘤相关因子水平的影响。现对本次研究进行回顾性分析。
1 资料与方法
1.1 一般资料纳入2014年1月-2017年12月于湖北省第三人民医院接受治疗的NMIBC患者136例,男性96例(70.59%),女性40例(29.41%);年龄48~76岁,平均(57.83±6.52)岁;体质指数17.39~24.52 kg/m2,平均(20.85±2.07)kg/m2;病灶直径5~28 mm,平均(17.63±1.82) mm;病灶位置:膀胱侧壁90例(66.18%),后壁26例(19.12%),顶部17例(12.50%),三角区11例(8.09%);病灶数目:单发85例(62.50%),多发51例(37.50%);TNM分期:Ta期91例(66.91%),T1期45例(33.09%);分级:G1级88例(64.71%),G2级48例(35.29%)。纳入标准:经术后病理确诊为NMIBC患者;原发病灶患者;预期生存180 d以上患者;手术可耐受患者;知情同意患者。排除标准:MIBC患者;复发膀胱癌患者;远处转移患者;合并其他恶性肿瘤患者;手术禁忌证患者;肝肾功能异常患者;依从性差患者。依据手术方法将136例NMIBC患者分为试验组与对照组,各68例。两组一般资料差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 试验组 试验组行HOLRBT治疗。患者全麻,取截石位,经尿道将观察镜置入,经操作腔将狄激光光纤置入,进入膀胱,以生理盐水连续灌注,激光频率:20~30 Hz,功率30~40 W,输出能量1.5~2.0 J。彻底暴露病灶基底部,沿其基底部于病灶周围1 cm左右完整切除病灶,切除深及肌层,止血后将病灶以ELLIK吸出,若病灶基底较宽或体积较大,则先对阻碍暴露病灶基底部的瘤体,切除瘤体后,再将病灶基底部及附近约2 cm为正常黏膜以狄激光汽化、切割。术后行化疗药物膀胱灌注,并根据危险程度进行定期膀胱镜检,若肿瘤复发,则行二次治疗。
1.2.2 对照组 对照组行TURBT治疗。患者全麻,取截石位。彻底暴露病灶基底部,以电切镜由浅入深依次蝶形切割,切割深度至清晰显露的基层纤维组织,然后对病灶基底部周围2 cm范围内黏膜电凝烧灼,止血后完成手术。术后行化疗、镜检及复发处理同试验组。
1.2.3 观察指标 观察两组手术时间、尿管留置时间、术毕膀胱冲洗时间、住院时间等手术相关指标;术前及术后7 d血清谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)等氧化应激因子水平;血清胰岛素样生长因子结合蛋白-3(IGFBP-3)、胰岛素样生长因子-I(IGF-I)、血管内皮生长因子(VEGF)等肿瘤相关因子水平;手术并发症;术后1年复发情况。以ELISA法检测GSH-Px、SOD;以比色法检测MDA;以化学发光法检测IGFBP-3、IGF-I;以酶联免疫吸附法检测VEGF。
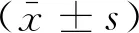
2 结果
2.1 两组手术相关指标比较试验组手术时间、尿管留置时间、术毕膀胱冲洗时间、住院时间等指标均少于对照组(P<0.05),见表1。
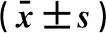
表1 两组手术相关指标比较
2.2 两组氧化应激因子比较术前,两组血清GSH-Px、SOD、MDA水平差异均无统计学意义(P>0.05);术后7 d,两组血清GSH-Px、SOD水平均降低,血清MDA水平升高,试验组血清GSH-Px、SOD水平均高于对照组,血清MDA水平低于对照组(P均<0.05),见表2。
2.3 两组血清肿瘤相关因子水平术前,两组血清IGFBP-3、IGF-I、VEGF水平差异均无统计学意义(P>0.05);术后7 d,两组血清IGFBP-3水平均升高,血清IGF-I、VEGF水平均升高,试验组血清IGFBP-3水平均高于对照组,血清IGF-I、VEGF水平低于对照组(P均<0.05),见表3。
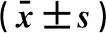
表2 两组氧化应激因子比较
注:与术前比较,*P<0.05; 与对照组比较,△P<0.05。
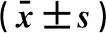
表3 两组血清肿瘤相关因子水平
注:与术前比较,*P<0.05; 与对照组比较,△P<0.05。
2.4 两组手术并发症、术后复发情况比较试验组手术并发症发生率低于对照组(P<0.05);两组术后1年复发率差异无统计学意义(P>0.05),见表4。
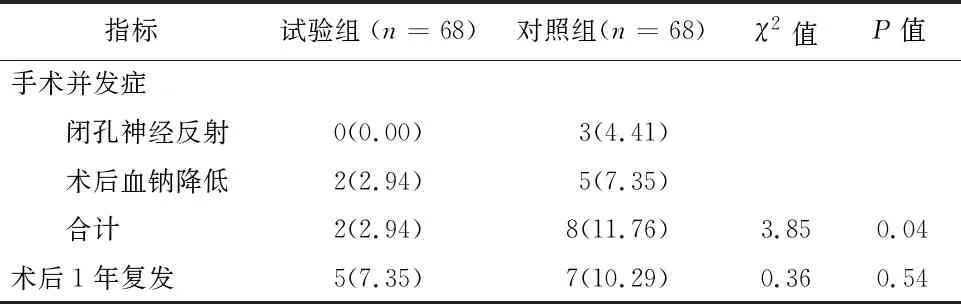
表4 两组手术并发症、术后复发情况比较/例(%)
3 讨论
TURBT是NMIBC治疗的金标准[5]。TURBT可经与机体产生电流回路进而引发汽化效应完成病灶切割。因闭孔神经位于膀胱侧壁外,故TURBT术中常可因电流刺激导致ONR,甚至导致膀胱穿孔等并发症[6]。与TURBT相比较,HOLRBT具有下述优势:(1)HOLRBT产生的激光能量背水吸收后,可于局部瞬间爆破并产生汽化效应切割病灶并止血,因其术中无电流产生,故不会引发ONR,且不易导致膀胱穿孔等并发症[7];(2)HOLRBT为非接触切割,术中不会因挤压肿瘤导致肿瘤细胞进入静脉而扩散,且可汽化卫星灶[8];(3)HOLRBT切割深度较小,解剖层次极为精确,可完整切除病灶[9];(4)HOLRBT视野清晰,术中不需持续清洗,可有效减少出血,避免低钠血症发生;(5)HOLRBT可汽化阻断病灶周围血管、淋巴管,避免肿瘤细胞扩散及术后复发[10];(6)HOLRBT创伤小,恢复快,且可有效避免术后瘢痕形成;(7)激光光纤柔软、纤细,便于术中操作,可有效减少治疗时间[11]。本研究显示,试验组手术并发症发生率低于对照组,提示HOLRBT较TURBT治疗NMIBC具有更好的治疗效果。
手术可导致机体产生强烈的氧化应激反应,刺激HPA轴及神经-内分泌系统,促进分泌应激因子,抑制机体免疫,诱发炎性反应[12]。GSH-Px、SOD均为抗氧化物酶[13]。GSH-Px能竞争性催化H2O2,清除有机氢过氧化物、自由基及其衍生物,避免机体过氧化损伤。GSH-Px可促进分泌血栓素及前列腺素,维护细胞结构与功能[14]。SOD可有效清除氧自由基,抑制、阻断自由基导致的细胞损伤,修复损伤细胞,恢复自由基导致的细胞伤害[15]。MDA为脂质过氧化产物,可导致细胞质膜损伤,改变细胞膜结构。MDA可干预线粒体内重要酶及呼吸链复合物活性,抑制线粒体功能,影响细胞功能或促进细胞凋亡[16]。在本研究中,术后7 d,试验组血清GSH-Px、SOD水平均高于对照组,血清MDA水平低于对照组,提示与TURBT治疗NMIBC相比较,HOLRBT创伤小,可有效缓解机体应激反应,避免过度刺激HPA轴及神经-内分泌系统,调节氧化应激因子,减少机体伤害。
IGFBP-3、IGF-I、VEGF为肿瘤相关因子,其血清水平改变与机体肿瘤的发生、进展密切相关,在膀胱癌治疗疗效评价中也具有积极意义。IGF-I为IGFs家族中的重要成员,在肿瘤发生、发展进程中具有重要作用[17]。IGF-I可通过结合其受体激活PI3K及MAPK信号传导通道促进肿瘤细胞的生长、增殖及凋亡[18]。已有研究证明,在肿瘤细胞中IGF-I表达上调可促进肿瘤的快速发展,IGF-I过表达是导致肿瘤发生的重要因素[19]。IGFBP-3可竞争性结合IGF-I,阻断其通过结合其受体激活PI3K及MAPK信号传导通道,发挥抑制肿瘤生长的作用[20]。除通过IGF-I间接抑制肿瘤外,IGFBP-3还可直接抑制肿瘤生长。VEGF为功能性糖蛋白,可特异性作用于血管内皮细胞,加快其有丝分裂进程,促进血管形成,并增加毛细血管的通透性。VEGF可促进肿瘤新生血管形成,并促进其异常生长,抑制抗肿瘤药物进入肿瘤细胞,从而避免肿瘤细胞凋亡。本研究显示,术后7 d,试验组血清IGFBP-3水平均高于对照组,血清IGF-I、VEGF水平低于对照组,提示HOLRBT可有效切除病灶,抑制IGFBP-3、IGF-I、VEGF分泌,避免肿瘤复发及转移。
总之,与TURBT治疗NMIBC相比较,HOLRBT可有效切除病灶,且创伤小,可缓解手术导致的机体氧化应激,促进分泌抑癌因子,抑制致癌因子生成,有助于NMIBC患者转归。
