耻垢分枝杆菌新型毒素-抗毒素系统MSMEG_3435-3436基因功能的初步研究
2020-02-17张蓝月耿艺漫贾红彦肖婧李自慧潘丽萍孙义成张宗德
张蓝月 耿艺漫 贾红彦 肖婧 李自慧 潘丽萍 孙义成 张宗德
毒素-抗毒素(toxin-antitoxin,TA)系统是广泛存在于细菌和古细菌等原核生物基因组中的一类小型功能性基因元件,在细菌持留性[1-2]、调节生物膜动力学和适应环境刺激[3-5]等多个方面发挥着重要作用。典型的毒素-抗毒素系统由不稳定的抗毒素和稳定的毒素组成,活性状态下的毒素可抑制细菌生长或介导细菌程序性死亡,从而杀灭细菌,而抗毒素则抑制该过程从而达到动态平衡。
分枝杆菌属中毒素-抗毒素系统的种类和数量存在很大差异。如结核分枝杆菌包含至少93个毒素-抗毒素系统[6];麻风分枝杆菌仅含有毒素假基因;而被用于研究结核分枝杆菌未知基因功能模式菌株的无致病性且代时短的耻垢分枝杆菌中[7],目前仅验证了4个有功能的毒素-抗毒素系统[分别为MSMEG_1277-1278(Phd/Doc)、MSMEG_4447-4448(MazEF)、MSMEG_1283-1284(vapBC)和MSMEG_5635-5634][8-10],1个不包括毒素的抗毒素-伴侣蛋白(antitoxin-chaperone, AC)和2个预测的未验证过功能的毒素-抗毒素系统(MSMEG_3435-3436、MSMEG_6762-6760)[3, 6]。因此,为了解毒素-抗毒素系统与分枝杆菌耐受和持留的关系[11],本研究通过构建耻垢分枝杆菌2个预测毒素-抗毒素系统过表达体系及敲除菌株探究其功能,为进一步研究结核分枝杆菌毒素-抗毒素系统的功能提供分子工具和线索。
材料和方法
一、材料来源
用于本研究的菌株和质粒见表1,引物见表2。
二、主要试剂和仪器
溶菌肉汤(lysogeny broth,LB)培养基,米氏肉汤分枝杆菌培养基(Middlebrook 7H9液体培养基)或7H10固体培养基(美国BD公司);BamHⅠ、HindⅢ等限制性内切酶及T4连接酶(美国NEB公司);PCR产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒(德国Qiagen公司);电穿孔仪(美国Bio-Rad 公司);crRNA由北京睿博兴科生物技术有限公司合成。抗生素及其相应终浓度:卡那霉素(Km)25 μg/ml;潮霉素(Hyg) 50 μg/ml;脱水四环素盐酸盐(ATc) 100 ng/ml;5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal) 20 mg/ml。

表1 用于本研究的菌株和质粒的特点与来源

表2 用于本研究的引物及其序列

续表2
三、研究方法
1.毒素-抗毒素系统基因的克隆表达及功能检测:分别将毒素基因MSMEG_3436、MSMEG_6760和毒素-抗毒素基因对MSMEG_3435-3436、MSMEG_6762-6760进行PCR扩增,再将PCR片段克隆入由诱导剂(ATc)诱导的pYC601载体启动子下游,经测序验证共构建5个克隆(即pYC601-con、pYC601-Ms_3436、pYC601-Ms_6760、pYC601-Ms_3435-3436、pYC601-Ms_6762-6760)。将5个克隆分别电转至耻垢分枝杆菌中,以pYC601-con空载体为对照,通过在7H9液体培养基中添加ATc以诱导基因表达并检测其功能。具体操作为:挑取单克隆摇至细菌的生长状态稳定期,再经1∶100转接2次使菌株状态一致。将溶液在600 nm波长处的吸光度值(A600)≈1.0的菌液分别转接到100 ml含ATc (100 ng/ml)和不含ATc的7H9液体培养基培养中,使初始A600≈0.02,然后在36 h内每间隔4 h测1次A600值,再以吸光度值为纵坐标、时间为横坐标绘制生长曲线。为使实验达到较好的平行性,该实验独立重复3次,取其中1次的数据做图。
2.敲除菌株生存能力鉴定及抗生素胁迫:应用CRISPR-Cas12a基因编辑技术构建敲除菌株[15]。根据靶标基因(MSMEG_3435-3436、MSMEG_6762-6760)设计靶标序列crRNA并连接到pCR-Hyg质粒载体上。以耻垢分枝杆菌野生型MC2155基因组DNA为模板,PCR扩增上下游同源臂,应用吉尔伯森克隆技术(Gibson Assembly法)连接到pUC19-Amp质粒载体上,并以此为模板将PCR扩增出来的上下游同源臂(≈1 kb)作为双链DNA模板。将crRNA(100 ng)和同源臂片段(700 ng)同时电转至SY3807感受态细胞中,30 ℃倒置培养3~4 d 后挑取单克隆测序验证。验证成功的突变菌株接种至7H9液体培养基中,1∶100转接2次后采用紫外分光光度计测A600,绘制野生株、各个突变菌株(ΔMSMEG_3435-3436、ΔMSMEG_6762-6760)的生长曲线。将异烟肼和利福平分别加到20 ml野生株和ΔMSMEG_3435-3436突变株的指数中期(A600≈0.3)培养液中,使终浓度分别为96 μg/ml和40 μg/ml。分别在加药后即刻及加药后24 h取样,将每个样品用不含抗生素的7H9洗两遍后,再用7H9液体培养基进行10倍梯度稀释至106倍,37 ℃倒置培养60 h后观察菌株的生长状况(菌落形成单位,CFU)并计算存活率[存活率(%)=处理24 h的CFU/处理前的CFU×100%]。再以存活率为纵坐标,抗生素名称为横坐标,绘制柱状图。为使实验达到较好的平行性,该实验独立重复3次,取其中1次的数据做图。
3.LacZ报告基因的整合及启动子活性检测:根据文献[8-10]及本课题前期实验研究发现的耻垢分枝杆菌中1对新的有功能的毒素-抗毒素系统,共计选择5对有功能的毒素-抗毒素系统(MSMEG_1277-1278、MSMEG_1283-1284、MSMEG_3435-3436、MSMEG_4447-4448、MSMEG_5635-5634)来验证毒素-抗毒素系统的自调控功能。PCR扩增含上游同源臂+LacZ+hyg+下游同源臂的片段(≈6 kb),电击转化该载体片段(700 ng)到SY3126(含pJV53-gfp)感受态细胞中,复苏后涂到含40 μl X-gal(20 mg/ml)的hyg+kana抗性的7H10固体培养基上,3~4 d后挑选蓝色菌落并测序验证。同时,采用同源重组的方法构建5个突变菌株(即SY3328、SY3309、SY6407、SY3310、SY3311)[14],并将PCR扩增的5对毒素-抗毒素系统的抗毒素基因(即MSMEG_1277、MSMEG_1283、MSMEG_3435、MSMEG_4447、MSMEG_5635)的开放阅读框(ORF)和基因上游约500 bp(包含启动子)的碱基序列克隆入pMV261,以构建高表达抗毒素基因的穿梭质粒载体,将pMV261-con和pMV261-MSMEG_1277分别电转至SY3328突变菌株中(另外4个突变菌株用同样的方式验证)。当A600≈1.0时,采用紫外分光光度计测定A550和A420,计算β-半乳糖苷酶活性[酶活性单位为“Miller单位(MU)”][β-半乳糖苷酶活性=1000×(A420-1.75×A550)/反应时间(min)×A600×菌量(ml)][16]。以β-半乳糖苷酶活性为纵坐标,突变菌株名称为横坐标,绘制柱状图。为使实验达到较好的平行性,该实验独立重复3次,取其中1次的数据做图。
四、统计学处理
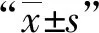
结 果
一、耻垢分枝杆菌中毒素-抗毒素系统的鉴定及功能检测
耻垢分枝杆菌中MSMEG_3435-3436、MSMEG_6762-6760基因排列见图1。与电转空载体pYC601对照组菌株相比,无ATc诱导时,表达MSMEG_3436和MSMEG_3435-3436、MSMEG_6760和MSMEG_6762-6760的菌株均可正常生长(图2,4);而有ATc诱导时,表达MSMEG_3436的菌株几乎没有生长,表现出明显的抑菌作用,但表达MSMEG_3435-3436的菌株可正常生长(图3),而诱导表达MSMEG_6760和MSMEG_6762-6760的菌株均未可正常生长(图5)。
二、敲除菌株生存能力鉴定及抗生素胁迫
crRNA序列见表2。经琼脂糖凝胶电泳和测序结果显示,成功获得ΔMSMEG_3435-3436、ΔMSMEG_6762-6760基因敲除突变菌株,琼脂糖凝胶电泳验证见图6,验证引物及删除片段大小见图注。与野生株相比,ΔMSMEG_3435-3436、ΔMSMEG_6762-6760突变菌株的生长表型均无明显差异(图7)。经验证ΔMSMEG_6762-6760是一对无功能的毒素-抗毒素系统,故未检测其与药物间耐药的相关性,仅对ΔMSMEG_3435-3436突变菌株与异烟肼和利福平耐药的相关性进行验证。野生株和ΔMSMEG_3435-3436突变菌株在加药处理前及经异烟肼和利福平处理24 h后的菌落形成单位即存活率见表3,加药处理后的野生株和ΔMSMEG_3435-3436突变菌株的菌落形成单位和存活率间的差异均无统计学意义(表3,图8)。

MSMEG_3434和MSMEG_6761为上游基因,MSMEG_3435和MSMEG_6762为抗毒素基因,MSMEG_3436和MSMEG_6760为毒素基因,MSMEG_3437和MSMEG_6763为下游基因图1 基因排列示意图
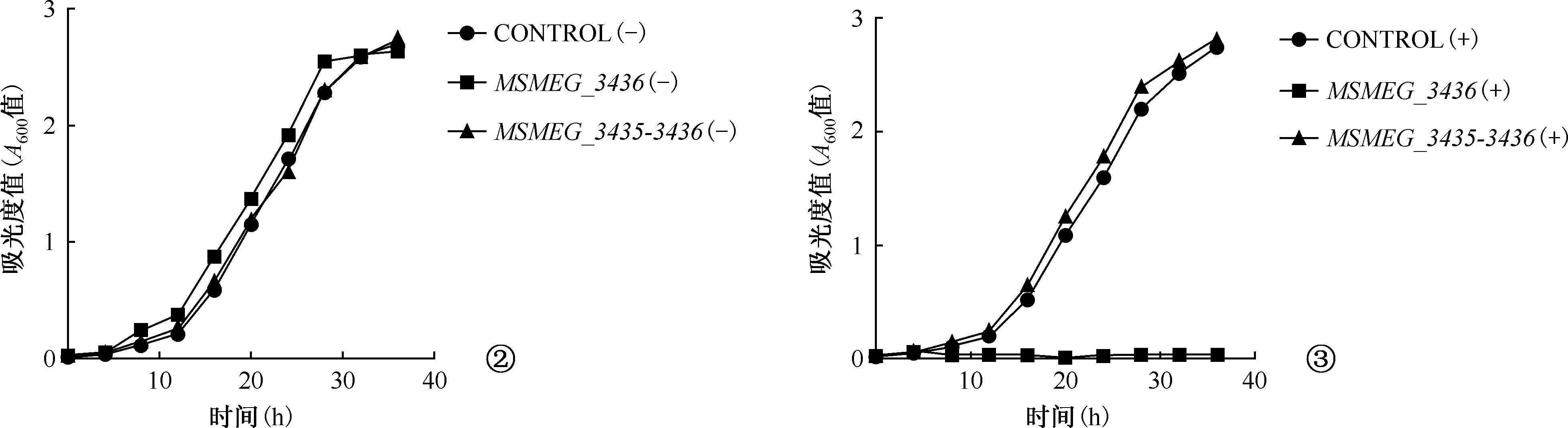
CONTROL为pYC601载体空白对照,(-)为未加ATc诱导,(+)为加ATc诱导,ATc 浓度为100 ng/ml;“A600值”指在波长600 nm处所测的吸光度值。图2为与电转空载体pYC601对照组菌株相比,无ATc诱导时,表达MSMEG_3436和MSMEG_3435-3436的菌株均正常生长。图3 为有ATc诱导时,诱导表达MSMEG_3436的菌株几乎没有生长,诱导表达MSMEG_3435-3436的菌株可正常生长图2,3 耻垢分枝杆菌毒素-抗毒素系统MSMEG_3435-3436对细菌生长的功能鉴定
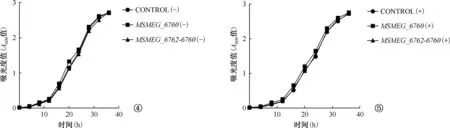
CONTROL为pYC601载体空白对照,(-)为未加ATc诱导,(+)为加ATc诱导,ATc 浓度为100 ng/ml;“A600值”指在波长600 nm处所测的吸光度值。图4为与电转空载体pYC601对照组菌株相比,无ATc诱导时,表达MSMEG_6760和MSMEG_6762-6760的菌株均可正常生长。图5为有ATc诱导时,诱导表达MSMEG_6760和MSMEG_6762-6760的菌株均可正常生长图4,5 耻垢分枝杆菌毒素-抗毒素系统MSMEG_6762-6760对细菌生长的功能鉴定

菌株类型菌落形成单位(CFU,x±s)处理后存活率(%,x±s)处理前(×105)异烟肼处理后(×105)利福平处理后(×104)异烟肼处理后利福平处理后野生株126.70±13.335.33±1.761.80±0.464.38±1.480.15±0.04突变株266.70±6.67 9.33±1.760.33±0.133.49±0.660.03±0.02t值9.3911.6043.0510.5482.663P值0.0010.1840.0380.6130.056

泳道M为Trans 2 k Plus DNA ladder marker,即750 bp、1 kb、2 kb、3 kb;泳道1为在野生型分枝杆菌上用引物MSMEG_3435 up F(MSMEG_ 3435上游同源臂正向引物)和R in Ds for MSMEG(MSMEG_ 3435下游同源臂逆向引物)3435-3436所得扩增产物条带,即1999 bp;泳道2为在ΔMSMEG_3435-3436菌株上用引物MSMEG_3435 up F和R in Ds for MSMEG_3435-3436所得扩增产物,删掉了959 bp;泳道3为在野生型分枝杆菌上用引物MSMEG_6760 up F和R in Ds for MSMEG_6762-6760所得扩增产物条带,即1824 bp;泳道4为在ΔMSMEG_6762-6760菌株上用引物MSMEG_6760 up F和R in Ds for MSMEG_6762-6760所得扩增产物,删掉了792 bp图6 应用CRISPR-Cas12a辅助的重组系统构建ΔMSMEG_3435-3436、ΔMSMEG_6762-6760突变菌株
三、LacZ融合转录调控及启动子活性检测
将pMV261空载体和pMV261-antitoxin系列质粒(即pMV261-MSMEG_1277、pMV261-MSMEG_1283、pMV261-MSMEG_3435、pMV261-MSMEG_4447、pMV261-MSMEG_5635)分别电转至经测序验证成功整合LacZ报告基因的5个突变菌株(即SY3328、SY3309、SY6407、SY3310、SY3311)中。生长至A600≈1.0时,用紫外分光光度计测定A600、A550和A420,计算β-半乳糖苷酶活性。与电转pMV261空载体相比,电转pMV261-antitoxin系列质粒的5个突变菌株中,抗毒素蛋白对启动子活性的抑制程度差异均无统计学意义(表4)。
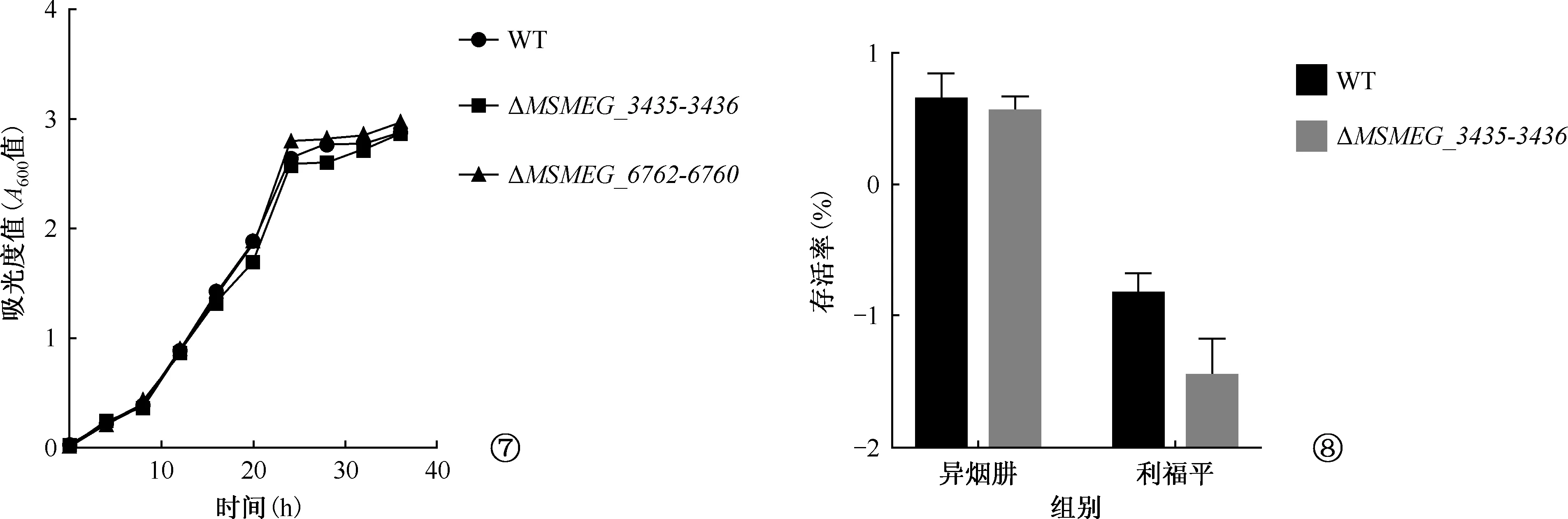
WT为野生型耻垢分枝杆菌,ΔMSMEG_3435-3436和ΔMSMEG_6762-6760分别为MSMEG_3435-3436和MSMEG_6762-6760的突变株。图7为与野生株相比,两个突变株的生长表型均与野生型菌株无差异。 图8为野生株和ΔMSMEG_3435-3436突变菌株在异烟肼和利福平处理24 h后(抗生素胁迫)的生存率比较,为直观显示纵坐标采用log10转换后表示图7,8 野生株和ΔMSMEG_3435-3436突变菌株在生长表型和抗生素胁迫方面的差异

菌株吸光度值A600值(x±s)A420值(x±s)A550值时间(min)β-半乳糖苷酶活性(MU,x±s)t值P值SY3328:: con1.025±0.0060.662±0.0290.0485.0376.50±17.132.2720.086SY3328:: MSMEG_12770.991±0.0270.550±0.0250.047 5.0315.50±20.71SY3309:: con1.018±0.0160.318±0.0150.0504.0189.00±12.241.7950.147SY3309:: MSMEG_12831.067±0.0140.297±0.0070.0524.0160.70±9.89SY6407:: con0.819±0.0060.480±0.0210.04718.0225.20±9.951.3190.258SY6407:: MSMEG_34350.815±0.0030.476±0.0060.04719.0211.70±2.57SY3310: con0.932±0.0310.417±0.0220.047 5.5221.40±12.071.9490.123SY3310: MSMEG_44470.839±0.0290.317±0.0180.0475.0186.60±13.17SY3311:: con0.988±0.0010.402±0.0130.048 6.0179.10±5.872.5620.063SY3311:: MSMEG_56350.944±0.0370.290±0.0300.052 5.5127.70±19.21
讨 论
毒素-抗毒素系统在细菌中的生物学功能是当前研究的热点。结核分枝杆菌至少含有93个预测的毒素-抗毒素系统[3],包括RelBE、MazEF、ParDE、VapBC、HigBA、YefM/YoeB等家族,这些毒素-抗毒素系统可能与细菌生长速率、长期休眠和耐药性相关[3],但由于涉及大量的基因,目前尚没有研究直接通过基因缺失来评估整体毒素-抗毒素系统的功能。根据生物信息学预测和实验研究结果显示,耻垢分枝杆菌至少含有7个毒素-抗毒素系统,数量远远少于结核分枝杆菌的毒素-抗毒素系统,可能与结核分枝杆菌的耐受和持留密切相关[10, 17],故认为对耻垢分枝杆菌的毒素-抗毒素系统的研究,对于认识分枝杆菌的毒素-抗毒素系统有重要作用。
据Tandon等[17]报道,Rv0366c-Rv0367c是结核分枝杆菌中非典型的PezAT样毒素-抗毒素系统,在耻垢分枝杆菌中Rv0366c的过表达可诱导其抑菌作用,并且该生长缺陷可以通过同源抗毒素Rv0367c的共表达后得以恢复,诱导表达Rv0366c使细菌长度缩短,并对乙胺丁醇的耐受性增强,经同源性分析表明,耻垢分枝杆菌的MSMEG_3435-3436是一个预测的毒素-抗毒素系统,但其功能目前没有文献报道。Bajaj等[18]报道了MSMEG_6760的晶体结构,并预测MSMEG_6760与处于同一操纵子调控的MSMEG_6762是一个毒素-抗毒素系统。基于结构预测显示,MSMEG_6762-6760与Rv2034-2035具有同源性[3]。本研究通过在液体培养基中加入一定浓度的四环素来诱导表达MSMEG_3436,显示出明显的毒性作用,导致细菌生长受到抑制,但当与其同源抗毒素MSMEG_3435共表达时,MSMEG_3436的毒素作用被中和,首次证明了MSMEG_3435-3436是一个有功能的毒素-抗毒素系统;而诱导表达MSMEG_6762-6760后,没有显示出毒性作用,证明了MSMEG_6762-6760是一个无功能的毒素-抗毒素系统,成为第一次在耻垢分枝杆菌中发现无功能的毒素-抗毒素系统的研究。由于本研究过表达所用的启动子是诱导型的,蛋白表达较高,尽管不能完全排除重组构建后目的基因并未表达的情况,但是大量研究都是通过在耻垢分枝杆菌及大肠杆菌中应用诱导型启动子来验证毒素-抗毒素系统的基因功能,已经报道的Rv0229c、Rv0569、Rv2165c等都是结核分枝杆菌中无功能的毒素-抗毒素系统[3, 6, 8],提示耻垢分枝杆菌中也可能存在无功能的毒素-抗毒素系统。
为了更好地研究毒素-抗毒素系统在耻垢分枝杆菌中的功能,本研究应用了CRISPR-Cas12a基因编辑技术构建了ΔMSMEG_3435-3436和ΔMSMEG_6762-6760基因敲除突变菌株。与野生株相比,在液体培养基中检测其生长曲线,发现单个毒素-抗毒素系统的缺失不会影响其生长表型,同Frampton等[10]的研究报道一致,他们分别构建了ΔvapBC,ΔmazEF,Δphd/doc敲除菌株也均未检测到表型差异,说明单个毒素抗毒素系统的缺失可能不会影响细菌的生长表型。在进一步的研究中,笔者挑选了ΔMSMEG_3435-3436敲除菌株,通过添加高浓度的异烟肼和利福平来验证毒素-抗毒素系统与药物耐受间的关系。虽然耻垢分枝杆菌对这两种一线抗结核药物天然耐药,但其天然耐药的机制仍未明确。笔者认为,研究异烟肼和利福平在耻垢分枝杆菌中天然耐药的分子机制,可以为阐明异烟肼和利福平在结核分枝杆菌中的耐药分子机制提供新的线索,而且有可能发现耻垢分枝杆菌天然耐药的机制与其毒素-抗毒素系统是否相关的问题。研究结果显示,高浓度异烟肼和利福平对野生株和ΔMSMEG_3435-3436敲除菌株均有95%以上的杀菌作用。通过比较加药处理前后的存活率表明,野生株和ΔMSMEG_3435-3436敲除菌株与异烟肼(药物靶点:分枝菌酸生物合成)和利福平(药物靶点:RNA合成)耐受均无明显关系。Frampton等[10]还研究了高浓度链霉素(药物靶点:多肽的生物合成)和利福平对删除了3个毒素-抗毒素系统的突变菌株(ΔMSMEG_1277-1278+ ΔMSMEG_1283-1284+ ΔMSMEG_4447-4448)的药物耐受情况,结果显示毒素-抗毒素系统与这两种抗生素耐受无关。也有研究表明,当毒素基因过表达时,细菌持留性增强进而促进细菌产生耐药性,而在缺失毒素-抗毒素系统的突变菌株中持留性是减弱的[19]。这提示我们,通过构建过表达菌株、增加药物种类等方式可以进一步优化实验,可以通过更多的研究来确定毒素-抗毒素系统与药物耐受的关系。
截至目前,在耻垢分枝杆菌中共计鉴定出7个毒素-抗毒素系统。除了MSMEG_2143-2144不含毒素基因和MSMEG_6762-6760是一个无功能的毒素-抗毒素系统,共计验证出5个有功能的毒素-抗毒素系统。本研究利用LacZ报告基因检测启动子活性(β-半乳糖苷酶活性)来研究毒素-抗毒素系统转录的负自动调节。诸多文献报道,典型的毒素-抗毒素系统的表达受毒素-抗毒素复合物的调节,该复合物中的抗毒素与相关启动子DNA相互作用,抑制转录,导致毒素-抗毒素系统转录的负自动调节[8, 20-21]。Robson等[9]和Frampton等[10]的研究认为,在耻垢分枝杆菌中抗毒素基因的表达可以抑制启动子的活性,但局限性在于该研究不是对基因组原位的验证,而是在质粒上构建并通过外源转入。为评估耻垢分枝杆菌中抗毒素蛋白与其自身启动子结合的特性,本研究以LacZ为报告基因,在染色体上检测了这5个毒素-抗毒素系统的自调控功能。与对照组相比,抗毒素表达载体仅轻微抑制了毒素-抗毒素系统的启动子活性,说明在耻垢分枝杆菌中毒素-抗毒素系统的自调控功能不明显,与Robson等[9]和Frampton等[10]的实验报道结果一致。虽然也有许多对其他菌属自调控功能的研究,如肠炎链球菌的TacT介导的TacA乙酰化会改变TacAT的启动子结合模式,但似乎并不影响对基础TacAT的转录水平[22];还有对AtaRT-操纵基因DNA复合物的晶体结构表明,提示异六聚体排列对于转录自调控也是至关重要的[23]。但对分枝杆菌中毒素-抗毒素系统的自调控功能的分子机制尚不清楚,还需要进行更深入的研究。
综上所述,本研究成功构建了MSMEG_3435-3436和MSMEG_6762-6760的表达体系及敲除菌株,发现MSMEG_3435-3436是耻垢分枝杆菌中一对新的有功能的毒素-抗毒素系统。初步探讨了这两对毒素-抗毒素系统对菌株生长表型及与对异烟肼和利福平耐受的相关性,验证了耻垢分枝杆菌中5对毒素-抗毒素系统的自调控功能,为下一步研究结核分枝杆菌毒素-抗毒素系统的功能奠定了基础。
