初探BRAFV600E免疫组化在甲状腺乳头状癌中的应用
2020-02-14罗昊刘艳丽刁国庆吴敏刘东刘鑫
罗昊,刘艳丽,刁国庆,吴敏,刘东,刘鑫
(北京市昌平区医院 病理科,北京 102200)
0 引言
甲状腺癌是最常见的内分泌肿瘤,据北京市2015年癌症播报数据显示甲状腺癌已上升为女性癌症发病率的第三顺位。近年研究发现甲状腺乳头状癌与BRAF基因突变有密切关系,尤其是BRAF第600位缬氨酸(V)向谷氨酸(E)的突变,研究数据表明甲状腺乳头状癌中BRAFV600E突变率高达29%-83%[1-3],被认为是甲状腺乳头状癌不良预后因素。但目前的主流研究BRAFV600E突变的方法主要为DNA测序以及基于PCR的各种分子生物学方法等,这些分子生物学检测需要专业的操作人员而且实验条件要求严格,实验成本高和周期长,价格较高,病人花费较多,不利于 BRAFV600E突变的检测和应用。本文拟通过免疫组化法检测BRAFV600E突变蛋白PTC中的表达分析,探讨免疫组化法检测BrafV600E突变的可行性。
1 材料和方法
1.1 材料。收集2016年8月至2018年8月昌平区医院病理科接收60例甲状腺病变手术切除标本。其中PTC组49例,男女比例1:3,患者年龄28-76岁;其中微小甲状腺乳头状癌(直径<1.0 cm)35例;10例有区域淋巴结清扫病例中仅3例有淋巴结转移;PTC组中经典型PTC47例,滤泡亚型2例(包括其中一例为包裹型滤泡亚型)。其他良性病变共10例。PTC组中1例经PCR检测证实BRAFV600E阳性病例作为阳性对照,另取1例滤泡癌,1例皮肤组织作为阴性对照。
1.2 实验方法。所有染色组织选自非冰冻组织蜡块,切片厚度4 μm,经烤箱70度烤30 min。其后使用罗氏诊断BRAF V600E(VE1)抗体检测试剂盒(英文名:VENTANA anti-BRAF V600E(VE1) Mouse Monoclonal Primary Antibody,购于北京巴瑞试剂公司),并按照试剂盒说明书操作,在本塔纳标准全自动染色平台上进行免疫组织化学染色。染色结果由两位高级职称医师观察评判,当肿瘤细胞浆的出现染色被认为是正确的染色部位;但肿瘤细胞仅有散在、微弱阳性判读为BRAFV600E突变蛋白阴性;当大于85%的肿瘤细胞浆出现中等强度以上染色则判读为BRAFV600E突变蛋白阳性[4]。
1.3 统计学分析。本文中所有数据SSPS 21.0软件做χ2检验分析,当P<0.05为具有统计学显著意义。
2 结果
2.1 BRAFV600E免疫组化结果
2.1.1 PTC与非癌组织的结果对比:49例甲状腺乳头状癌组中其中1例由于肿瘤组织太少,免疫组化切片上已无肿瘤组织,因此从PTC组剔除,PTC组最终剩余48例病例数进行统计研究。48例PTC组中有38例表达BRAFV600E突变蛋白阳性,总阳性表达率为(38/48)79.1%而甲状腺非肿瘤组BrafV600E突变蛋白阳性表达率为0,(χ2=19.59,P<0.01)两组差别有显著统计学意义。
2.1.2 相关临床特征分组之间的差别:将48例PTC按照性别、年龄(>45,≤45)、肿瘤大小(≥1 cm,小于1 cm)、肿瘤有无包膜侵犯等分组分析BrafV600E突变蛋白表达情况,结果显示各组之间差别均无统计学意义,见表1。另由于本组数据中有淋巴结转移较少未做统计,3例有转移癌淋巴结病例中两例BRAFV600E阳性,1例由于组织飞片无法判断。
3 讨论
随着BRAFV600E突变蛋白单抗VE1 的诞生,免疫组化检测BRAFV600E突变也应运而生,虽然Dan Chen等的研究中发现2例IHC阳性而PCR阴性病例,认为IHC可能存在少量假阳性[5],但多项研究表明BRAF V600E免疫组化在组织中检测的结果与PCR等检测方法结果相比较都有较好的一致性[6-7]。本研究组中48例甲状腺乳头状癌组中有38例BRAF V600E阳性,总体的阳性率79.2%。结果与Jung-Soo等一项包含不同国家11篇文章的1141病例的meta分析中得出甲状腺乳头状癌中BRAF V600E免疫组化检测的总体阳性率79.1%[6]相符,因此可见免疫组化法有较高的可靠性和稳定的。
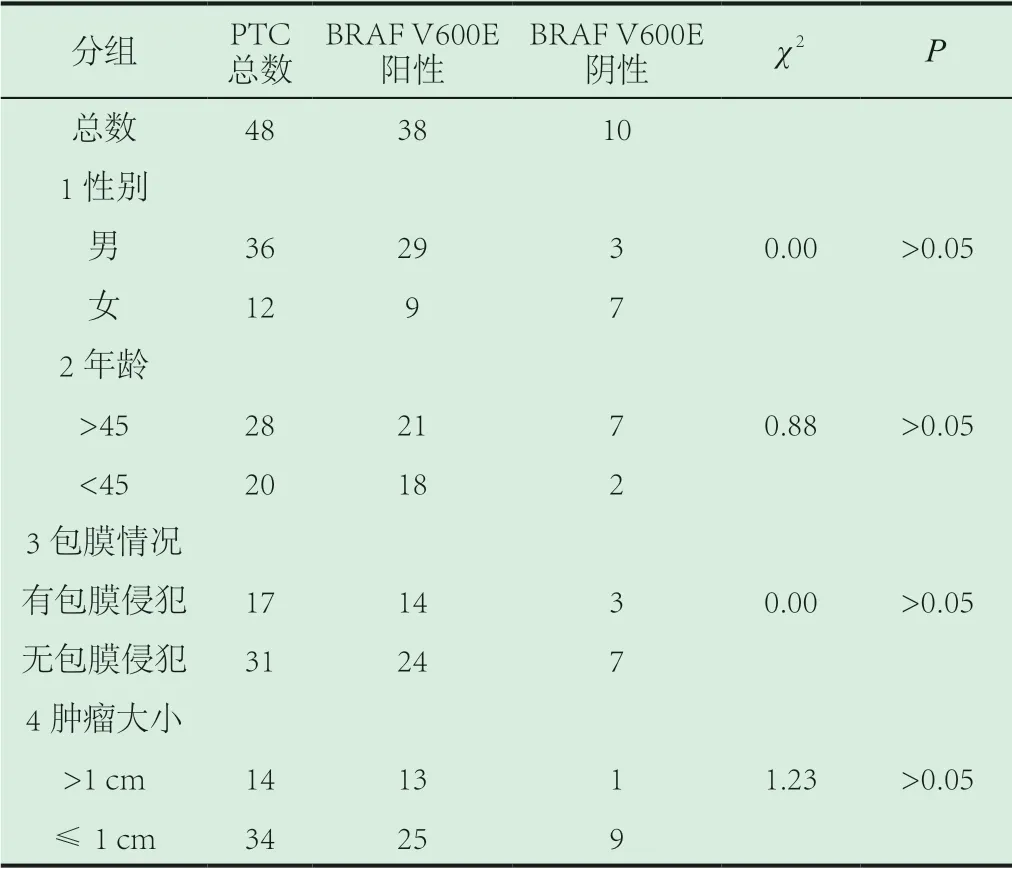
表1 两组患者相关临床特征对比
当前关于BRAF V600E突变与甲状腺乳头状癌的临床病理关系,研究结论仍不一致,部分研究认为BRAFV600E突变与患者年龄,肿瘤大小,生长方式,肿瘤分型,远处转移等有关[8-9]而有些研究认为BRAF V600E突变仅仅与区域淋巴结转移有关,与其他临床信息均无关系[4]本研究中也得到类似结果。笔者推测多项研究的不一致性可能由于样本量和人群以及研究方法之间的差异所致,但同时可能提示BRAFV600E突变并非与某项临床病理信息存在确定相关性,而只是肿瘤发生相关的一种分子机制。同时,我们已知甲状腺乳头状癌生物学性质相对温和,虽然其区域淋巴结转移率可达20%-60%[10],尤其是经典的甲状腺乳头状癌病例中,但是仅有10%-15%的病例会表现为侵袭发展的行为,与当前甲状腺乳头状癌中BRAFV600E高达29%-83%的突变率存在一定差异。因此推测BRAFV600E突变可能是肿瘤发生相关的一种分子机制,是影响甲状腺乳头状癌预后的一个因素,但并非唯一的关键因素。关于BRAFV600E突变对于甲状腺乳头状癌的更大的意义可能在于其相关分子药物靶向治疗,而非不良预后的预测上。因此改用成本较低、易操作的免疫组化方法有助于BRAFV600E突变检测推广,从而使更多患者受益。
当然,由于当前免疫组化的方法运用并不广泛,对BRAFV600E突变的免疫组化结果仍缺乏统一的判读标准[11]。一些研究者认为肿瘤细胞浆中出现中-强度的染色即确定为阳性[5-9],未对肿瘤细胞阳性的数量并未提出要求;而Fisher等认为只有>10%肿瘤细胞浆内出现中度-强度的阳性才能判读为阳性[12]。其他一些学者则认为弥漫>85%肿瘤细胞浆内出现明确染色可以判读为阳性[4],因此建立统一的标准的判读标准,是推广BRAFV600E免疫组化作为初筛方法的首要问题。
综上所述,BRAFV600E免疫组化以其较高的可靠性和简便快捷,易操作,花费低等优点可作为初步鉴别诊断手段以便广泛运用于甲状腺乳头状癌组织及细胞学诊断中。其次建立规范的BRAFV600E免疫组化的结果判读标准,研究和确立类似于乳腺、胃的关于HER-2检测与治疗相关性的系列关系,可能是未来研究BRAFV600E突变在甲状腺乳头状癌患者个性化治疗中的作用的关键问题。
