TGF-β1体外诱导兔子宫内膜上皮细胞EMT模型
2020-02-14汪国武
姚 远,汪国武,张 雨,刘 芳
宫腔黏连(intrauterine adhesion,IUA)是子宫内膜损伤修复障碍最常见的疾病,其本质是子宫内膜纤维化修复,确切的发病机制至今尚不明确。近年研究证实,IUA的发生与上皮间质转化(epithelial mesenchymal,EMT)密切相关[1-2]。Thiery et al[3]提出2型EMT是大部分纤维化疾病的主要发病机制之一。TGF-β1是诱导EMT的重要因子之一,广泛用于体外诱导上皮细胞EMT[4-6]。项目组首次以兔子宫内膜上皮细胞为研究对象,通过CCK-8、免疫组化、Western blot等方法探讨TGF-β1诱导兔子宫内膜上皮细胞发生EMT的条件,为研究IUA的发病机制、预防及治疗等提供一定的细胞基础。
1 材料与方法
1.1 实验动物10~12周龄雌性新西兰大白兔(体质量2.5~3.0 kg,清洁级)60只,购于新疆医科大学实验动物中心,购回后自由进食水适应性饲养一周,实验过程严格遵守动物伦理学标准。
1.2 主要试剂与仪器孕马血清促性腺激素(PMSG)购自北京Solarbio公司;绒毛膜促性激素(hCG)购自宁波市三生药业;DMEM/F12培养基、胎牛血清、表皮生长因子、胶原酶I、0.25%胰蛋白酶购自美国Sigma公司;Human TGF-β1购自美国PEPROTECH公司;Rabbit Anti-Cytokeratin 19 antibody、Rabbit anti-Vimentin antibody、Rabbit Anti-E cadherin antibody购自北京Bioss公司;即用型SABC-POD试剂盒购自武汉博士德生物公司。二氧化碳恒温培养箱(HF151,上海力新仪器有限公司);生物安全柜(BHC-1300ⅡA2,北京阿尔泰实验室设备有限公司);高端研究级倒置显微镜(Axio Observer A1,德国蔡司公司);全光栅酶标仪(Multiskan GO,美国莫赛飞世尔公司);双垂直电泳仪(DYCZ-24DN,北京六一仪器厂)。
1.3 细胞的培养给予兔肌肉注射PMSG 100 IU,48 h后耳缘静脉注射hCG 80 IU,18 h后耳缘静脉空气栓塞处死,取出子宫,含2%双抗PBS洗3次,纵向剪开子宫,用手术刀片背面轻刮内膜面至手感粗糙,DMEM/F12收集组织,用含0.05%胶原酶Ⅰ和0.05%胰蛋白酶的PBS重悬,37 ℃水浴锅中消化30 min。含10%胎牛血清DMEM/F12终止消化,150 nm滤网进行过滤,滤液使用38 nm细胞筛进行过滤,滤网上为兔子宫内膜上皮细胞,滤网下为兔子宫内膜间质细胞,DMEM/F12反复冲洗细胞筛,收集冲洗液1 200 r/min,离心6 min,弃上清液,使用上皮细胞培养基重悬,以1×106个/ml接种,置于37 ℃,5%CO2,95%湿度的培养箱培养。
1.4 细胞免疫组化鉴定4%多聚甲醛室温固定细胞30 min,0.3% Triton X-100浸泡5 min,蒸馏水洗2次,30% H2O2与纯甲醇1 ∶50混合,室温浸泡30 min,蒸馏水洗3次。5% BSA封闭,滴加一抗CK19(1 ∶200稀释)、VIM(1 ∶200)、E-cadherin(1 ∶200),37 ℃孵育1 h,加入二抗孵育37 ℃,30 min,PBS洗2次,加入SABC 37 ℃,30 min,DAB显色2~10 min,苏木精轻度复染25 s,1% HCl酒精洗涤7~8 s,酒精梯度脱水,二甲苯透明,中性树脂封片,在倒置显微镜下观察结果。
1.5 CCK-8检测将对数生长期的细胞接种至96孔板中,待细胞融合至50%~60%,更换无血清的DMEM/F12培养基饥饿处理12 h后更换上皮细胞培养基,分别加入0、10、60、110 μg/L TGF-β1处理24 h和48 h后每孔加入10 μl CCK-8溶液,孵育3 h后酶标仪测定450 nm下的OD值,实验重复3次取平均值。增殖抑制率(IR)%=[(OD值阴性对照组-OD值空白对照组)-(OD值实验组-OD值空白对照组)]/(OD值阴性对照组-OD值空白对照组)×100%。
1.6 Western blot检测提取总蛋白,应用BCA法检测蛋白浓度,分别取等量的蛋白质样本,进行SDS-PAGE凝胶电泳后,将蛋白转移至PVDF膜上,脱脂奶粉封闭,分别加入稀释的一抗VIM(1 ∶200)、E-cadherin(1 ∶200),4 ℃过夜。TBST洗3次,再将PVDF膜放入10 ml二抗稀释液(1 ∶10 000)中,37 ℃温箱避光孵育1 h,TBST洗3次。加ECL发光剂,X线曝光、显影、定影。以GAPDH作为内参,通过Image J对比蛋白灰度值进行分析计算。

2 结果
2.1 兔子宫内膜上皮细胞培养及鉴定细胞在培养3 d后开始贴壁,细胞贴壁后增殖速度缓慢,约生长14 d后铺满瓶底,细胞呈近圆形,胞浆饱满,核位于细胞中央,排列紧密,呈铺路石样(图1 A)。对其骨架蛋白进行免疫细胞化学鉴定,结果显示:子宫内膜腺上皮细胞特异性细胞角蛋白-19(CK-19)染色呈现阳性,细胞质被染成棕黄色,核周胞质染色最强(图1 B)。

图1 兔子宫内膜上皮细胞培养及鉴定 ×200
A:P1代兔子宫内膜上皮细胞;B:P1代兔子宫内膜上皮细胞CK-19染色
2.2 TGF-β1对兔子宫内膜上皮细胞增殖的影响TGF-β1处理24、48 h,随着作用浓度增高,兔子宫内膜细胞增殖抑制率显著升高(F24 h=555.10,P<0.01;F48 h=17.00,P<0.01),差异有统计学意义。与10 μg/L TGF-β1处理组比较,60、110 μg/L处理24 h及48 h后细胞增殖均受到显著抑制(P<0.05),但60、110 μg/L浓度处理组间无显著差异(P>0.05)。对不同时间点同一浓度进行比较发现60、110 μg/L浓度TGF-β1处理组48 h后对细胞的抑制率均显著高于24 h(P<0.05)(表 1)。

表1 不同浓度TGF-β1对兔子宫内膜上皮细胞细胞增殖抑制率
与10 μg/L组比较:*P<0.05;与同浓度24 h组比较:△P<0.05
2.3 TGF-β1对兔子宫内膜上皮细胞形态的影响不同浓度TGF-β1诱导兔子宫内膜上皮细胞24 h及48 h后,倒置显微镜下观察细胞形态变化:结果如图2所示:在不同浓度及不同时间点的TGF-β1诱导下,子宫内膜上皮细胞均呈不同程度的拉长或出现丝状伪足,细胞拉长呈梭形,细胞边界模糊,细胞间隙增大,细胞密度降低。其中60 μg/L TGF-β1诱导24 h后,大多数细胞呈梭形(图2C),细胞形态较正常培养组相比发生了明显的变化,向间质细胞样细胞形态转化;110 μg/L TGF-β1诱导48 h后,细胞呈典型的梭形,且细胞密度明显降低(图2H)。用不含TGF-β1的培养基继续培养上述细胞,观察到细胞形态保持稳定。
2.4 Western-blot法检测E-cadherin和VIM蛋白表达结果显示(图3):TGF-β1处理24、48 h,随着作用浓度增高,E-cadherin蛋白相对表达量显著降低(F24 h=15.89,P<0.01;F48 h=224.6,P<0.01),差异有统计学意义;VIM蛋白相对表达量显著升高(F24 h=27.77,P<0.01;F48 h=38.34,P<0.01),差异有统计学意义。与对照组比较,10 μg/L TGF-β1诱导24 h及48 h E-cadherin和VIM蛋白的表达均无显著变化(P>0.05);与对照组比较,60、110 μg/L TGF-β1诱导24 h及48 h均显著降低了E-cadherin蛋白表达量(P<0.05),显著提高了VIM蛋白的表达量(P<0.05);60 μg/L TGF-β1诱导48 h较24 h组E-cadherin蛋白和VIM蛋白的表达量差异均有统计学意义(P<0.05);110 μg/L TGF-β1诱导48 h较24 h组VIM蛋白的表达增加,差异有统计学意义(P<0.05)。
2.5 免疫组化鉴定60 μg/L TGF-β1诱导内膜上皮细胞24 h免疫组化鉴定结果显示:E-cadherin蛋白实验组较对照组阳性细胞较少(图4A、4B);VIM蛋白实验组较对照组阳性细胞较多(图4C、4D)。使用Image J计算相对阳性细胞面积:TGF-β1实验组E-cadherin蛋白表达(95.94±2.662)显著低于对照组(115.8±3.788),差异有统计学意义(P<0.05),实验组VIM蛋白表达量(132.4±4.638)显著高于对照组(108.7±2.532),差异有统计学意义(P<0.05)。

图2 TGF-β1对兔子宫内膜上皮细胞形态生物影响 ×100
A:正常培养24 h;B:10 μg/L TGF-β1剂量组诱导24 h;C:60 μg/L TGF-β1剂量组诱导24 h;D:110 μg/L TGF-β1剂量组诱导 24 h;E:正常培养48 h;F:10 μg/L TGF-β1剂量组诱导48 h;G:60 μg/L TGF-β1剂量组诱导48 h;H:110 μg/L TGF-β1剂量组诱导 48 h

图3 不同浓度TGF-β1及不同作用时间诱导子宫内膜上皮细胞蛋白表达变化
A:24 h E-cadherin、VIM蛋白表达量;B:48 h E-cadherin、VIM蛋白表达量;C:E-cadherin蛋白相对表达量;D:VIM蛋白相对表达量;1:对照组;2:10 μg/L TGF-β1诱导组;3:60 μg/L TGF-β1诱导组;4:110 μg/L TGF-β1诱导组;与对照组比较:*P<0.05;与同浓度24 h组比较:#P<0.05
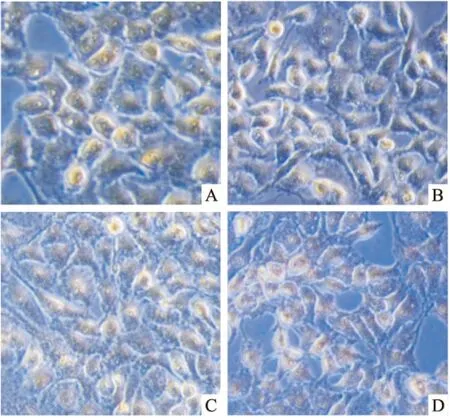
图4 TGF-β1诱导兔子宫内膜上皮细胞24 h免疫组化 ×100
A:E-cadherim对照组;B:E-cadherim实验组;C:VIM对照组;D:VIM实验组
3 讨论
EMT的发生取决于细胞从其微环境获得信号,TGF-β1是一类涉及细胞增殖、凋亡、分化及EMT的调节因子[7]。在炎症或损伤等病理因素作用下,TGF-β1趋化成纤维细胞和炎性细胞聚集,同时促进胶原蛋白和纤维蛋白的合成,致使细胞外基质(ECM)沉积和降解紊乱,促进细胞转分化。研究显示,IUA子宫内膜及黏连组织[8]、血清[9]中TGF-β1表达较对照组均显著升高,且TGF-β1的表达与宫腔黏连程度呈正相关[10],提示TGF-β1参与子宫内膜损伤纤维化修复,为TGF-β1诱导子宫内膜上皮EMT提供了一定的理论基础。
细胞增殖、分化、衰老、凋亡是多数细胞的发育结局,其可因微环境不同而相互影响,细胞的分化、凋亡、衰老会导致其本身增殖抑制,本研究发现60 μg/L TGF-β1诱导子宫内膜上皮细胞24 h即可抑制多数细胞增殖,促进其转分化。随着TGF-β1浓度和作用时间增加,子宫内膜上皮细胞EMT标志物E-cadhrien表达显著下调,表明TGF-β1是诱导EMT的有效因子。而VIM表达量呈增加趋势,与前期课题小组研究子宫内膜损伤后VIM蛋白表达增加结果一致[11]。综上,子宫内膜上皮细胞通过TGF-β1诱导后,其形态向间质细胞转变,主动转移潜能增加而细胞间黏附性降低,失去极性,发生了表型转化,成功诱导子宫内膜上皮细胞发生EMT。EMT与子宫内膜纤维化疾病相关的研究很少见,直至近年才有学者陆续提出EMT可能是IUA的发病机制之一[2-3],建立子宫内膜上皮细胞EMT模型或可为研究IUA发病机制及治疗提供依据。
EMT是纤维化疾病中至关重要的过程,应用EMT特异性抑制剂,阻碍EMT过程,已成为靶向治疗纤维化疾病的新策略[12-13],TGF-β1诱导兔子宫内膜上皮细胞EMT为研究宫腔黏连等子宫内膜纤维化修复疾病的发病机制、预防及治疗提供了一定的细胞基础。综上所述,使用60 μg/L的TGF-β1诱导兔子宫内膜上皮细胞24 h可成功建立EMT模型,但还需要进一步研究建立子宫内膜细胞EMT更加细致的条件及TGF-β1诱导兔子宫内膜上皮细胞EMT的具体机制。
