格列本脲、二甲双胍对GDM小鼠糖代谢的影响
2020-02-14陈可洋
余 婷,汪 洋,陈可洋
妊娠期糖尿病(gestational diabetes mellitus,GDM)被定义为在妊娠期间发生或首先被识别葡萄糖调节受损,是妊娠期的一种很常见并发症[1]。临床上除胰岛素之外,GDM的药物治疗选择十分有限[2]。格列本脲和二甲双胍治疗2型糖尿病均有很好的降糖效果,但它们应用于GDM的作用效果和后续影响仍知之甚少[3]。格列本脲的主要作用是增加胰岛素分泌,从而减少肝脏葡萄糖的产生,间接改善胰岛素敏感性[4]。而二甲双胍是双胍类药物,是胰岛素增敏剂[5]。据报道,二甲双胍可降低肝脏葡萄糖输出并改善胰岛素敏感性[6]。该研究在孕期对GDM小鼠分别使用胰岛素、格列本脲和二甲双胍进行干预,旨在探讨格列本脲、二甲双胍对GDM小鼠的治疗效果以及对小鼠产后1周和产后5周糖代谢的影响。
1 材料与方法
1.1 试剂和仪器链脲佐菌素(streptozotocin,STZ)、小鼠抗β-actin购自美国Sigma公司,STZ用柠檬酸-柠檬酸钠缓冲液溶解,配成浓度为1%的STZ溶液;盐酸二甲双胍肠溶片购自贵州圣济堂制药有限公司;格列本脲片购自天津太平洋制药有限公司;地特胰岛素注射液购自丹麦诺和诺德公司;兔Anti-AKT抗体、兔Anti- p-AKT(Thr308)、兔Anti- p-AKT(Ser473)、兔Anti- FoxO1、兔Anti- p-FoxO1、兔Anti- PEPCK购自CST公司;兔Anti-G6Pase购自Thermo Scientific公司;辣根过氧化物酶标记山羊抗兔IgG抗体、辣根过氧化物酶标记山羊抗小鼠IgG抗体购自北京中杉金桥生物有限公司。血糖仪、血糖试纸购自美国罗氏公司;凝胶扫描成像系统(Fine-do X6显影仪)购自上海天能科技有限公司。
1.2 实验动物及其处理从南京模式动物公司购买SPF级8周龄C57BL/6小鼠并按雌雄分类分别标记,其中雌鼠共100只,体质量为17~20 g,雄鼠共50只,体质量为20~24 g。试验前动物自由进食饮水。小鼠生活环境为12 h白/12 h黑暗的昼夜节律,动物房温度为(23±2)℃,相对湿度为(50±5)%。在上述环境适应1 周后,按2 ∶1雌雄合笼,第2天7:00对雌鼠进行阴栓检查。查到阴栓的那天定为GD0,认为小鼠怀孕。怀孕后雌鼠改喂繁殖饲料(江苏协同生物有限公司),雄鼠依然进食基础饲料。在GD6、GD7、GD8,怀孕雌鼠禁食8 h后,按40 mg/kg每天1次腹腔内注射配制好的STZ溶液,隔1 d后,使用尾针刺法测量小鼠空腹血糖,≥11.1 mmol/L则认为GDM模型成功。选取GDM模型小鼠64只,按照随机数字法分成4组(每组16只):糖尿病对照组(G)、糖尿病胰岛素组(GI)、糖尿病格列本脲组(GG)、糖尿病二甲双胍组(GM),另选16只正常健康的孕鼠做正常对照组(N)。在GD0、GD2、GD4、GD6、GD8、GD10、GD12、GD14、GD16、GD18(分娩前)检测小鼠体质量和空腹血糖水平。
1.3 药物干预对于GI组的动物,从GD11至GD18(分娩前)治疗,其由最初皮下注射7~10 U/kg地特胰岛素注射液,并根据需要增加剂量,以确保血糖控制在11.1 mmol/L以下。对GM组的小鼠,使用盐酸二甲双胍肠溶片,剂量为300 mg/kg,用生理盐水溶解,使用前用迷你振荡器混匀后,给小鼠灌胃。从GD11至GD18(分娩前)治疗,并且必要时每天增加剂量以确保血糖控制在11.1 mmol/L以下。对GG组的小鼠,使用格列本脲片,剂量为20 mg/kg,用生理盐水配制成混悬液(格列本脲不易溶于生理盐水),使用前用迷你振荡器混匀后,给小鼠灌胃。从GD11至GD18(分娩前)治疗,并根据需要增加剂量,以确保血糖控制在11.1 mmol/L以下。
1.4 实验动物干预后处理在GD18时,通过腹膜内注射戊巴比妥钠,每组随机选取8只孕鼠实施安乐死,立即收集肝组织,用液氮快速冷冻固定后储存于-80 ℃冰箱待用。每组剩余的8只孕鼠继续饲养,直到自然分娩。每周测量1次小鼠体质量和空腹血糖水平。在产后1周和5周,对自然分娩的母鼠施行葡萄糖耐量实验(glucose tolerance test,GTT)、胰岛素耐量实验(insulin tolerance test,ITT)。具体而言,禁食8 h后,通过向腹腔内注射葡萄糖(2 mg/g)进行GTT,并使用血糖仪在注射之前和0.5、1、1.5、2、2.5 h之后通过尾部血液测量血糖浓度。通过将人胰岛素(0.65 mU/g)注射到腹腔内,对禁食4 h的小鼠进行ITT,并在注射之前和20、40、60、80、100、120 min之后通过尾部血液测量血糖浓度。然后在产后5周将母鼠安乐死,立即收集肝组织。肝组织用液氮快速冷冻固定后储存于-80 ℃冰箱待用。本研究经安徽医科大学动物伦理委员会批准,按照安徽医科大学动物实验规范进行。
1.5 Western blot检测肝脏组织AKT、FoxO1、p-AKT、p-FoxO1、G6Pase、PEPCK的表达准确称取50 mg肝脏组织,裂解后匀浆取上清液,BCA法进行蛋白定量。SDS-PAGE凝胶电泳分离目的蛋白,使用PVDF膜转膜,一抗(小鼠抗β-actin、兔Anti-AKT抗体、兔Anti- p-AKT(Thr308)、兔Anti- p-AKT(Ser473)、兔Anti- FoxO1、兔Anti- p-FoxO1、兔Anti- PEPCK、兔Anti-G6Pase)室温孵育2 h 或者4 ℃孵育过夜,二抗室温孵育50 min。显影A、B液1 ∶1配置后滴至PVDF膜,放入显影仪中进行显影。各条带进行灰度扫描,对各灰度值进行统计分析。

2 结果
2.1 格列本脲和二甲双胍对GDM小鼠体质量、血糖的影响GDM造模成功的4组小鼠均表现出各种GDM症状,多食多尿(表现在食物、饮水消耗较快,垫料浸湿也较快)且体质量较轻。而N组则生长状态良好。由图1A可见,4组GDM模型小鼠的体质量均比N组小鼠的体质量低(F=18.65,P<0.01)。与G组相比,GI、GG、GM组小鼠的体质量均有增加。如图1B所示,GDM造模成功的4组小鼠的空腹血糖水平在GD10左右达到最大值,在G11开始使用胰岛素、格列本脲和二甲双胍药物干预后,GI、GG、GM组小鼠的空腹血糖水平都表现出了不同程度的下降。与N组相比,G组小鼠的空腹血糖水平从GD8开始升高,为(8.58±0.48)mmol/L,在GD18达到高峰,为(29.60±0.71)mmol/L。与G组比较,GI组、GG组、GM组小鼠的血糖水平在用药后均有降低,差异有统计学意义(F=419.20,P<0.01)。
2.2 格列本脲和二甲双胍对GDM小鼠肝脏中相关蛋白的影响与G组相比,GI、GG和GM组分别采用胰岛素、格列本脲和二甲双胍3种干预措施,AKT活性增强(p-AKT473和p-AKT308),达到N组水平,差异有统计学意义(F=42.66,P<0.01;F=27.53,P<0.01)。见图2A。与G组相比,GI、GG和GM组p-FoxO1与FoxO1的比值升高,差异有统计学意义(F=105.60,P<0.01)。见图2B。Western blot显示,GDM模型小鼠的肝脏中G6Pase和PEPCK蛋白水平增加。而与G组相比,GI、GG和GM组均显示G6Pase和PEPCK蛋白含量降低,差异有统计学意义(F=57.40,P<0.01;F=21.91,P<0.01)。见图2C。
2.3 格列本脲和二甲双胍对产后0~5周母鼠体质量、血糖的影响与N组相比,G组的小鼠体质量降低,而GI、GG和GM组的小鼠体质量减轻得到了缓解(F=19.73,P<0.05)。见图3A。与N组相比,GDM模型小鼠的空腹血糖水平增加(F=630.10,P<0.01)。见图3B。表明经过干预GDM模型小鼠从产后1周开始血糖水平急剧上升,最终在产后4~5周之后达到与未处理的G组小鼠相同的水平。
2.4 格列本脲和二甲双胍对产后1周母鼠GTT、ITT的影响GTT和ITT中,GDM小鼠表现出了葡萄糖耐受不良和胰岛素抵抗。见图4A、B。与N组小鼠相比,在G组中观察到GTT和ITT中更高的血浆葡萄糖浓度-时间曲线(曲线下面积,area under the curve,AUC)。随后的胰岛素、格列本脲和二甲双胍治疗分别使GI、GG、GM组中的GTT和ITT的AUC值降低(F=278.40,P<0.01;F=642.10,P<0.01)。见图4A、B。

图1 GDM小鼠体质量和血糖的变化
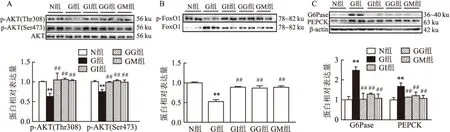
图2 格列本脲和二甲双胍分别干预后GDM小鼠肝脏中各蛋白的水平
A:p-AKT308/AKT和p-AKT473/AKT;B:p-FoxO1/FoxO1;C:G6Pase/β-actin和PEPCK/β-actin ;与N组比较:**P<0.01;与G组比较:##P<0.01

图3 产后母鼠体质量和血糖的变化
2.5 格列本脲和二甲双胍对产后5周母鼠GTT、ITT的影响在GTT中,与N组小鼠相比,G、GI、GG、GM组中均观察到更高的AUC,差异有统计学意义(F=339.30,P<0.01)。见图5A。与N组小鼠相比,在G、GI、GG、GM组中均观察到ITT中更高的AUC,差异有统计学意义(F=105.90,P<0.01)。见图5B。

图4 孕期格列本脲和二甲双胍分别干预对产后1周母鼠GTT、ITT的影响

图5 孕期格列本脲和二甲双胍分别干预对产后5周母鼠GTT、ITT的影响
A:p-AKT308/AKT和p-AKT473/AKT;B:p-FoxO1/FoxO1;C:G6Pase/β-actin和PEPCK/β-actin;与N组比较:**P<0.01;与G组比较:##P<0.01; 与GG组比较:$$P<0.01
2.6 格列本脲和二甲双胍对产后5周母鼠肝脏中相关蛋白的影响与G组相比,产后5周的GI、GG和GM组AKT活性(p-AKT473和p-AKT308)没有变化,低于N组,差异有统计学意义(F=135.20,P<0.01;F=109.60,P<0.01)。见图6A。另外,FoxO1的活性没有变化,低于N组,差异有统计学意义(F=37.79,P<0.01)。见图6B。这些结果与图2A、2B中显示的改善完全相反。与图2C相比,GI、GG和GM组分别在产后5周时,G6Pase和PEPCK回到与未干预的GDM对照小鼠相同的水平,高于 N组,差异有统计学意义(F=55.80,P<0.01;F=100.60,P<0.01)。见图6C。
3 讨论
在本研究中,GDM小鼠模型是从GD8开始表现出血糖浓度的升高,模拟了在怀孕期间,人类从妊娠中期开始发生的GDM。此外,虽然本研究的GDM模型是由低剂量STZ诱导的,一些学者认为它对胰腺β细胞有毒性[7],但是本研究中GDM小鼠的高血糖症可以被格列本脲(胰岛素分泌增强剂)改善,这表明GDM小鼠模型的胰岛素分泌功能良好,未被破坏。
本研究显示格列本脲和二甲双胍在维持怀孕期间小鼠的空腹血糖稳定方面与胰岛素一样有效,这些结果与人群研究是一致的[8-9]。本研究表明,在怀孕期间,经二甲双胍、格列本脲分别干预的GDM小鼠的肝组织中的蛋白质水平恢复到正常水平,例如p-AKT308 (Thr308)、p-AKT473 (Ser473)、p-FoxO1、G6Pase和PEPCK。AKT磷酸化变为p-AKT即为AKT的激活,AKT的激活是调节肌肉、脂肪细胞、肝脏中糖原合成和抑制糖异生所必需的[10]。本研究中干预组小鼠p-AKT308 (Thr308)、p-AKT473 (Ser473)的增加,证实了格列本脲或二甲双胍可以通过增加AKT的激活,进而抑制糖原合成酶。高血糖是肝脏葡萄糖输出增加和糖尿病患者外周葡萄糖利用率降低的结果,PEPCK和G6Pase是参与调节肝脏糖异生的两种关键酶[11],而FoxO1可以调节PEPCK和G6Pase的活性[12]。用格列本脲或二甲双胍治疗减弱了GDM小鼠肝脏中PEPCK和G6Pase的表达的异常升高,这说明格列本脲或二甲双胍的干预抑制了PEPCK和G6Pase的表达,进而抑制糖异生。
葡萄糖刺激胰腺分泌胰岛素,从而提高血糖的利用率。然而,GDM小鼠对胰岛素不敏感,导致了对葡萄糖的利用下降,因此它们的血糖水平仍然较高。糖尿病小鼠葡萄糖耐量降低可能导致GTT血糖水平较高,胰岛素敏感性降低可能导致ITT血糖水平较高[13]。因此,GTT广泛应用于评估葡萄糖耐量,而 ITT则广泛应用于评估胰岛素敏感性[14]。母鼠产后1周,观察到格列本脲和二甲双胍干预组GTT和ITT中的AUC比G组低,这说明在产后1周格列本脲和二甲双胍对母鼠葡萄糖耐受、胰岛素抵抗的改善仍持续存在;对于产后5周的小鼠,格列本脲和二甲双胍对GDM小鼠的干预效果消失,GTT和ITT的曲线趋势与GDM对照组一致,这说明母鼠发生了葡萄糖耐量降低和胰岛素敏感性降低。并且与G组相比,GDM治疗组产后5周母鼠肝组织中p-AKT473、p-AKT308、p-FoxO1、G6Pase和PEPCK蛋白水平均没有变化。以上指标均显示,干预组的小鼠在产后5周都表现出2型糖尿病小鼠所具有的糖代谢特征。这表明虽然格列本脲或二甲双胍可以改善GDM小鼠在妊娠期和产后短期的糖代谢异常,但不能降低GDM小鼠在产后发展为2型糖尿病的风险。
综上所述,GDM不仅会引起小鼠孕期的葡萄糖耐量降低和胰岛素抵抗,而且会对小鼠产后的葡萄糖代谢产生强烈影响。而妊娠期间格列本脲或二甲双胍的干预可通过改善妊娠期和产后1周的GDM小鼠肝脏中的胰岛素敏感性来改善葡萄糖代谢,但不能改善产后5周小鼠的胰岛素抵抗和葡萄糖代谢。
