不稳定型心绞痛患者血尿酸水平与血管内超声的相关性
2020-02-12吕何锦黄美兴刘震李韶南
吕何锦 黄美兴 刘震 李韶南
(1广州中医药大学第一附属医院心血管内科,广东 广州 510405;2广州市中西医结合医院病理科;3广州市第一人民医院心血管内科)
不稳定型心绞痛(UA)是冠状动脉粥样硬化斑块破裂或冠状动脉痉挛,导致局部心肌供血急剧减少,造成心肌缺血缺氧引起疼痛症状的临床常见疾病,病情变化快,呈进行性恶化趋势等特点〔1〕。高血尿酸(SUA)是心血管疾病的危险因素,并且引起UA患者的死亡风险增加〔2〕。而既往研究中对UA患者SUA水平与冠状动脉血管内超声(IVUS)的相关性分析尚缺乏。本研究旨在探讨UA患者SUA水平与冠脉IVUS的相关性。
1 资料与方法
1.1一般资料 从2015年5月至2018年5月在广州市第一人民医院心血管内科住院患者中,连续筛选出187例冠心病(CAD)患者,入选标准:结合2007年《冠心病诊断与治疗指南》,入选本研究的患者需符合以下条件。患者有胸部不适感和(或)心电图证实有心肌缺血,且冠状动脉造影(CAG)存在左主干(LM)、左前降支(LAD)、左回旋支(LCX)、右冠状动脉(RCA)4支血管中至少有一支冠状动脉血管直径狭窄≥50%的病变。其中男133例,女54例,年龄(65.43±9.82)岁,并依据患者心绞痛的症状特点、心肌酶谱、心电图及CAG结果,分成UA组患者133例,男97例,女36例,年龄(65.79±10.04)岁。稳定型心绞痛(SAP)组患者54例,男39例,女15例,年龄(64.53±10.56)岁;选取同一时间段内在广州市第一人民医院心血管内科住院的非CAD患者50例作为对照组,其中男23例,女27例;年龄(59.08±11.38)岁。排除标准:①严重肝、肾功能不全〔谷丙转氨酶(ALT)>150 U/L、肌酐(Cr)>265 mmol/L〕;②遗传性酶缺陷,黄嘌呤氧化酶及嘌呤核苷酸化酶先天性缺陷;③自身免疫性疾患,曾经或目前正用免疫调节剂;④风湿性疾病;⑤痛风、痛风性关节炎、口服利尿剂、干扰尿酸生成或排泄药物;⑥近期食用海鲜、豆类制品及嗜酒等。
1.2方法
1.2.1采集标本 入院第二天早晨,所有入选患者在清醒、静息、空腹状态下,使用静脉采血针穿刺肘静脉,EDTA-K2抗凝管留取血液标本3 ml,送至广州市第一人民医院检验科。
1.2.2SUA检测 研究对象均在入院次日早晨空腹进行静脉采血3 ml,使用BECKMAN COULTER AU5800全自动生化分析仪进行分析,用尿酸酶-过氧化物酶法检测SUA。
1.2.3选择性CAG 全部入选患者穿刺动脉均为桡动脉(右桡动脉为主)或股动脉。CAG前需在常规手术区域进行皮肤准备、镇静;穿刺动脉前需做Allen试验检查,Allen试验阳性者则穿刺股动脉,Allen试验阴性则穿刺桡动脉;术中用利多卡因局麻,使用Seldinger法穿刺桡动脉或股动脉,穿刺成功后用TIG或Judkins造影管在普通导丝作用下分别衔接左冠状动脉、RCA,常规选择左肩位、右肩位、蜘蛛位、肝位、头位、足位、左前斜位等体位中4~6个体位,行选择性CAG,并判断、记录冠状动脉病变部位及狭窄严重程度;根据2016年《中国经皮冠状动脉介入治疗指南》〔3〕,LM、LAD、LCX、RCA 4条主要冠状动脉血管,存在任意一条冠状动脉病变狭窄直径≥50%,即CAD诊断明确。
1.2.4IVUS检查 罪犯病变部位的血管采用由美国 Boston Scientific公司产的IVUS仪进行操作,IVUS探头频率为40 MHz,3.2 F。将血管内置入0.014英寸(0.355 6 mm)导引钢丝,将0.2 mg硝酸甘油常规注入冠状动脉内,不锈钢冠状动脉导丝送入待检查的血管并沿导丝送入超声导管,然后缓慢从血管远端往近端连续撤回,速度为0.5 mm/s,回撤到血管起始部即终止。测量罪犯病变血管的外弹力膜横截面积、管腔面积、斑块面积及斑块负荷。
1.3统计方法 采用SPSS22.0软件行t检验,方差分析,Pearson相关分析,χ2检验。
2 结 果
2.1各组一般资料比较 比较各组性别、年龄、高血压、糖尿病、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平有统计学差异(P<0.05),而各组间患者的吸烟、CAD家族史、体重指数、估算肾小球滤过率、D-二聚体、超敏C反应蛋白(hs-CRP)、N端脑利钠肽前体(NT-proBNP)、总胆固醇(TC)水平无统计学差异(P>0.05)。见表1。
2.23组SUA水平比较 UA组SUA水平〔(514.41±74.21)μmol/L〕明显高于对照组〔(387.30±80.00)μmol/L〕、SAP组〔(393.34±73.28)μmol/L,F=79.35,P=0.001〕,且SAP组明显高于对照组(P<0.05)。
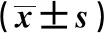
表1 各组一般资料比较
2.3SAP组与UA组IVUS测量指标比较 UA组管腔面积、斑块面积、斑块负荷均明显高于SAP组(P<0.05)。见表2。
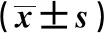
表2 SAP组与UA组IVUS测量指标比较
2.4UA患者SUA水平与IVUS测量指标相关性 UA患者SUA与IVUS检查指标斑块面积、斑块负荷均呈正相关(r=0.368、0.479,均P=0.001),与管腔面积无明显相关性(r=0.110,P=0.208)。
3 讨 论
UA是由于冠状动脉粥样硬化,在各种炎症物质作用下,冠状动脉斑块溃疡、破裂或冠脉痉挛,因而引起病变冠状动脉非完全性堵塞。有研究表明,高尿酸血症可能与冠状动脉易损斑块相关〔4,5〕。本研究提示UA病变处斑块更不稳定、更易发生破裂。
自从冠状动脉病变与高尿酸血症之间的相关性首次被Gentler等〔6〕发现后,CAD与高尿酸血症的关系逐渐引起各研究者的关注与研究。很多研究表明高尿酸水平与CAD发生、发展呈正相关〔7,8〕,并且随着血尿酸水平越来越高,冠状动脉病变狭窄程度及累计冠状动脉血管数目的也随之增加,说明高尿酸是预测冠状动脉病变程度的重要指标。高尿酸血症可能通过如下机制参与CAD的发生、发展过程:①损害微循环血管内皮:尿酸盐形成结晶后,容易沉着在血管壁上,损害血管内皮;同时,它还可以引起血管平滑肌细胞的增生并抑制内皮细胞的再生,减少内皮细胞一氧化氮的产生等。②高尿酸血症会引起血小板的活化、黏附和聚集的能力增加,增高血液黏度,从而使血液易于形成血栓,加快动脉粥样硬化斑块的破裂。③细胞内信号传导途径可被高尿酸水平激活,产生更多细胞因子和多种炎性介质,并促进人体的炎性反应。④高尿酸血症可增加LDL氧化,也能促进脂质过氧化,干扰体内脂质代谢,引起氧自由基生成增加,损害血管内皮细胞,加快血管平滑肌细胞凋亡〔9,10〕。
既往对83 686例澳大利亚男性患者进行队列追踪性研究,研究表明高尿酸水平与CAD的死亡率有着独立关系,且高尿酸水平与心血管病死亡率也具有独立而显著的相关性〔4〕。SUA水平高于7 mg/dl与增加的心血管病死亡率相关,同时SUA水平高于7.5 mg/dl已被证实对已接受经皮冠状动脉介入(PCI)治疗的急性冠脉综合征患者死亡率有增加的风险〔11〕。横断面研究982例可疑患有冠心病的土耳其患者均进行CAG,结果显示SUA水平与冠状动脉病变处狭窄程度呈正相关。还有研究显示高尿酸水平与受损内皮中介舒张具有相关性〔12〕。同时高尿酸水平与充血性心力衰竭的恶化也具有明显相关性〔13〕。
本研究发现血SUA与IVUS评价斑块稳定性的指标密切相关,SUA水平与斑块面积、斑块负荷呈正相关,有利于鉴别UA患者的冠状动脉靶血管处斑块稳定性,同时可在一定程度上通过靶血管处斑块稳定性预测患者临床危险性。同时积极干预降低SUA水平对UA患者的防治可能存在较为重要的意义。本研究是一个单中心小样本研究,尚需多中心大样本研究加以证实。另外,本研究仅对冠状动脉罪犯血管靶斑块进行IVUS检查,未对斑块行虚拟组织学-血管内超声(VH-IVUS),无法对斑块成分进行准确地分辨,从而准确判断其是否稳定。同时位于非最狭窄处血管的斑块可能会影响血清SUA的浓度,使结果存在一定程度的偏倚。
