ILT3在冠心病患者外周血单核细胞的表达及意义
2020-02-12刘晓峰陈玲廖然殷锡虎汪光枝
刘晓峰 陈玲 廖然 殷锡虎 汪光枝
(九江市第一人民医院 南昌大学附属九江医院心血管内科,江西 九江 332000)
冠心病的严重程度由斑块的稳定性决定,炎症免疫反应在斑块稳定性中发挥重要作用〔1〕。研究表明免疫调节失衡在不稳定斑块的发生中发挥重要作用,其中T淋巴细胞参与动脉粥样硬化相关抗原的应答反应,促进动脉粥样斑块的发生和进展〔2〕。最新研究发现自身免疫在冠心病中可能发挥着重要作用〔3〕。树突细胞(DC)是目前发现的机体内功能最强的专职抗原提呈细胞,极少量的DC即可强烈激活T淋巴细胞启动特异性细胞免疫反应〔4〕。T淋巴细胞的激活可能在冠状动脉粥样硬化起始和斑块的稳定性中起重要作用〔5〕。免疫球蛋白样转录子(ILT)3,属于抑制性受体,可表达于DC和T淋巴细胞表面,在免疫反应中发挥重要作用〔6〕。研究发现在急性冠脉综合征(ACS)患者的破裂斑块中和外周循环血均可检测到异常增殖的T细胞〔7〕。本研究首先检测冠心病患者外周血单个核细胞(PBMC)中ILT3的表达,再通过在体外建立混合淋巴细胞反应(MIR),进一步探讨ILT3参与冠心病发生发展的免疫机制。
1 对象与方法
1.1研究对象 选择2014年1月至2017年12月九江市第一人民心血管内科心内科住院冠心病患者100例,所有患者依据病史、心绞痛症状、心电图、心肌酶学检查结果分为:稳定性心绞痛(SAP)组45例,男25例,女20例,年龄(61±10)岁;ACS组55例,男43例,女12例,年龄(56±8)岁。所有患者经冠状动脉造影检查证实。排除标准:合并急慢性感染、胶原结缔组织病、血液系统疾病、自身免疫性疾病、周围血管病、恶性肿瘤、进展期肝肾病者;服用免疫抑制剂、非甾体类炎症抑制剂等药物。本研究获得九江市第一人民医院医学伦理委员会批准,所有入选者签署知情同意书。两组年龄及性别差异无统计学意义(P>0.05)。
1.2研究方法
1.2.1PBMC的分离 采用Ficon密度梯度离心法:所有患者在入院24 h内,在无菌条件下,空腹抽取乙二胺四乙酸(EDTA)抗凝血10 ml用RPMI1640 1∶1培养稀释到20 ml,用毛细滴管插到云雾层,全部吸取单个核细胞(避免吸出分层液),置入另一离心管中,然后加入5倍以上体积的RPMI1640液,1 500 r/min×10 min,洗涤细胞两次,获得PBMC。
1.2.2外周血DC分离和体外培养 在无菌条件下,用37℃无血清的RPMI1640液体培养基充分吹打上述分离得到的PBMC,使成均匀细胞悬液,用浓度为50 ng/ml的重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)和50 ng/ml的重组人白细胞介素(rhIL)-4,37℃、5%CO2条件下培养5 d。第6天加入白细胞介素(IL)-1β(10 ng/ml),肿瘤坏死因子(TNF)-α(50 ng/ml)和Toll样受体配体polyⅠ:C(20 μg/ml),均购自美国Sigma公司。继续培养2 d,第8天收获悬浮细胞,显微镜下鉴定。
1.2.3应用MACS 免疫磁珠阴性分选得CD4+T淋巴细胞 采用Ficon密度梯度离心法分离脐带血获得的PBMC,用RPMI1640 1∶1培养稀释到10 ml,采用应用MACS 免疫磁珠阴性分选,将分选获得的CD4+T淋巴细胞置于含有10%胎牛血清的RPMI1640完全培养液中,调整细胞浓度在1×106/ml,备用。提取的CD4+T调节性T细胞以流式细胞仪行纯度检测。
1.2.4细胞因子检测 各组分离培养的DC和脐血分离的CD4+T细胞混合培养。4 d后,收集细胞培养上清,利用酶联免疫吸附试验(ELISA)试剂盒检测干扰素(IFN)-γ、TNF-β和IL-10细胞因子水平,在酶标仪上,于450 nm波长处检测光密度(D)值。用流式细胞仪检测CD4+CD25+T淋巴细胞的百分比,实验重复3次。
1.2.5流式细胞术检测样品 上述分离纯化的细胞用10%FBS RPMI1640调整细胞浓度为1×106/ml,取细胞悬液100 μl,分别加入6 μl CD4-PE、6 μl ILT3-FITC抗体,混合反应后,操作同前,上流式细胞仪检测;然后获取条件分别为CD4-PE、CDILT3-FITC阳性。依次收集标本,收集细胞数至少5 000个细胞,分析荧光强度,数据存盘,测试结束后在计算机上用CellQustPlot软件进行数据分析,计算获得细胞百分数表示。
1.3统计学方法 应用SPSS17.0软件进行t及χ2检验。
2 结 果
2.1ILT3在两组PBMC的表达 SAP组PBMC的ILT3 阳性率为〔(80.13±2.10)%〕,显著高于ACS组〔(1.83±0.91)%,P<0.01〕。
2.2两组CD4+CD25+T淋巴细胞百分比比较 SAP组CD4+CD25+T淋巴细胞数量百分比为〔(89.2±2.3)%〕,较ACS组〔(39.5±5.3)%〕明显升高,差异有统计学意义(P<0.01)。
2.3两组细胞因子水平比较 ACS组IFN-γ和TNF-β水平比SAP组明显升高,IL-10水平在SAP组比ACS组有明显升高,差异有统计学意义(P<0.01),见表1。
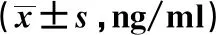
表1 两组细胞因子水平比较
与SAP组比较:1)P<0.01
3 讨 论
研究表明,炎症免疫反应参与动脉粥样硬化的发生、发展以致易损斑块和血栓的形成〔8〕。其中T细胞参与的免疫激活在冠脉斑块破裂中起主导作用〔9〕。急性冠状动脉综合征(ACS)的发生中,冠状动脉易损斑块的形成可能是T细胞介导的一种免疫失衡性疾病〔10〕。研究表明,在机体免疫耐受的产生和维持中起重要作用的CD4+CD25+T调节细胞,通过负向调节来抑制自身反应性T细胞的作用,发挥免疫耐受,减少炎症免疫性疾病的发生〔11〕。尽管目前尚未将动脉粥样硬化归类于自身免疫性疾病。但有动物实验研究显示CD4+CD25+T调节细胞能够增加斑块的稳定性〔12〕。研究已经表明CD4+CD28-T淋巴细胞能够直接溶解内皮细胞及平滑肌细胞,而导致斑块破裂〔13〕,与CD4+CD28-T细胞亚群作用相反,CD4+CD25+T是最近研究发现的调节性T细胞亚群之一,参与调节与冠状动脉斑块的稳定性〔2〕。ILT3可表达于DC表面,传导抑制性信号,抑制杀伤性NK 细胞的活性,参与细胞抗原俘获、抑制细胞炎症免疫作用〔14〕。 有研究表明,高表达ILT3的DC细胞可抑制T淋巴细胞的增殖与活化〔15〕。ILT3可通过抑制DC的共刺激分子的表达,同时诱导CD4+T细胞转化为CD4+CD25+T的调节性T细胞〔16〕。本研究结果显示PBMC中ILT3表达的变化参与冠心病的发生发展中。
将抗原特异性CD4+CD25+T淋巴细胞输入小鼠观察到其可抑制动脉粥样硬化的发展,说明CD4+CD25+T淋巴具有负向调节动脉粥样硬化炎症反应的作用〔17〕。急性心肌梗死患者CD4+CD25+T淋巴细胞表达百分比与正常对照组相比会降低,这表明可能在冠状动脉粥样斑块活动或破裂过程中发挥重要作用〔18〕。本研究推断CD4+CD25+T淋巴细胞对维持动脉粥样硬化患者斑块的稳定性发挥重要作用且与ILT3高表达相关。
抗原提呈细胞是启动免疫应答的起始环节,DC是目前发现的机体内功能最强的专职抗原提呈细胞,最近发现在冠状动脉粥样硬化斑块中DC增多〔19〕。成熟的DC可分泌多种细胞因子,参与T淋巴细胞的增殖和免疫调节功能〔20〕。本研究提示高表达ILT3的DC释放IL-10而稳定斑块。
