急性ST段抬高型心肌梗死患者发生心脏破裂的风险预测模型构建及验证
2020-02-12迪力夏提吾布力田桃张兴达任航曹梦雨王祥马凯高明丰小星郑杨
迪力夏提·吾布力 田桃 张兴达 任航 曹梦雨 王祥 马凯 高明 丰小星 郑杨
(1吉林大学第一医院心血管诊疗中心,吉林 长春 130021;2新疆医科大学第一附属医院心脏中心)
心脏破裂(CR)是急性ST段抬高型心肌梗死(STEMI)严重而并不少见的并发症之一,其包括左室游离壁破裂、室间隔穿孔和乳头肌断裂,通常发生在急性期后的前2 w内,发病急,病死率极高,预后极差〔1〕。随着再灌注治疗的普及,STEMI合并CR的比例呈逐年下降趋势〔2〕,其发生率为1%~3%,明显高于其他类型的急性冠脉综合征患者〔3〕。随着医疗技术的提高,其病死率由之前的94%下降至75%〔2〕,但CR仍然是STEMI患者住院期间主要死亡原因之一,一般抢救措施通常无效〔4〕,而且药物保守治疗病死率高、预后差,外科手术治疗更是面临手术难度高、早期病死率高的挑战〔5〕。因此通过早期风险评估,积极采取预防措施,尽可能防止CR显得尤为重要〔6〕。基于目前国内外研究,年龄、女性、入院时心率、收缩压、白细胞水平、血红蛋白、左前降支病变等因素是STEMI患者发生CR的独立危险因素,再灌注治疗、β受体阻滞剂、血管紧张素转换酶抑制剂(ACEI)、血管紧张素受体拮抗剂(ARB)等治疗能明显降低CR的发生〔2~4,7,8〕。尽管对于STEMI患者发生CR的危险因素、保护因素研究较多,但在临床实践中,用于STEMI患者CR风险预测模型极为有限〔6〕。因此,本研究通过回顾性临床研究,分析患者临床资料,拟建立STEMI患者发生CR的风险预测模型,为STEMI患者CR的早期预警及合理分配医疗资源提供参考依据。
1 资料与方法
1.1研究对象 从吉林大学第一医院心血管中心数据库中连续入选2013年1月1日至2018年6月30日的STEMI患者共9 053例,其中确诊为CR的患者167例为破裂组,在未发生CR的8 886例STEMI患者中,按5%的比例系统抽样随机抽取450例患者为对照组,分别从破裂组和对照组中按7∶3系统抽样随机分为建模组(破裂117例,未破裂315例)和验证组(破裂50例,未破裂135例)。
1.2入选标准 ①STEMI符合ESC心肌梗死的第三次通用定义〔9〕关于STEMI的诊断标准。②CR的诊断:游离壁破裂诊断标准:出现心包填塞的症状和体征,超声心动图提示新出现的心包填塞,心包穿刺可抽出不可凝固血;乳头肌断裂诊断标准:心尖部出现响亮、粗糙收缩期杂音,向腋部传导,超声心动图可见二尖瓣大量反流或直接观察到乳头肌断裂;室间隔穿孔诊断标准:胸骨左缘4~5肋间出现粗糙的全收缩期杂音,伴收缩期震颤,超声心动图可见穿过室间隔的血流束。值得强调的是医院心血管中心对于所有突发意识不清、心源性休克、抢救患者行即刻床旁心脏彩超,确保了CR诊断的准确性和及时性〔10〕。超声心动图诊断均由2名及以上经过正规培训并获得资格的临床医师诊断。
1.3资料收集 从数据库中选取入院数小时即能获得的临床资料,包括年龄、性别、发病时间、心肌梗死部位、既往史、生命体征、入院时Killip分级、血常规、血肌酐、血尿素氮、离子、随机血糖、尿常规、凝血常规、初始心肌损伤标志物、D-二聚体、脑钠肽(BNP)/N末端脑钠肽前体(NT-pro-BNP)及是否行直接PCI治疗等资料。
1.4统计学分析 采用SPSS20.0软件进行统计分析,正态分布的计量资料采用t检验、秩和检验、χ2检验。对各潜在危险因素进行单因素分析,P<0.05为差异有统计学意义。通过二元Logistic回归分析建立风险预测模型(向前进入法),检验水准P<0.05;在确定风险预测模型后,根据各危险因素的β值建立CR发生风险的评分标准:β值最低者评分为1分,其他因素的基础评分为该因素的除值(取整数),得到相应权重,根据评分标准对建模组患者进行评分,根据评分最佳约登指数选取评分临界值。模型建立后,模型的拟合优度采用Hosmer-Lemeshow 检验,P>0.05为校准度较好;鉴别效度采用受试者工作特征(ROC)曲线下面积(AUC),以AUC大于0.7为鉴别效度较好,并在内部数据进行验证,采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1CR患者基线资料 在本研究中共167例STEMI患者发生CR,其中左室游离壁破裂130例(其中同时合并室间隔穿孔 3例、乳头肌断裂 1例)、室间隔穿孔 35例、乳头肌断裂2例。其中女性87例,男性80例。平均年龄(69.54±9.977)岁。前壁心肌梗死109例(其中同时含有下壁心肌梗死10例,同时合并侧壁心肌梗死5例),下壁心肌梗死53例(同时合并侧壁心肌梗死2例),侧壁心肌梗死5例。共27例在出现CR前存在明确诱因(8例出现恶心呕吐,7例剧烈胸痛,6例出现情绪激动,6例在大小便后出现CR)。
2.2建模组中两组患者基础资料的单因素分析结果 年龄、性别、脑卒中病史、初始心肌损伤标志物、入院时Killip分级、白细胞计数、随机血糖、GRACE评分及未行直接经皮冠状动脉介入术(PCI)等19个变量差异有统计学意义(P<0.05),见表1。
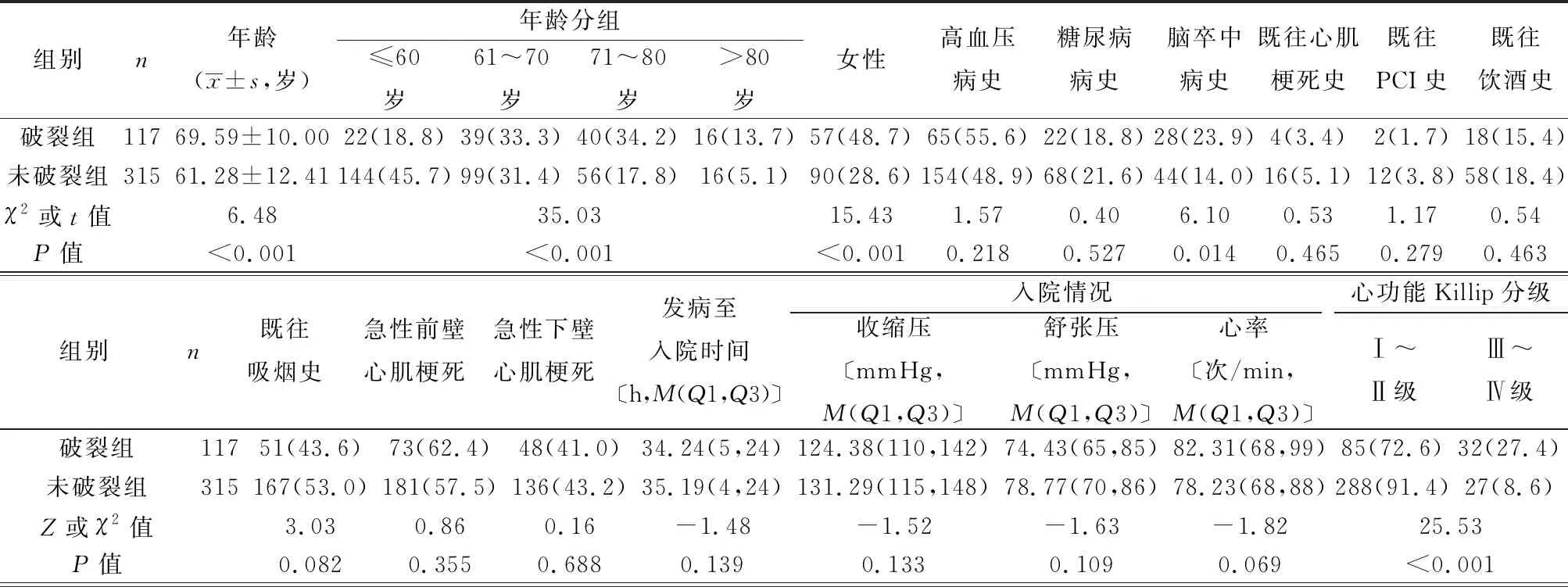
表1 建模组中STEMI患者院内破裂组和未破裂组临床资料比较〔n(%)〕

续表1 建模组中STEMI患者院内破裂组和未破裂组临床资料比较〔n(%)〕
2.3风险预测模型的建立 将单因素分析筛选出的变量进行二元Logistic回归分析并建立风险预测模型,最终筛选出5个STEMI后并发CR发生的独立危险因素,根据其β值,按照相关性从小到大依次为:既往有脑卒中病史(包括缺血性及出血性)、女性、年龄(按照每10岁为界,分为≤60岁、61~70岁、71~80岁、>80岁四组)、此次入院未行直接PCI及入院时Killip分级Ⅲ~Ⅳ级(表2)。

表2 建模组中STEMI患者院内心脏破裂危险因素的Logistic回归分析
2.4风险评分标准的构建 根据已建立预测模型中各危险因素的β值及其变量类型建立CR发生风险的评分标准,既往有脑卒中病史为1分,女性为1分,年龄(61~70岁为1分,71~80岁为2分,>80岁为3分),此次入院未行直接PCI术为2分,入院时Killip分级Ⅲ~Ⅳ级为2分,根据设定的评分标准对所有患者进行评分,根据评分最佳约登指数选取评分临界值,可将患者划分为低风险组(0~3分)、高风险组(4~9分)两组。
2.5风险预测模型的验证 将上述建立的风险预测模型,采用AUC及Hosmer-Lemeshow 检验检测模型鉴别效度和校准度,建模组中,AUC (0.771,95%CI:0.723~0.819),Hosmer-Lemeshow 检验(P=0.393)。根据评分可以将患者划分为低风险组(0~3分)和高风险组(4~9分)两组。在CR患者中,低风险组患者明显少于高风险组(29.9%vs 70.1%,P<0.001),差异有统计学意义。内部验证组中,AUC (0.758,95%CI:0.682~0.835),Hosmer-Lemeshow 检验(P=0.669),结果显示该模型有较好的对CR的预测价值。
2.6本评分模型与既往CR风险评分模型比较 Qian等〔6〕通过年龄、性别、心率、心肌梗死部位、血红蛋白数量、白细胞计数及入院时间等7个变量建立了STEMI患者预测CR的风险评分模型,与此模型相比,本研究5个变量更为简易,并能迅速获得,且对年龄进一步细分,更加符合建立预测模型要求〔11〕,在建模组和验证组总数据中,本研究评分AUC大于Qian等〔6〕人的CR风险模型(0.761 vs 0.680),因此在临床实际运用中,本研究模型在STEMI患者中预测CR更有优势。见表3、图1。
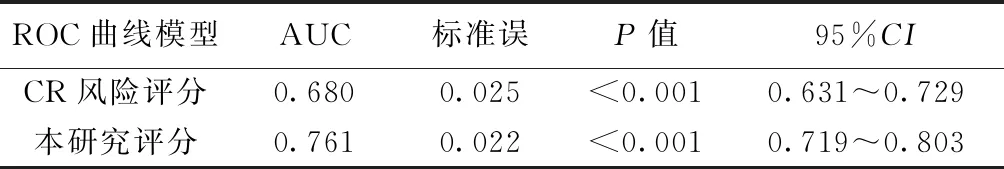
表3 CR风险评分与本研究评分对STEMI患者发生CR的预测价值比较
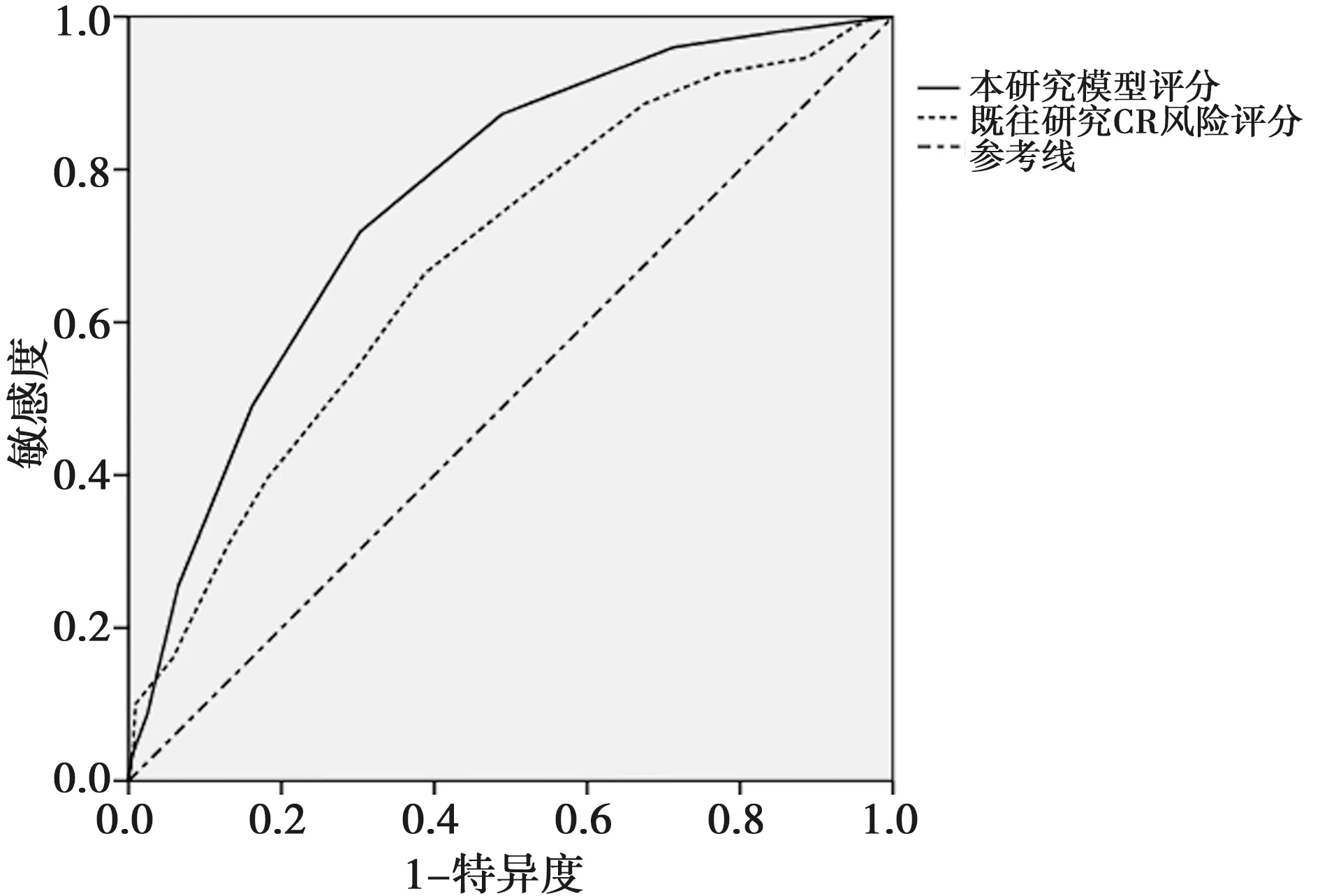
图1 CR风险评分与评分的AUC比较
3 讨 论
CR是STEMI患者致死性并发症之一,是STEMI患者住院后早期死亡的第三大原因,仅次于心源性休克和充血性心力衰竭〔12〕。其发生机制可能与心肌细胞凋亡与坏死、炎症损伤、胶原降解、再灌注损伤等有关〔13,14〕。若其一旦发生,治疗比较棘手,因此对于STEMI患者早期危险分层、合理地给予干预措施、预防CR的发生显得尤为重要。本研究通过回顾性病例对照研究,得出了既往脑卒中病史、女性、年龄、此次入院未行直接PCI、入院时Killip分级Ⅲ~Ⅳ级等5个变量是STEMI发生CR的独立危险因素,且建立了简易的评分模型用于早期预测STEMI患者CR的风险,为临床上此类患者的危险分层提供依据。
在本研究中1.84%(167/9 053)STEMI患者发生CR,这与既往文献报道相似〔3,15〕,其中82例(49.1%)和32例(19.6%)患者分别在发病24 h内及3~5 d发生CR,这符合CR发生高峰的时间特点〔8〕。本研究得出的5个变量均在以往的文献中明确报道与CR的发生有关〔2,3,15~18〕。在本研究的预测模型中女性占1分,分析其原因可能由于雌激素水平、炎症损伤、侧支循环少、延迟就诊、心室壁薄、容易情绪不安、躁动等导致比男性更容易出现CR〔7,19,20〕。在本研究中年龄每增加10岁,其CR发生率也成倍增加,这与Lopez-Sendon等〔3〕的研究结果相似。模型中,年龄61~70岁为1分,71~80岁为2分,>80岁为3分,起着举足轻重的作用。高龄一直是CR发生的重要危险因素〔21〕,老年患者CR死亡率也高居不下〔22〕。随着年龄的增长,出现的更加严重的炎症反应、细胞外基质(ECM)的损伤、更常见的多支血管病变、脂肪浸润、心肌脆性大、顺应性差、组织修复能力差等能解释为什么高龄患者更容易出现CR〔7,12,23〕。众所周知,心血管疾病与脑卒中有许多共同的危险因素,关系密切〔24〕,文献报道5.1%的STEMI患者既往合并脑卒中病史〔25〕。既往脑卒中病史在本研究模型中占1分,分析其原因,更多合并高血压、糖尿病及外周血管疾病使此类患者并发症多,高龄及认知功能障碍等导致患者延迟就诊〔25〕,冠状动脉在内的动脉系统粥样硬化更严重,再灌注治疗及抗血小板治疗接受率低〔26〕等综合因素使此类患者更容易出现CR。Killip分级已经成为急性心肌梗死患者入院时简单而有效的危险分层工具〔27〕。本研究显示,入院时Killip分级Ⅲ~Ⅳ级在模型中占2分,此类患者CR发生率为入院时Killip分级Ⅰ~Ⅱ级患者的3.498倍。此类患者通常入院时即存在严重心力衰竭或心源性休克,反映心肌梗死面积大,院内死亡率较高。低灌注状态、更常见的多支血管、左主干病变〔28〕、直接 PCI 的比例和有循证依据的药物(抗血小板、他汀类、β 受体阻滞剂、ACEI/ARB)使用较少〔29〕等可能加速了此类患者CR的发生。在我们建立的预测模型中,未行直接PCI占2分。根据STEMI管理指南,直接PCI无疑是STEMI患者首选的再灌注策略,能明显降低患者死亡率〔9〕。它也许通过恢复血管灌注,限制梗死面积,降低透壁性梗死程度,改善左心室重塑等方面来降低CR的发生〔30〕,但是其带来的出血风险及再灌注损伤也不容忽视,如何降低此类风险也许能成为进一步降低CR发生的新的突破口〔16〕。
综上,本研究模型中的每个变量都能用于早期预测CR的风险,但单个变量的辨别能力有限,当这些变量集中在一起时,预测能力会大大提高,而且5个选定的预测变量可在入院后可迅速获得,并快速组合,迅速识别出STEMI患者并发CR的高危人群,临床上可通过加强护理、心理指导、尽可能控制危险因素(如心率、血压等)、选择合理再灌注治疗策略、尽可能应用有循证依据的药物(抗血小板、他汀类、β 受体阻滞剂、ACEI/ARB)等个体化管理〔12〕,最大程度降低CR的发生。
研究局限性:①本研究是单中心、回顾性病例对照研究,样本量相对较少,可能存在偏倚。②虽然在独立内部队列中验证了评分模型,但缺乏外部验证。③CR诊断均依据临床表现及床旁彩超或超声心动图,缺乏尸检,可能低估了真实世界中CR发生率。
