不对称Salen 配体的Ni(Ⅱ)/Cu(Ⅱ)/Mn(Ⅲ)配合物的合成及其晶体结构
2020-02-11张奇龙王家忠杨小生朱必学
张奇龙 王家忠 杨小生 朱必学
(1 贵州医科大学,药用植物功效与利用国家重点实验室,贵阳 550014)
(2 贵州医科大学基础医学院,贵阳 550025)
(3 贵州中烟工业有限责任公司,贵阳 550009)
(4 贵州省大环化学及超分子化学重点实验室,贵阳 550025)
Salen 配体是由二胺类分子与二醛或者二酮类分子通过缩合反应得到的含有2 个C=N 双键的四齿席夫碱配体[1-2]。Salen 配体及其金属配合物因其容易制备、结构上的易修饰性、多变的配位几何构型、高度不对称的配位环境、 独特的电子态等特点而备受化学家们的关注[3-6]。具有不对称结构的salen 配体及其金属配合物类似于生命体系的真实情况, 使得该类化合物被广泛用于生命体系中金属蛋白的模拟研究[7-8]。具有不对称结构的salen 金属配合物在不对称催化[9-10]、非线性光学材料[11-12]、磁性[13]等领域也有着重要的应用与研究价值。合成不对称结构的salen化合物相对困难, 在合成过程中稍微不注意控制条件,就会生成对称的salen 化合物。 合成不对称结构的salen 化合物,首先需要形成较为稳定的“半体”(half unit), 即二胺化合物中仅一个胺基与醛或酮进行缩合反应,另一个胺基没有反应,然后再将“半体”与另一种醛或酮进行缩合反应得到不对称结构的salen 化合物[14]。 但大多数“半体”是不稳定的,实验中很难分离得到纯组分, 从而限制了具有不对称结构的salen 及其配合物的合成与研究。 在这里,我们合成得到不对称结构的salen 配体H2L, 然后将配体H2L 与Ni(OAc)2·4H2O、Cu(OAc)2·H2O、Mn(OAc)2·4H2O 进行配位反应,得到3 个单核配合物[Ni(L)]·CH2Cl2(1),[Cu(L)] (2),[Mn(L)(Cl)]·CH2Cl2(3),研究了它们的晶体结构。
1 实验部分
1.1 试剂和测试仪器
(1R,2R)-环 己 二 胺、2-羟 基-1-萘 甲 醛、3,5-二叔 丁 基 水 杨 醛、Ni(OAc)2·4H2O、Cu(OAc)2·H2O、Mn(OAc)2·4H2O 及其它所用试剂均为分析纯。 表征所用仪器有JEOL ECX 500 MHz 核磁共振仪、Bio-Rad 型傅立叶红外光谱仪(4 000~400 cm-1)、Vario ELⅢ型元素分析仪, 晶体结构测定采用Bruker Smart Apex 单晶衍射仪。
1.2 配体及其配合物的合成
配体的合成:在N2保护下,向250 mL 的三颈瓶中依次加入(1R,2R)-环己二胺1.14 g (0.01 mol) 和60 mL 无水乙醇, 再将2-羟基-1-萘甲醛1.72 g(0.01 mol)的无水乙醇溶液(50 mL)缓慢滴加到(1R,2R)-环己二胺溶液中,在30 min 内滴加完毕,继续搅拌,恒温45 ℃反应20 min。 再将含2.34 g(0.01 mol) 3,5-二叔丁基水杨醛的甲醇溶液(60 mL)加入上述反应液中,室温下继续反应1 h。 反应达到平衡后,有固体析出,滤除固体,将滤液降温至0 ℃以下,并静置过夜,得黄色固体。 经过柱层析(二氯甲烷/乙酸乙酯,4∶1,V/V)分离,减压蒸干,固体经真空干燥,得化合物H2L 1.87 g。产率:38.7%。1H NMR(CDCl3):δ 14.44(s,1H,NaPh-OH),13.62(s,1H,Ph-OH),8.67(s,1H,-CH=N-),8.26(s,1H,-CH=N-),7.65~6.83(m,10H,Ar-H),3.52(m,2H,Chiral-H),3.22(m,1H,Chiral-H),2.20~1.40(m,8H,CH2),1.46(m,9H,-CH3),1.11(m,9H,-CH3)。 元素分 析 按C32H40N2O2计 算 值 (%):C 79.30,H 8.32,N 5.78; 实验值(%):C 79.25,H 8.26,N 5.80。
配合物1 的合成:称取0.968 g(2 mmol) H2L 溶于20 mL 二氯甲烷中, 缓慢滴加Ni(OAc)2·4H2O 0.498 g(2 mmol)的甲醇溶液,反应1 h 有棕色沉淀生成,过滤、用乙醇、水依次分别洗3 次,真空干燥,得0.76 g 配合物1, 产率:70.0%。 FT-IR (KBr,cm-1):3 441(s),2 945(s),2 862(m),1 613(s),1 536(m),1 438(m),1 402(w),1 339(m),1 251(w),1 170(m),922(w),830(m),741(m),574(w),431(w)。 元素分析按C33H40Cl2N2NiO2计 算 值(%):C 63.29,H 6.44,N 4.47;实 验 值(%):C 63.25,H 6.40,N 4.50。
配合物2 的合成:按上述配合物1 的合成方法,H2L 与Cu(OAc)2·H2O 反 应 合 成 得 到0.73 g 棕 色 配合物,产率:67.1%。FT-IR(KBr,cm-1):3 440(m),2 946(s),2 861(m),1 616(s),1 535(s),1 438(m),1 433(s),1 390(m),1 344(s),1 248(m),1 164(s),1 036(w),966(w),832(m),786(w),741(s),554(m),464(w)。 元素分析按C32H38CuN2O2计算值(%):C 70.37,H 7.01,N 5.13;实验值(%):C 70.35,H 7.05,N 5.10。
配合物3 的合成:称取0.968 g(2 mmol) H2L 溶于20 mL 无水乙醇中, 加入溶有1.47 g (3 mmol)Mn(OAc)2·4H2O 的乙醇溶液,回流反应5 h,降至室温,加入0.186 g(3.0 mmol) LiCl,空气鼓泡,室温搅拌3 h,反应完毕,过滤即得产品,依次用乙醇,蒸馏水洗涤数次, 干燥得棕红色固体0.677 g, 产率:63.0%。 FT-IR(KBr,cm-1):3 433(s),2 923(s),2 855(s),1 617(s),1 540(m),1 458(m),1 339(m),1 309(m),1 248(m),1 171(w),1 029(w),972(w),921(w),837(m),747(s),568(s)。 元素分析按C33H40Cl3MnN2O2计算值(%):C 60.24,H 6.13,N 4.26;实验值(%):C 60.20,H 6.10,N 4.23。
1.3 晶体结构测定和粉末衍射测定
将配体及其配合物溶解于三氯甲烷和乙醇的混合溶液中,缓慢挥发后得到配体及其配合物的晶体,选取大小合适的配合物晶体, 用Bruker Smart Apex CCD 单晶衍射仪,采用经石墨单色器单色化的Mo Kα射线(λ=0.071 073 nm),以φ-ω 扫描方式在一定的θ范围(1.50°~24.99°,H2L;1.83°~25.00°,1;1.39°~25.00°,2;1.06°~25.00°,3)内收集单晶衍射数据,衍射强度数据进行了经验吸收校正、Lp 校正。 晶体结构由直接法解得。 对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正。所有计算用SHELX-97 程序完成[15],有关晶体学数据详见表1。
CCDC:1939801,H2L;1939803,1;1939802,2;1939804, 3。
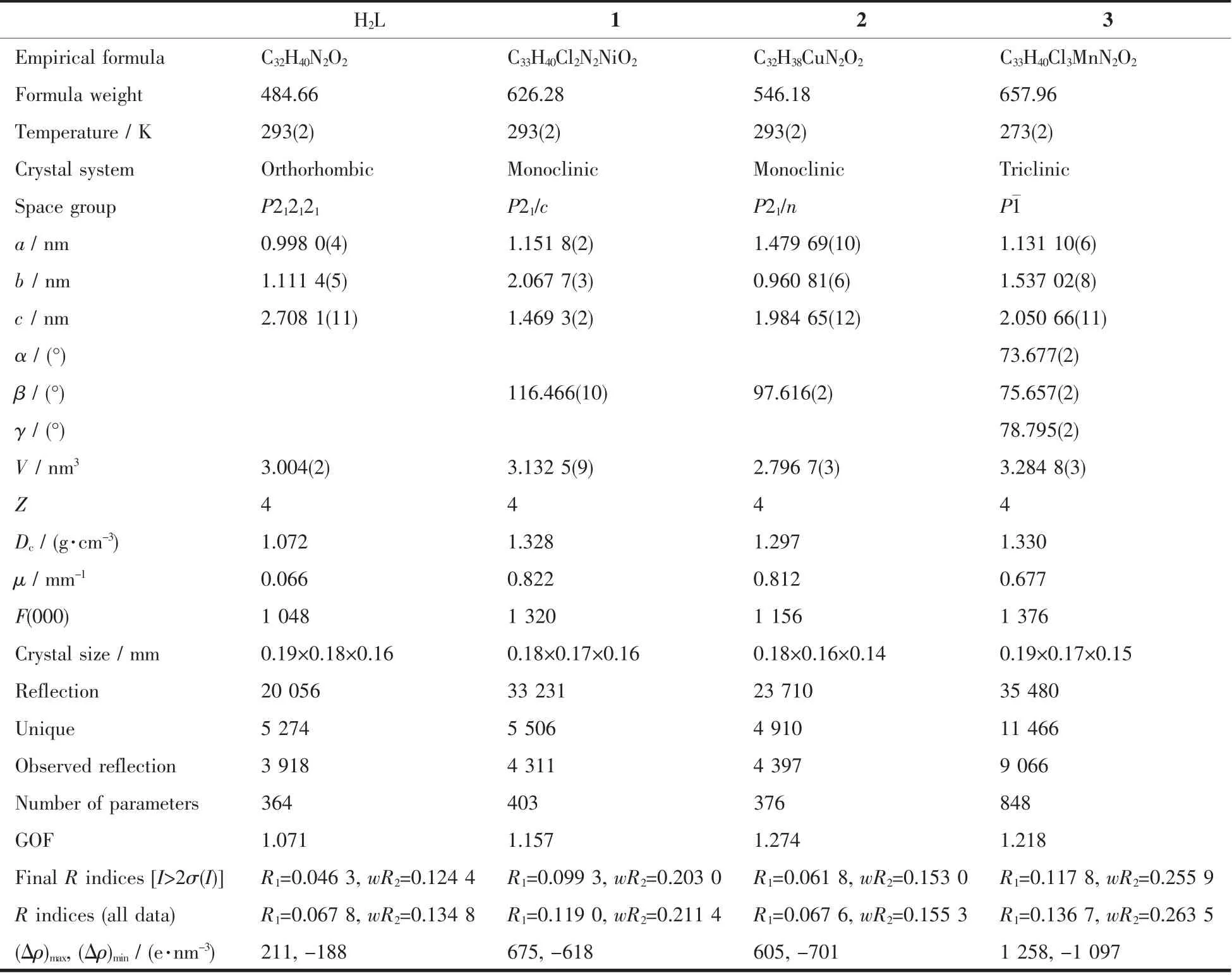
表1 配合物及其配合物的晶体学及结构修正数据Table 1 Crystal data and structure refinement for the ligand and complexes
2 结果与讨论
2.1 配体及其配合物的紫外可见光谱
从图1 中可以看出, 非对称Salen 配体H2L 的λmax分别出现在262、331 nm 和424 nm 三处。 在262 nm 处的吸收归属为芳环的π-π*跃迁产生,331 nm 处的吸收应该归属于C=N 双键的π-π* 跃迁所致,424 nm 谱带为n-π* 跃迁吸收峰。 配合物1 的λmax分别出现在268、350 nm 和425 nm 三处。 在268 nm 处的吸收归属为芳环的π-π*跃迁产生,350 nm 处的吸收应该归属于C=N 双键的π-π* 跃迁所致,425 nm 谱带为n-π* 跃迁吸收峰。 配合物2 的λmax分别出现在242、266 nm 和380 nm 三处。 在242 nm 处的吸收归属为芳环的π-π*跃迁产生,266 nm 处的吸收应该归属于C=N 双键的π-π* 跃迁所致,380 nm 谱带为n-π* 跃迁吸收峰。 配合物3 的λmax分别出现在243、329 nm 和444 nm 三处。 在243 nm 处的吸收归属为芳环的π-π*跃迁产生,329 nm 处的吸收应该归属于C=N 双键的π-π* 跃迁所致,444 nm 谱带为n-π*跃迁吸收峰。

图1 配体及其配合物1~3 的UV-Vis 光谱Fig.1 UV-Vis spectra of the ligand and complexes 1~3
2.2 配体及其配合物的晶体结构
2.2.1 配体H2L 的晶体结构
配体H2L 属于正交晶系,P212121空间群, 配体H2L 的分子结构如图2 所示。 配体分子结构显示环己二胺上的2 个胺基分别与2-羟基萘醛和3,5-叔丁基水杨醛的醛基进行缩合反应生成不对称salen配体。 2-羟基萘醛芳环所在平面和3,5-叔丁基水杨醛芳环所在的平面近似垂直, 其二面角为89.85°,2个醛羟基的朝向相反, 并且2 个羟基都和亚胺氮原子形成O-H…N 分子内氢键(氢键参数见表2),分子间存在C2-H2…Cg(2)、C10-H10…Cg(4)、C15-H15B…Cg(1)、C32-H32A…Cg(4)等4 个C-H…π 相互作用(氢键参数见表2)。

图2 配体H2L 的分子结构Fig.2 Molecular structure of ligand H2L
2.2.2 配合物1 的晶体结构
配合物1 的分子结构如图3 所示,主要键长、键角列在表3 中。 配合物1 属于单斜晶系,P21/c 空间群。 不对称单元中包含1 个配合物1 分子和1 个二氯甲烷分子,中心Ni(Ⅱ)离子具有近似四方平面的配位构型,分别与苯环的羟基氧原子、萘环的羟基氧原子、2 个亚胺氮原子配位, 形成1 个五元环结构和2 个 六 元 环 结 构。 Ni1-O1、Ni1-O2、Ni1-N1、Ni1-N2的 键 长 分 别 为0.182 9(5)、0.183 0(5)、0.183 6(6)和0.183 3(6) nm,Ni(Ⅱ)周围的键角在85.1(2)°~177.1(3)°范围,苯环与萘环的二面角为158.81°。 配合物1 分子中的六元环己烷无序。 配合物1 分子间通过C2-H2…Cg(1)、C6-H6…Cg(2)等C-H…π 相互作用(氢键参数见表2)扩展成一维结构(图4)。
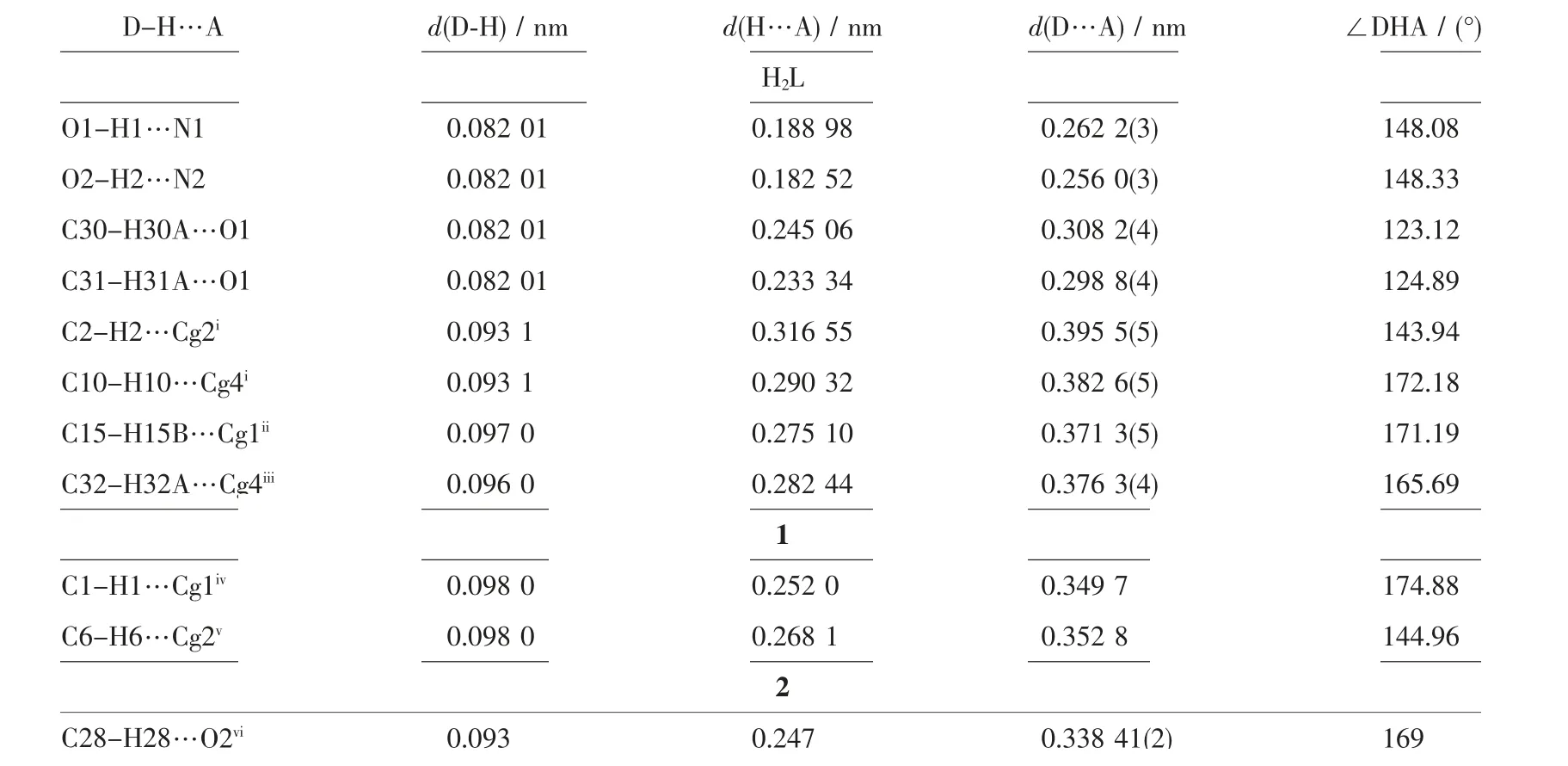
表2 化合物H2L 及配合物1~2 的氢键参数Table 2 Structural parameters of hydrogen bonds for compound H2L and complexes 1~2

图3 配合物1 的分子结构Fig.3 Molecular structure of complex 1

图4 配合物1 通过C-H…π 相互作用扩展形成的一维结构Fig.4 One-dimensional structure of complex 1 formed through C-H…π weak interactions
2.2.3 配合物2 的晶体结构
配合物2 的分子结构如图5 所示,主要键长、键角列在表3 中。配合物2 和配合物1 的结构相似,配合物2 中苯环与萘环的二面角为171.57°,比配合物1 大。配合物2 分子中的六元环己烷也无序。分子之间存在非典型C28-H28…O2 分子间氢键(氢键参数见表2,如图6 所示)。

图7 配合物3 的分子结构Fig.7 Molecular structure of complex 3
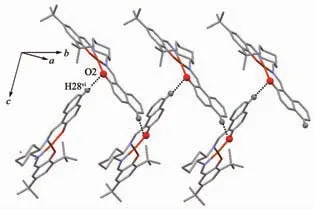
图6 配合物2 通过C28-H28…O2 相互作用扩展形成的一维结构Fig.6 One-dimensional structure of complex 2 formed through C28-H28…O2 weak interactions
2.2.4 配合物3 的晶体结构
配合物3 的分子结构如图7 所示,主要键长、键角列在表3 中。配合物3 属于三斜晶系,P1 空间群,不对称单元中包含2 个配合物3 分子和2 个二氯甲烷分子, 中心Mn(Ⅲ)离子具有近似四方锥形的配位构型, 分别与苯环的羟基氧原子、 萘环的羟基氧原子、2 个亚胺氮原子以及氯原子进行配位,形成一个五元环结构和2 个六元环结构。 Mn1-Cl1、Mn1-O1、Mn1-O2、Mn1-N1、Mn1-N2 的键长分别为0.239 8(3)、0.187 3(6)、0.187 2(5)、0.197 5(7)、0.195 4(6) nm,Mn2-Cl2、Mn2-O3、Mn2-O9、Mn2-N3、Mn2-N4 的键长分别为0.236 4(3)、0.186 3(6)、0.188 0(6)、0.197 7(7)、0.198 3(8)nm。 Mn(Ⅲ)周围的键角在81.8(3)°~163.2(3)°范围内。氯原子位于四方锥形的顶部。尽管不对称单元中2 个Mn(Ⅲ)离子的配位构型都是近似四方锥形,但是结构有点差异。Mn1 到{N2O2}构成的平面(锥底)的距离为0.031 5 nm,Mn2 到{N2O2}构成的平面(锥底)的距离为0.033 5 nm,包含Mn1 的配合物分子中苯环与萘环的二面角为150.88°, 包含Mn2 的配合物分子中苯环与萘环的二面角为172.53°,即包含Mn1 的配合物分子更加扭曲。与配合物1、2 相似的是,配合物3 分子中的六元环己烷也无序,另外配合物3 中有一个叔丁基也无序。 不对称单元中包含的2 个配合物3 分子间存在π…π 相互作用(图8)。

图5 配合物2 的分子结构Fig.5 Molecular structure of complex 2
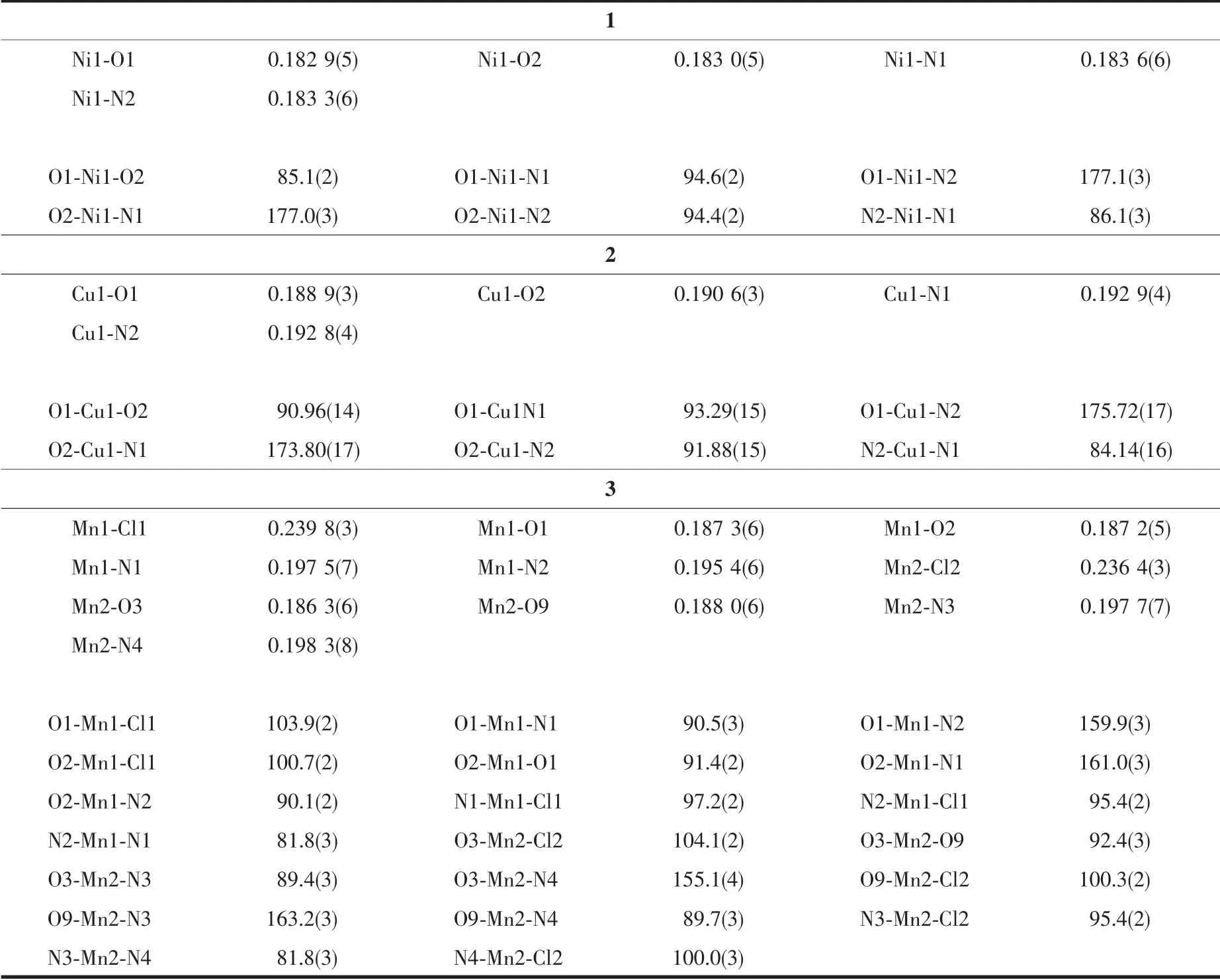
表3 配合物1~3 的部分键长和键角Table 3 Selected bond lengths (nm) and bond angles (°) for complexes 1~3
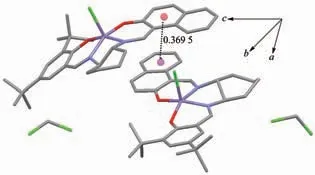
图8 配合物3 分子之间的π…π 弱相互作用Fig.8 π…π weak interaction between complex 3 molecules
