孔源性视网膜脱离术后视网膜微结构与视功能的相关性
2020-02-08吴园园闻思敏
吴园园,杨 林,闻思敏,周 琼
0引言
孔源性视网膜脱离(rhegmatogenous retinal detachment,RRD)是最常见的视网膜脱离,该疾病可造成视力严重损害,原发性RRD发生率约为(5.4~18.2)/10 000[1],高发年龄为55~59岁,而在青少年中很少见,约占所有视网膜脱离的3%~5%[2]。随着医疗技术的发展,解剖复位率可达91.1%~98.9%,但术后最佳矫正视力(best corrected visual acuity,BCVA)优于20/50的仅占39%~56%[3-4]。光学相干断层扫描(optical coherence tomography,OCT)通过光的干涉现象观察组织不同深度水平的断层成像,是一种安全、无创的成像检测技术,可提供各层视网膜图像,为临床定量和定性分析视网膜结构改变提供了途径。很多学者运用OCT技术对RRD患者进行分析,发现了多种黄斑形态学异常改变,且其改变与患者术后视功能恢复有关[5-6]。本研究选取诊断为RRD、病变累及黄斑部位、年龄15~30岁的患者作为研究对象,根据裂孔位置行巩膜扣带术(scleral buckling,SB)或玻璃体切除术(pars plana vitrectomy,PPV),运用OCT技术观察术前术后视网膜结构变化,并分析其与视功能的相关性,探索RRD术后转归。
1对象和方法
1.1对象前瞻性临床研究。选取2017-06/2018-09就诊于南昌大学第一附属医院眼科的RRD患者75例75眼,其中赤道部前视网膜裂孔患者40例40眼行SB术(SB组),赤道部后视网膜裂孔患者35例35眼行PPV术(PPV组)。SB组患者中男21例,女19例,平均年龄22.25±5.61岁,平均发病时间13.35±8.60d。PPV组患者中男18例,女17,平均年龄23.77±5.05岁,平均发病时间12.23±7.78d。纳入标准:(1)初次发病,经眼部B超、眼底照相、OCT检查证实病变累及黄斑部;(2)增殖性玻璃体视网膜病变(perliferative vitreoretinopathy,PVR)等级为B~C1级;(3)年龄15~30岁;(4)术后随访6mo,无手术相关并发症发生。排除标准:(1)病变未累及黄斑部;(2)外伤导致的视网膜脱离者;(3)PVR等级C2级及以上;(4)合并其他眼科疾病,如糖尿病视网膜病变、青光眼、白内障、弱视、家族性渗出性玻璃体视网膜病变等;(5)伴有手术及麻醉禁忌者;(6)既往行玻璃体视网膜手术者。两组患者性别构成比、年龄、发病时间、术前最佳矫正视力(BCVA)等基本资料比较,差异均无统计学意义(P>0.05,表1)。本研究经南昌大学第一附属医院医学伦理委员会批准。所有患者或其监护人均对本研究知情同意并签署知情同意书。
1.2方法
1.2.1手术方法
1.2.1.1术前准备术前1d均行视力、OCT等眼科检查。术前局部予5g/L左氧氟沙星滴眼液点术眼4次,采用20g/L盐酸利多卡因注射液和10g/L盐酸罗哌卡因注射液混合液行球后麻醉。两组患者手术均由同一医生完成。
1.2.1.2 SB组采用OPMI Lumera 700、Carl Zeiss Mdeditec AG显微镜,根据视网膜脱离部位及范围,沿角巩膜缘放射状做球结膜切口,选择1-0尼龙线作牵引线分别悬吊裂孔周围直肌,用1mL注射器针头行巩膜穿刺,配合深部拉钩压迫后部巩膜使视网膜下液尽可能排净,定位裂孔,裂孔处冷冻4~5s。将硅胶条加压于裂孔处,并予5-0网脱线固定于巩膜表面,6-0薇荞线缝合结膜切口。地塞米松2mg球结膜下注射,涂氧氟沙星眼膏,包扎术眼。术后体位无特殊要求。
1.2.1.3 PPV组采用Alcon 23G联合手术套包-5000CPM 0.9mm普通照明光纤、Alcon constellation VISION SYSTEM 玻切机、PurePiont YZB激光光凝机进行手术。分别在鼻上、颞上、颞下距角巩膜缘3.5mm处穿刺巩膜,分别置入光纤、灌注头及玻切头。置广角镜,切割中轴部玻璃体,可见视网膜脱离情况,重水下切割周边部玻璃体。裂孔处行视网膜激光光凝,激光光斑大小200μm、持续时间200ms、能量100mJ。气液交换后均注入ARCADOPHTA SARL Arviolane5500硅油5mL。涂氧氟沙星眼膏,包扎术眼。术后1mo嘱患者保持俯卧位,保持裂孔位置处于最高位。术后3mo取出硅油。
1.2.1.4术后处理术后两组患者均采用5g/L左氧氟沙星滴眼液、妥布霉素地塞米松滴眼液(妥布霉素15mg,地塞米松5mg)点术眼,4次/d;氧氟沙星眼膏点术眼,1次/晚;各用药1mo后停药。
1.2.2观察指标术后1、3、6mo两组患者均进行OCT和BCVA检查。OCT检查:运用频域光学相干断层扫描仪(SD-OCT)Macular Cube 512×128扫描模式记录黄斑区视网膜图像,一般图像信号强度>5为合格采用。检查前使用复方托吡卡胺散大瞳孔,在6mm×6mm正方形模式下扫描视网膜内界膜-色素上皮层每层组织,记录神经上皮层、外核层厚度,其中中心凹下视网膜神经上皮层厚度为中心凹视网膜内界膜至视网膜色素上皮和Bruch膜复合体的内界距离;中心凹下外核层厚度为从视网膜内界膜到视网膜外界膜最内反光线之间的距离。同时,观察视网膜椭圆体带(inner sensory layer/outer sensory layer,IS/OS)和内界膜(internal limiting membranes,ILM)的完整性及是否有视网膜层间积液。BCVA检查:采用国际标准视力表对患者进行BCVA检查,结果转换成最小分辨角对数(LogMAR)视力进行统计分析。
2结果
2.1两组患者术后视网膜厚度情况术后两组患者神经上皮层厚度具有时间差异性(F时间=75.15,P时间<0.001),术后6mo两组患者神经上皮层厚度分别与同组术后1mo比较,差异均有统计学意义(PSB组<0.001,PPPV组=0.022),其余时间点两两比较差异均无统计学意义(P>0.05)。术后两组患者神经上皮层厚度具有组间差异性(F组间=6.672,P组间=0.012),术后1mo两组患者神经上皮层厚度差异无统计学意义(t=1.860,P=0.067),但术后3、6mo两组患者神经上皮层厚度差异有统计学意义(t=2.354、3.240,P=0.021、0.002)。术后两组患者神经上皮层厚度变化趋势具有差异性(F组间×时间=3.719,P组间×时间=0.04),随着观察时间的延长,SB组患者神经上皮层厚度的增厚幅度较大(表2)。
表1 两组患者术前基本资料比较
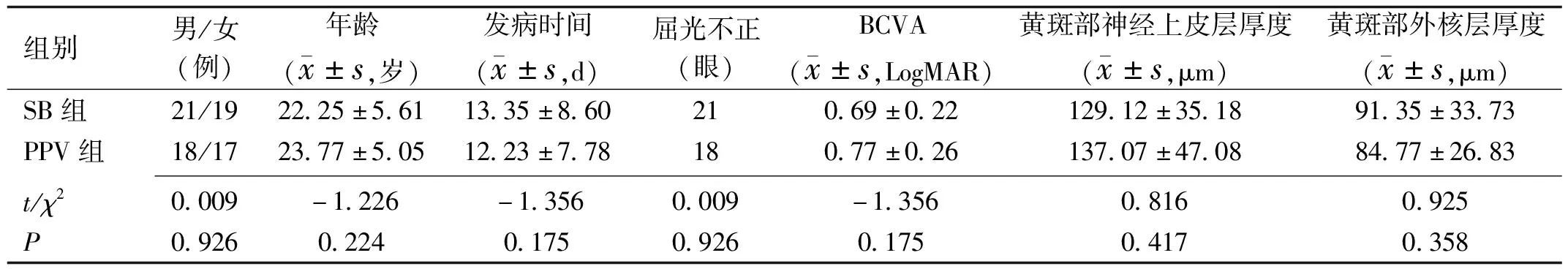
组别男/女(例)年龄( x±s,岁)发病时间( x±s,d)屈光不正(眼)BCVA( x±s,LogMAR)黄斑部神经上皮层厚度( x±s,μm)黄斑部外核层厚度( x±s,μm)SB组21/1922.25±5.6113.35±8.60210.69±0.22129.12±35.1891.35±33.73PPV组18/1723.77±5.0512.23±7.78180.77±0.26137.07±47.0884.77±26.83 t/χ20.009-1.226-1.3560.009-1.3560.8160.925P0.9260.2240.1750.9260.1750.4170.358
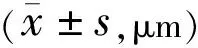

组别眼数神经上皮层厚度术后1mo术后3mo术后6mo外核层厚度术后1mo术后3mo术后6moSB组40141.63±34.99154.48±31.85168.58±31.0388.70±26.4394.93±25.57102.57±24.75PPV组35127.63±29.43137.26±31.32144.91±32.1376.51±21.8282.66±23.3189.20±24.44
表3 广义估计方程模型分析结果
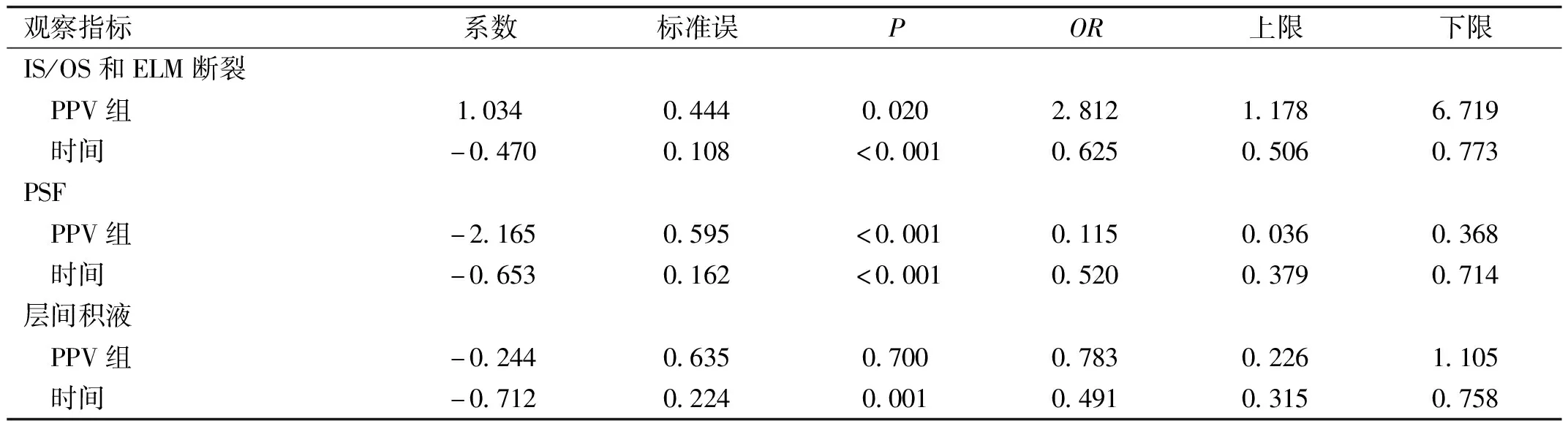
观察指标系数标准误POR上限下限IS/OS和ELM断裂 PPV组1.0340.4440.0202.8121.1786.719 时间-0.4700.108<0.0010.6250.5060.773PSF PPV组-2.1650.595<0.0010.1150.0360.368 时间-0.6530.162<0.0010.5200.3790.714层间积液 PPV组-0.2440.6350.7000.7830.2261.105 时间-0.7120.2240.0010.4910.3150.758
表4 两组患者术后IS/OS和ELM完整性及PSF和层间积液发生情况眼

组别眼数IS/OS和ELM断裂术后1mo术后3mo术后6moPSF术后1mo术后3mo术后6mo层间积液术后1mo术后3mo术后6moSB组40221813272010742PPV组35272520574531
术后两组患者外核层厚度具有时间差异性(F时间=67.76,P时间<0.001),术后6mo两组患者外核层厚度分别与同组术后1mo比较,差异均有统计学意义(PSB组=0.016,PPPV组=0.024),其余时间点两两比较差异均无统计学意义(P>0.05)。术后两组患者神经上皮层厚度无组间差异性(F组间=5.236,P组间=0.25),变化趋势也无差异(F组间×时间=0.184,P组间×时间=0.737)。
2.2两组患者术后IS/OS和ELM完整性及PSF和层间积液发生情况经广义估计方程模型分析,相较于SB组,PPV组术后发生IS/OS和ELM断裂的可能性为2.812倍,差异有统计学意义(P=0.020),发生视网膜下积液(persistent subretinal fluid,PSF)的可能性为0.115倍,差异有统计学意义(P<0.001),但两组患者术后发生层间积液的可能性差异无统计学意义(P=0.700),且随着观察时间的延长,两组患者发生IS/OS和ELM断裂、PSF、层间积液的可能性均逐渐降低(OR=0.625、0.520、0.491),见表3、4。
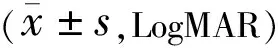

组别眼数术后1mo术后3mo术后6moSB组400.64±0.240.58±0.240.49±0.23PPV组350.75±0.270.71±0.280.67±0.29t-1.915-2.274-2.987P0.0590.0260.004
2.3两组患者术后BCVA比较术后两组患者BCVA具有时间差异性(F时间=67.47,P时间<0.001),术后6mo SB组患者BCVA与术后1mo比较,差异有统计学意义(P=0.005),其余时间点两两比较差异均无统计学意义(P>0.05);术后1、3、6mo PPV组患者BCVA各时间点两两比较差异均无统计学意义(P>0.05)。术后两组患者BCVA具有组间差异性(F组间=4.89,P组间=0.03),术后1mo两组患者BCVA差异无统计学意义(P>0.05),但术后3、6mo两组患者BCVA差异有统计学意义(均P<0.05)。术后两组患者BCVA变化趋势具有差异性(F组间×时间=7.31,P组间×时间=0.002),随观察时间的延长,SB组患者BCVA恢复更佳(表5)。
表6 两组患者术后BCVA与黄斑部神经上皮层厚度和外核层厚度的相关性r/P
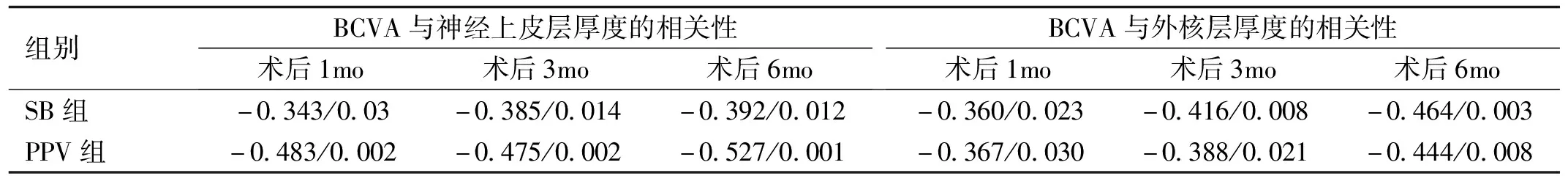
组别BCVA与神经上皮层厚度的相关性术后1mo术后3mo术后6moBCVA与外核层厚度的相关性术后1mo术后3mo术后6moSB组-0.343/0.03-0.385/0.014-0.392/0.012-0.360/0.023-0.416/0.008-0.464/0.003PPV组-0.483/0.002-0.475/0.002-0.527/0.001-0.367/0.030-0.388/0.021-0.444/0.008
2.4视力与视网膜厚度的相关性分析Pearson相关性分析结果显示,术后各时间点两组患者BCVA(LogMAR)均与黄斑部神经上皮层厚度、外核层厚度呈负相关,表明术后随着视网膜厚度的增加,视力逐渐改善(表6)。
3讨论
研究表明,年龄是RRD发生的危险因素,主要是由于玻璃体性质随年龄增长而变化[7]。正常情况下,玻璃体为无色透明胶质,主要成分包括水、胶原、透明质酸[7]。玻璃体和视网膜内界面由胶原纤维连接,当玻璃体发生后脱离时,由玻璃体产生的向前牵引力加强,容易牵拉已有格子样变性的视网膜而造成视网膜马蹄形裂孔,液化的玻璃体通过该裂孔进入视网膜神经上皮层下,最终形成RRD。青少年较少发生玻璃体后脱离,裂孔以变性萎缩圆孔为主,在裂孔附近常伴有视网膜变性区,如格子样变性、霜样变性等。当出现这些变性区时,即使未出现裂孔,也可在这些变性区处预防性使用激光光凝术,从而减少视网膜脱离的发生。
IS/OS和ELM的连续性代表光感受器细胞的结构完整性[8]。本研究中,SB组患者术后发生IS/OS和ELM断裂者从术后1mo 22例22眼(55%)下降到术后6mo 13例13眼(32%),PPV组术后发生IS/OS和ELM断裂者从术后1mo 27例27眼(77%),下降到术后6mo 20例20眼(57%),两组患者IS/OS和ELM的完整性均有明显恢复,但SB组恢复更佳,视力恢复更佳。与本研究结果一致,Staurenghi等[5]观察了51例RRD患者,其中43%存在IS/OS断裂,视力较未发生IS/OS断裂患者更差。研究表明,动物和人类的眼睛在视网膜脱离早期就会诱导光感受器凋亡,细胞凋亡在2d达到高峰,1wk后逐渐下降,即一旦神经上皮层与视网膜色素上皮(retina pigment epithelium,RPE)层分离,就已经出现感光细胞的凋亡[9]。Gharbiya等[10]发现,IS/OS断裂长度≥200μm的患者视力预后较该层断裂<200μm的患者差。以上研究均证实IS/OS和ELM断裂情况与视力预后密切相关。关于RRD患者及动物实验研究表明,随着时间的延长光感受器细胞均能恢复,黄斑部神经上皮层厚度、外核层厚度也逐渐增加[11-13]。Gharbiya等[10]对术后6mo的RRD患者进行OS厚度测量,发现其厚度较正常人更薄,但较术前明显增加。这些研究结果表明术后早期IS/OS良好的完整性代表着术后BCVA更佳[14]。
本研究结果显示,术后1、3、6mo,SB组患者PSF发生率分别为68%(27/40)、50%(20/40)、25%(10/40),PPV组患者PSF发生率分别为14%(5/35)、20%(7/35)、11%(4/35)。PPV组患者术后PSF发生率明显低于SB组患者,推测其可能原因是大部分视网膜下积液在PPV术中经内部引流清除,而且在气体或硅油填充的辅助下使黄斑下积液从黄斑区转移,所以在PPV术后早期出现PSF的可能性较低。而SB术中穿刺放液无法将视网膜下积液引流干净,在术后早期较多患者仍有视网膜下积液,术后随着时间的延长,视网膜下积液逐渐吸收。Jong等对36例SB术后患者进行长期随访研究,发现术后6mo PSF发生率为50%[15],国内相关文献报道则为12.5%~52.5%[16]。孟自君等[17]研究发现PPV术后1、3、6mo PSF发生率分别为13.9%、5.6%、2.9%。目前,关于RRD复位术后PSF的发生机制仍不明确。Oellers等[18]认为SB术可导致脉络膜血流量减少,改变了RPE的极性,造成液体渗出。多数研究者认为PSF中含有的细胞碎片、高浓度蛋白使视网膜下液变得黏稠而增加了吸收难度[19]。研究证实,如果RRD患者术后黄斑区出现PSF,则视力恢复往往较差,这可能是因为黄斑区PSF的存在增加了RPE层与光感受器细胞层之间的距离,干扰了血-视网膜屏障,RPE吞噬功能减弱,导致视网膜下液持续性存在,进一步损伤光感受器细胞[20]。Benson等[21]研究结果表明,视网膜下液未吸收时其对视力影响较大,但不影响最终视力。
我们发现,SB组患者术后BCVA优于PPV组。Tewari等[23]研究表明,PPV术较SB术具有更高的解剖复位率,但是SB组术后视力优于PPV组,这与本研究结果一致。推测可能是由于视网膜的光损伤及玻璃体腔填充物的毒性作用。Grignolo等[23]认为光损伤的可能机制包括暴露在强光下由维生素A产生有毒光产物,光暴露引起代谢异常以及光引起氧化反应。手术过程中,显微镜及光纤均可对视网膜造成光损伤,且光损伤与光照时间、光源强度呈正相关,与光源距离视网膜间距呈负相关。PPV联合硅油填充术解剖复位率高,但硅油也会带来慢性并发症。Caramoy等[24]观察了9例病变未累及黄斑的RRD患者在接受PPV联合硅油术后的情况,发现术眼神经节细胞层(ganglion cell layer,GCL)和内丛状层(inner plexiform layer,IPL)厚度随时间变薄,而外层视网膜厚度不变。Scheerlinck等[25]认为当硅油替代了玻璃体时,玻璃体电解质和水溶性因子的缓冲作用消失,内平衡失调,K+沉积在视网膜上,引起Müller细胞损伤,术后视功能恢复较差。但也有研究表明,PPV术相对于SB术具有更佳的解剖及功能复位效果,分析其可能原因是PPV术中视网膜下液在气液交换过程中被完全排出,而SB术中视网膜下液则是被有限排出;同时SB术中冷凝引起的炎症反应可能会加速视网膜下积液的产生,破坏血-视网膜屏障[25]。在取出硅油,视网膜失去硅油顶压作用后,PPV术的解剖复位率下降[26]。也有研究认为,PPV术和SB术后远期视力无明显差异[27]。
综上,本研究表明,随着随访时间的延长,SB术后视力优于PPV术,但SB术后更易出现PSF,且吸收速度较快。随着IS/OS和ELM完整性的恢复,黄斑部神经上皮层和外核层厚度逐渐增加,且与视力具有显著相关性。因此,IS/OS和ELM完整性、PSF、黄斑部神经上皮层和外核层厚度是影响患者术后视力恢复的关键因素。然而,本研究仍存在一定的局限性:(1)本研究样本量较少,观察时间较短;(2)神经上皮层、外核层厚度测量可能存在偏差;(3)SB术后黄斑血量变化及PPV术后眼内填充物对视功能恢复的影响未能排除。在今后的研究中,我们将进一步扩大样本量,并深入分析裂孔位置对视功能恢复的影响。
