455~470nm波长的面阵蓝光对SD大鼠视网膜组织结构的影响
2020-02-08李慧丽陈治威孙小红董国军王大洪肖胜燕李小丹
李慧丽,陈治威,孙小红,董国军,王大洪,肖胜燕,李小丹
0引言
近年来,关于光对视网膜的损伤一直是眼科及视光学专业研究的热点问题,蓝光作为高能短波可见光,波长在400~500nm间对视网膜的影响最大,对视网膜具有高度的敏感性及穿透力,故又被称为“高能可见光”[1],其对视网膜造成光化学损害已被研究证实。本实验选取波长为455~470nm的蓝光灯珠制成实验所需的面阵蓝光发光器,观察面阵蓝光对SD大鼠视网膜组织结构的影响,讨论分析照射时间与视网膜组织结构变化之间的关系。

图1规格380mm×325mm×180mm聚乙烯PP饲养笼,顶置蓝光发光器。
图2蓝光发光器内侧面。
图3蓝光发光器外侧面。
图4实验室环境。
图5蓝光照射整体工作状态。
图6正在进行蓝光照射的单个饲养笼。
1材料和方法
1.1材料
1.1.1实验动物6周龄雄性SD大鼠24只,体质量400~450g,重庆医科大学实验动物中心提供。SPF级动物包房分笼饲养,12h/12h(明暗交替)室温18℃~20℃,相对湿度40%~70%,通风换气8~12次/h。实验SD大鼠均用标准饲料喂养[实验动物生产许可证:SCXK(渝)2012-0006]。对实验大鼠行常规眼部检查,证实其外眼和眼底均正常。动物管理符合动物保护条例并符合动物伦理委员会要求。
1.1.2主要试剂及仪器DAB(diaminobenzidine,DAB二氨基联苯胺显色试剂盒)(中杉金桥生物科技有限公司);粘附载玻片(CITOTEST江苏世泰实验器械有限公司);AR分析纯丙酮(天津市科密欧化学试剂有限公司);冰醋酸(台山市新宁制药有限公司);8%~14%甲醛溶液(重庆川东化工有限公司);10%的水合氯醛注射液(青岛宇龙海藻有限公司);95%乙醇(四川金山制药有限公司);照度计ZD-10(杭州远方光电信息股份有限公司);重庆康华瑞明科技股份有限公司协助制作的蓝光发光器(图1)。目前蓝光灯珠波长多455~470nm,本实验我们使用的灯珠波长为455~470nm,主峰462nm(广东台宏光电科技有限公司)。双目生物显微镜(日本OLYMPUS公司);11800型修块机(瑞典LKB公司);8800型超薄切片机(德国Leica公司)。
1.2方法
1.2.1实验动物分组选取6周龄健康SD雄性大鼠24只,随机分为正常对照组(n=6)和实验组(n=18),正常对照组无任何干预正常喂养6wk;实验组分为3个小组,每天分别予蓝光发光器(455~470nm、391Lx)照射3、6、12h,连续照射6wk。
1.2.2蓝光发光器的制备聚乙烯PP饲养笼,规格380mm×325mm×180mm,顶盖安置蓝光发光器(图1)。发光器由9个大功率蓝光LED灯组成,横向每组串联3个灯珠,纵向并联3组,灯珠之间横向间距9cm,纵向间距12cm(图2、3)。通过预实验观察,发现蓝光照射下大鼠活动范围主要集中在箱底周边区域,实时测得距离发光器光源20cm处实验箱底四角及四边中点照度值为385.2~397.5(均值391)Lx,作为本实验的照度值(图4~6)。
1.2.3大鼠眼球壁组织病理学检查快速颈椎脱臼处死大鼠,分别于大鼠双眼角膜缘12∶00位缝线做标记,立即摘除眼球,眼球取下后立刻投入AR分析纯丙酮50mL+冰乙酸2mL+40%甲醛4mL+蒸馏水3mL的混合液中,固定24h,2h后在眼球标本侧面角膜缘开窗,便于固定液渗入,眼球标本继续再固定2d,取出标本,再转入80%乙醇浸泡4h,95%乙醇浸泡4h,100%乙醇浸泡4h,脱水固定,二甲苯透明,浸蜡3h,包埋,矢状面切片,切片厚度4μm,常规HE染色,光学显微镜下观察455~470nm波长的面阵蓝光对SD大鼠视网膜组织结构的影响,讨论分析照射时间与视网膜组织结构变化之间的关系。
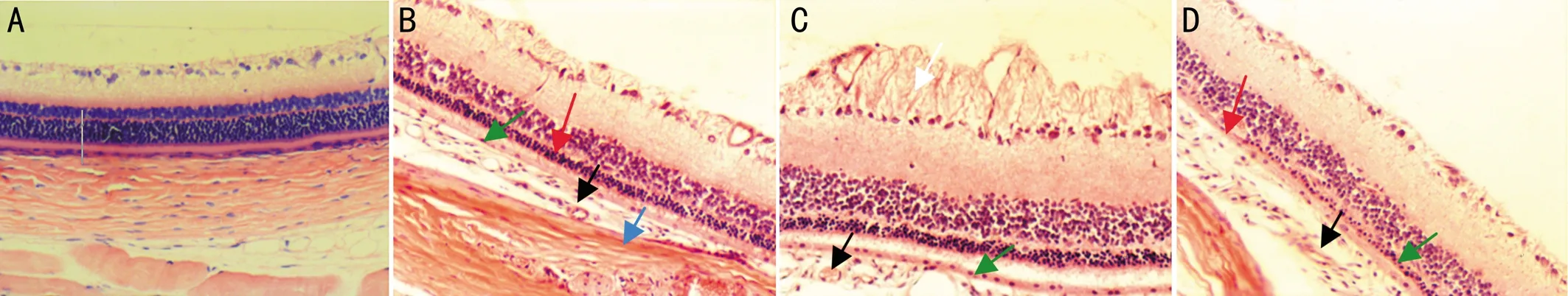
图7各组大鼠视网膜组织的组织病理学表现(HE×200)A:正常对照组大鼠眼视网膜结构和形态正常;B:3h实验组大鼠眼脉络膜纤维结缔组织玻璃样改变(蓝箭头),小血管增生(黑箭头),色素层变薄,细胞稀疏(绿箭头),视细胞层细胞数量减少(红箭头);C:6h实验组大鼠眼脉络膜层疏松水肿,小血管增生(黑箭头),色素层变薄,细胞稀疏(绿箭头),神经节细胞层局部胞浆丰富,向内侧形成胞突(白箭头);D:12h实验组大鼠眼脉络膜层疏松水肿小血管增生(黑箭头),色素层变薄(绿箭头),视细胞显著减少、萎缩,胞核固缩,局部视细胞消失(红箭头),双极细胞层及节细胞层变化不明显。
2结果
正常对照组的大鼠眼脉络膜结构完整,可见致密纤维结缔组织;色素上皮层由2~3层梭形上皮细胞组成,胞质内含少量色素颗粒;视细胞层排列整齐,约10余层视细胞核组成,细胞核结构清楚,双极细胞层结构完整,细胞排列整齐,约6层细胞核重叠排列,视网膜神经节细胞层呈单层疏松排列,局部可见小血管(图7A)。蓝光照射3h实验组的大鼠眼脉络膜致密纤维结缔组织玻璃样改变,局部疏松水肿,小血管增生,色素层变薄,细胞稀疏;视细胞数量减少约5~6层,细胞核染色清晰,双极细胞层及节细胞层未见明确改变(图7B)。蓝光照射6h实验组的大鼠眼脉络膜层疏松水肿,小血管增生;色素层变薄,细胞稀疏,视细胞层细胞数进一步减少,约4~5层,细胞核固缩;双极细胞层轻度增生,细胞核淡染;神经节细胞层局部胞浆丰富,向内侧形成胞突,小血管增生(图7C)。蓝光照射12h实验组的大鼠眼脉络膜层疏松水肿,小血管增生;色素层变薄,细胞疏松;视细胞显著减少、萎缩,细胞核固缩,大部分视细胞层细胞核1~2层,并逐渐减少,局部视细胞消失;双极细胞层及节细胞层变化不明显(图7D)。
3讨论
随着LED光源大量应用,短波蓝光造成的潜在视网膜损伤应该引起重视[2]。视网膜是眼组织中最容易受到光辐射损害的部位,1966年Noell等[3]首次建立大鼠视网膜光损伤动物模型。既往研究发现视网膜光损伤主要累及视网膜的光感受器细胞和色素上皮细胞。大鼠的视网膜光感受器视杆细胞约占97.2%,而视锥细胞仅占2.8%[4]。视网膜色素上皮细胞参与视黄醇循环,吞噬脱落的光感受器细胞外节以维持光感受器细胞兴奋性,并分泌多种生长因子,帮助维持脉络膜血管内皮细胞和光感受器细胞的结构完整性[5-7]。既往实验证明视网膜色素上皮细胞对蓝光刺激敏感[8],损伤可造成血视网膜屏障及跨膜物质转运发生功能障碍[9-10],故有研究者认为,蓝光损伤主要部位为视网膜的色素上皮细胞,凋亡是其主要表达方式[11]。
而近年来的研究[12]则更多表明蓝光照射引起的视网膜光损伤其本质是光感受器的凋亡。每个光感受器细胞外节内含一种感光色素。视杆细胞外节所含感光色素为视紫红质(rhodopsin),视紫红质由11-顺视黄醛和视蛋白组成,与光损伤的发生密切相关[13]。视黄醛(retiniod)被称为A2E(N-retinyl-N-retinylideneethanolamine1)[14-16],A2E有2个吸收峰,一个在紫外光区335nm处,一个在蓝光区的435nm处。A2E对视网膜色素上皮在没有光照的黑暗条件下没有毒性,而光照下毒性大大增加。蓝光对视网膜的损害是连锁反应:蓝光激发A2E使其释放自由基离子,自由基离子增大A2E对视网膜色素上皮的损坏,引起视网膜色素上皮萎缩,导致光感受器细胞的凋亡。
既往国内文献报道多采用点光源蓝光照射实验,点光源所发出的光谱距离垂直中心方向越远,光照度差异越大。面阵光源在同一平面内照射的范围较大,距离垂直中心方向光照度差异性小,各个方向的光照度更均匀;国外文献也有报道使用面阵光源照射模型[17],其采用高光无间断照明,将氙灯汇聚成小光束,经过蓝色滤光片或绿色滤光片形成蓝光束-或绿光束,直接短时间高光照射固定在模具中的大鼠眼睛,其光照时间与光照均匀性的设计与本实验有区别。
本实验设计在养殖箱内完成,实验最好选用一块同养殖箱底面同样大小的LED显示屏照射,但因实际条件所限不能实施。若简单选用一个LED光源照射,就会存在因点光源近距离投射造成不同位置光照度相差较大。为此,综合考虑箱体大小、大鼠活动性,采用由9个蓝光LED灯构成面阵照射,通过国家计量质检中心检测验证,实时测量养殖箱底部5个部位(4个角+1个中心)的照度数值基本一致,波动范围均在10%以内,符合实验照射要求,可重复操作性强。本实验设计方案既往未见国内外报道。
本实验基于455~470nm面阵蓝光发光器每天分别照射SD大鼠3、6、12h,随蓝光照射时间延长,各实验组大鼠眼脉络膜纤维结缔组织玻璃样改变,局部疏松水肿,小血管增生,色素层变薄,细胞稀疏,视细胞数逐渐减少,局部消失。3h实验组细胞核染色清晰,双极细胞层及节细胞层未见明确改变。6、12h实验组细胞核固缩,双极细胞层轻度增生,神经节细胞层局部形成胞突。光照时间越长光感受器细胞损伤越重,与既往报道一致。蓝光照射引起视网膜色素上皮细胞变薄疏松,色素上皮细胞损伤程度与蓝光照射时间无明显关系。由于条件限制未对大鼠视网膜各层具体厚度及细胞数进行检测及统计学分析,有待进一步完善。
致谢重庆市中医研究院病理科曾敏指导病理切片阅片。
