烟草BELL基因家族鉴定及其温室条件下的表达模式分析
2020-02-08宋卫娜赵森森武明珠王根发罗朝鹏李泽锋
宋卫娜,赵森森,武明珠,王根发,罗朝鹏,王 晨,李泽锋,杨 军,王 中*
1.中国烟草总公司郑州烟草研究院,郑州高新技术产业开发区枫杨街2号 450001
2.郑州大学生命科学学院,郑州高新技术产业开发区科学大道100号 450001
3.河南中烟工业有限责任公司技术中心,郑州市经济技术开发区第三大街9号 450000
植物TALE(Three amino-acid loop extension)基因家族编码一类包含同源异型盒结构域的转录因子,其DNA结合域由63个氨基酸组成,形成2个螺旋与3个额外氨基酸(P-Y-P)的非典型结构[1-2]。根据序列和进化上的差异,植物TALE基因家族可进一步被分为BELL(BEL1-like homeodomain)和KNOX(KNOTTED1-like homeobox)两个亚家族。KNOX基因主要参与细胞分化和茎尖分生组织的维持[3-4],而BELL基因在胚珠发育、叶状体发育、干细胞维持和分化中起着重要作用[5-7]。
BELL基因家族存在于所有生物体中,但不同植物中该基因家族成员数目不同。例如,苔藓基因组中有 4个BELLs基因[8],拟南芥有13个[5],玉米有15个[9],而水稻和土豆各有14个[10-11]。虽然BELL基因家族的数目不同,但其编码的蛋白在结构上具有高度保守性,都包含SKY、BEL和HD功能域[12]。这3个功能域的高度保守对维持植物BELL的功能具有重要意义。研究表明,SKY和BEL功能域能够与KNOX蛋白的MEINOX结构域进行特异性识别和结合,从而形成BELL-KNOX异源二聚体蛋白[13],这种结合对两种转录因子蛋白的核定位和结合靶基因序列的活性至关重要[14-16]。BELL-KNOX二聚体形成后会从细胞质转移到细胞核中,随后两个蛋白的HD功能域识别并特异结合到各自的靶基因序列上,从而实现对下游靶基因表达水平的调控[2,17]。与此同时,BELL-KNOX二聚体蛋白还能与其他转录因子互作。例如,与MADS-Box转录因子和SPOROCYTELESS蛋白结合,共同调控胚珠的发育[18-19];与OVATE蛋白结合后,BELL-KNOX二聚体蛋白能够从细胞核反向转移到细胞质中[20]。多种具有不同活性的异源BELL-KNOX二聚体组合参与调控植物的生长发育,包括茎尖分生组织及其边界的维持、叶片发育、开花等[20-23]。在拟南芥中,BELL家族的BLH1蛋白能够与KNOX家族的KNAT3蛋白结合形成BLH1-KNAT3二聚体,通过调控脱落酸(ABA)信号通路相关基因的表达而影响种子的发芽和生长[14,20]。BELL 家族的ATH1蛋白与 KNOX 家族STM蛋白形成的二聚体能够调控植物顶端分生组织的发育[15],而ATH1蛋白和KNAT2蛋白形成的二聚体则调控植物花序组织的发育[24]。
虽然已在多种植物中鉴定出了BELL基因,但大多数基因的功能仍未十分明确。目前,关于BELL基因功能的研究主要集中在模式植物拟南芥中,鲜见烟草BELL(NtBELL)基因的报道。根据烟草基因组数据库,利用生物信息学的方法,通过检索SKY、BEL和HD功能域鉴定出烟草基因组中的BELL基因后,对烟草BELL家族成员的序列特征、进化关系和表达模式进行分析,以期为进一步研究烟草BELL基因的功能奠定基础。
1 材料与方法
1.1 材料、试剂和仪器
供试材料为普通栽培烟草红花大金元(Nicotiana tabacum L.)。烟草种子于2017年3月播种于MS培养基上,待幼苗长至4片真叶时,移栽到小盆钵中。移栽后的幼苗种植在国家烟草基因研究中心温室,温室条件为28℃光照16 h,23℃黑暗8 h。待烟苗长至盛花期,分别收集根、茎、叶、顶芽、花蕾和花等样品,经液氮速冻后于-80℃保存。
TransTaq®高保真Taq酶试剂盒(北京全式金生物技术有限公司);反转录试剂盒(北京康润诚业生物科技有限公司);植物多酚RNA提取试剂盒、实时荧光定量试剂盒和凝胶回收试剂盒(北京艾德莱生物科技有限公司);限制性内切酶(大连宝生物工程有限责任公司)。引物由北京擎科新业生物技术有限公司合成;其他常规试剂均为国产分析纯试剂。
MM400混合型碾磨仪(德国Retsch公司);Nanodrop 2000超微量分光光度计(美国Thermo公司);C1000TMThermal Cycler荧光定量PCR仪(美国BIO-RAD公司)。
1.2 方法
1.2.1 干旱和盐胁迫处理
烟草幼苗在MS培养基上长至4片真叶时,选取长势一致的幼苗分别移入含有0、1%和3%(质量体积比)NaCl的MS培养基上。正常条件下继续培养1周,收取全株幼苗,液氮速冻后用于总RNA的提取。将幼苗从MS培养基移栽到盆钵中,温室中生长,每周浇2次水,每次300 mL。待烟苗长至8片真叶时进行干旱处理,分别采集断水后0、2、4和6 d的烟草叶片[25-26],液氮速冻后用于总RNA的提取。
1.2.2 RNA提取和反转录
采用植物多酚RNA提取试剂盒提取烟草各组织RNA,实验操作严格按照产品说明书进行。在提取过程中,加入RNase-free DNase I消化可能残留的基因组DNA。提取完成后,各RNA样品的浓度和质量分别用Nanodrop 2000和琼脂糖凝胶电泳进行检测。选择质量检测合格且浓度较高的RNA样品用于cDNA第一链的合成,合成过程参照Gene Star M-MLV反转录试剂盒说明书。cDNA样品的浓度经Nanodrop 2000检测后,用ddH2O统一稀释至40 ng/μL,-20 ℃保存。
1.2.3 生物信息学分析
以BEL1-like homeodomain protein为关键词在中国烟草基因组数据库V4.0中进行检索,获得所有普通烟草中的候选BELLs基因。随后将所有候选基因编码的蛋白序列导入到Pfam软件(http://pfam.xfam.org/search)中进行功能域分析,选择同时包含SKY、BEL和HD功能域的基因作为烟草BELL家族基因。提取各NtBELLs基因的序列、染色体位置、外显子个数、核苷酸长度、蛋白质长度、蛋白分子量、等电点等信息。利用DNAMAN V6.0比对烟草BELLs基因编码蛋白的氨基酸序列,再利用 MEME 软件(http://meme-suite.org/)确定烟草BELLs基因3个保守功能域的氨基酸序列,用GSDS软件(http://gsds.cbi.p-ku.edu.cn/)分析基因的外显子/内含子结构,并绘图。
根据NtBELLs基因在烟草染色体上的位置信息,利用MapInsect软件进行染色体定位和图谱的绘制。用Clustal X软件比对不同物种中BELLs基因编码的氨基酸序列,比对完成后将结果导入MEGA5软件中,用Neighbor-joining方法构建BELLs基因的系统进化树。本研究中,用到其他物种的BELLs基因分别来自拟南芥(AtBEL10/AT1G19700、AtBLH5/AT2G27220、AtBLH3/AT1G75410、tBLH6/AT4G34610、AtBLH7/AT2G16400、AtBLH11/AT1G 75430、AtBEL1/AT5G41410、AtBLH4/AT2G23760、AtBLH2/AT4G36870、AtBLH1/AT2G35940、AtBLH8/AT2G27990、AtBLH9/AT5G02030、AtATH1/AT4G32 980)和马铃薯(StBLH5/PGSC0003DMP400010515、StBEL29/PGSC0003DMP400036956、StBEL11/PGSC 0003DMP400034115、StBEL13/PGSC0003DMP4000 17878、StBEL14/PGSC0003DMP400021824、StBEL22/PGSC0003DMP400038077、StBEL30/PGSC0003DMP 400053924、StBEL32/PGSC0003DMP400006695、StBE L33/PGSC0003DMP400041981、StBEL34/PGSC0003 DMP400014183、StBEL35/PGSC0003DMP400033253、StBEL6/PGSC0003DMP400052181、StBEL31/PGSC 0003DMP400006694)。
1.2.4 基因表达分析
利用荧光定量PCR(Quantitative real-time PCR,qRT-PCR)技术检测烟草NtBELLs基因在根、茎、叶等不同组织和胁迫条件下的表达,引物见表1。在冰上配制qRT-PCR反应体系:10 μL 2×SYBR Green Master、3 μL cDNA 模板(40 ng/μL)、上 下 游 引 物(10 μmol/L) 各 1 μL、5 μLddH2O,充分混匀后瞬时离心。qRT-PCR反应程序采用两步法,即95℃ 3 min;95℃ 10 s,60℃30 s,信号采集,45个循环。反应结束后运行溶解曲线程序(65~95℃)。以3株长势相近的烟草叶片作为1个独立的生物学重复,每个组织共设置3个生物学重复。qRT-PCR反应结束后,采用2-ΔCT或 2-ΔΔCT方法计算NtBELLs基因的相对表达量[27]。
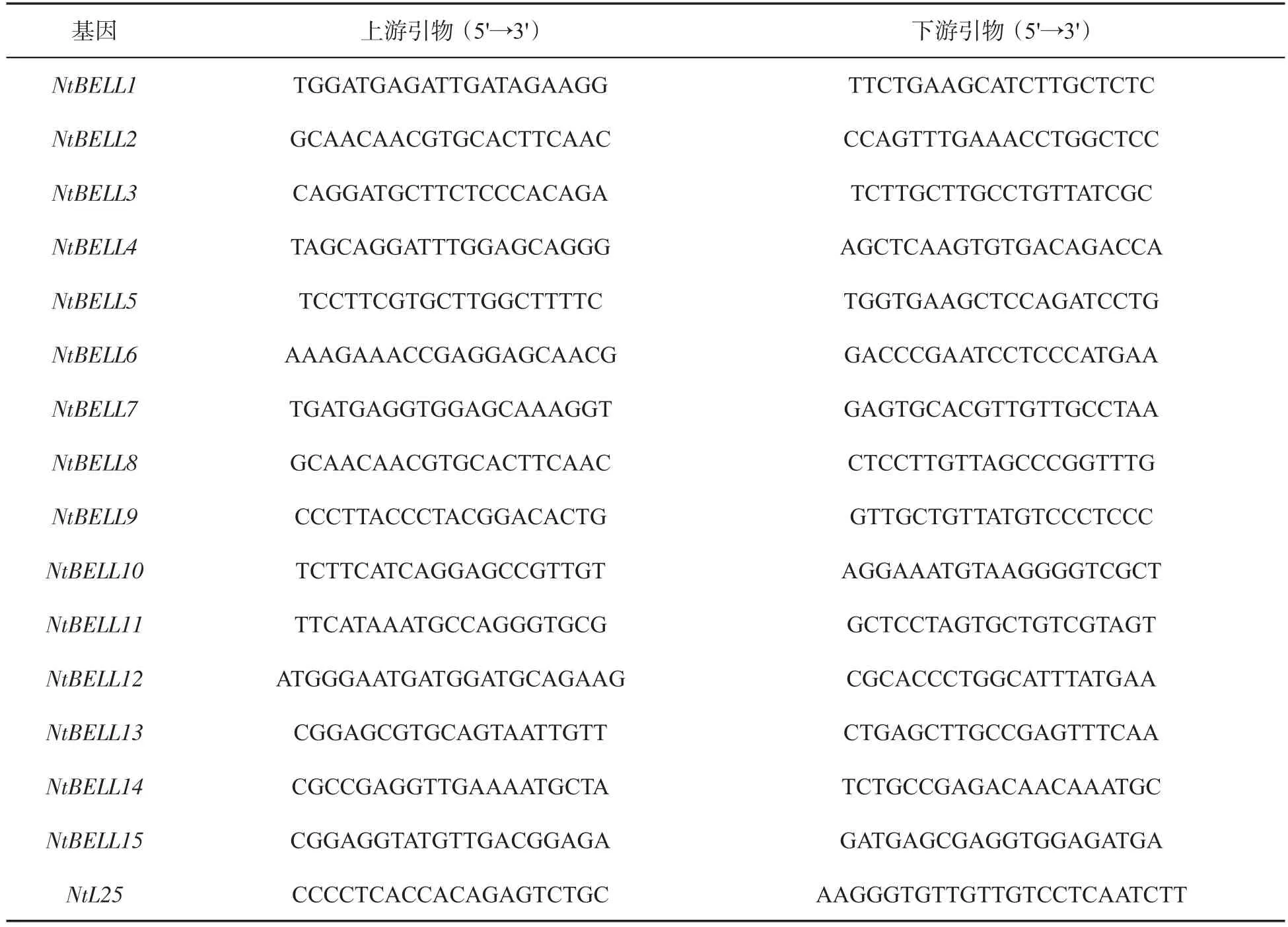
表1 NtBELLs基因引物Tab.1 Primers of NtBELL genes
2 结果与分析
2.1 烟草BELLs基因的鉴定
在中国烟草基因组数据库V4.0中,用BEL1-like homeodomain protein作为关键字进行检索后,共获得28个可能的BELLs基因。通过Pfam功能域分析发现,28个烟草BELLs基因均包含典型的SKY、BEL和HD结构域,属于BELL基因家族成员。由表2可知,NtBELLs基因含有3~8个外显子,大多数含有4个。NtBELL基因的编码区在1 299~2 289 bp之间,编码432~762个氨基酸,蛋白质分子量在48.81~82.99 kDa之间,等电点为4.88~9.15。
两两比对NtBELLs基因编码区序列和氨基酸序列的相似性(表3),根据相似性的高低,将NtBELLs基因分为15组,分别命名为NtBELL1~NtBELL15。其中,NtBELL7和NtBELL15各有1个拷贝,而其他NtBELLs基因都有两个相似性很高的拷贝。
2.2 烟草NtBELLs基因的染色体定位及进化分析
由图1可知,除3个定位在scaffold上的NtBELLs基因(Ntab0312290、Ntab0471080和 Ntab0547850)外,其余25个烟草NtBELLs基因分别分布在15条不同的染色体上。其中,7和22号染色体上分布的BELLs基因最多,各有3个。NtBELL8基因的两个拷贝(Ntab0734150和Ntab0815520)都分布在10号染色体上,而且二者序列相似性为100%,推测可能由染色体复制产生。NtBELL4和NtBELL5基因的两个拷贝都分别分布在5和22号染色体上,且相邻在一起,表明二者之间可能存在一定的连锁性。
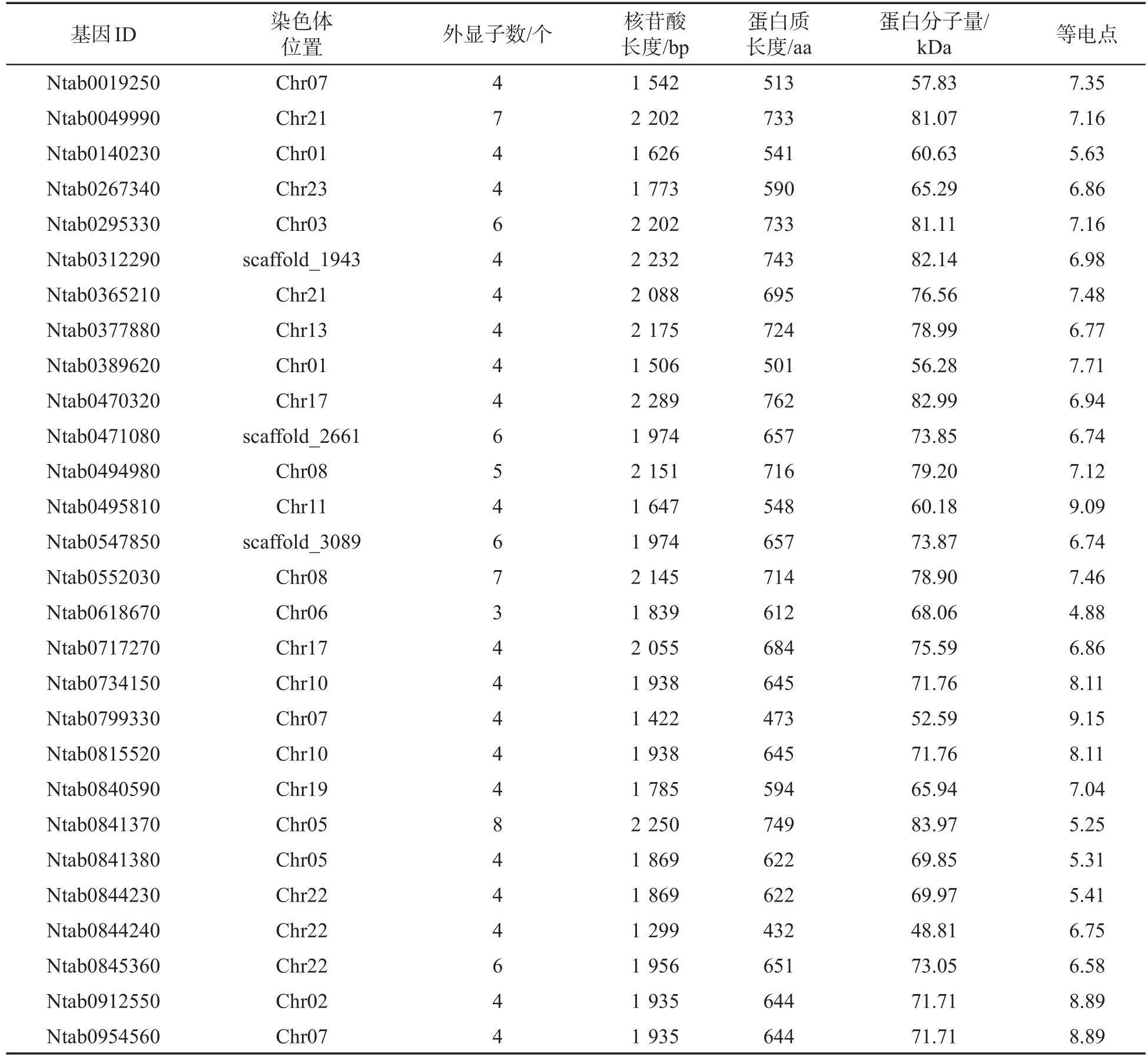
表2 普通烟草中BELLs的基因信息Tab.2 Information of BELL genes in Nicotiana tabacum
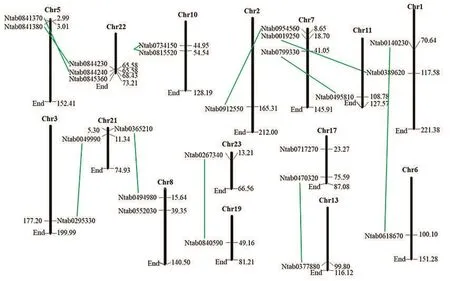
图1 NtBELLs基因在染色体上的分布Fig.1 Chromosome location of NtBELL genes
为进一步明确烟草BELL基因家族成员的进化关系和可能的生物学功能,根据烟草、拟南芥和马铃薯BELLs基因编码的氨基酸序列,构建BELL基因家族的系统进化树。由图2可知,BELL基因家族被分为4个组,即BELL-Ⅰ、Ⅱ、Ⅲ和Ⅳ。烟草NtBELL基因在4个组上的分布较为均匀,如BELL-Ⅰ和Ⅲ各有6个NtBELLs基因,BELL-Ⅱ有9个,BELL-Ⅳ有7个。拟南芥、马铃薯已有的BELLs基因功能研究结果表明,不同组的BELLs基因可能具有不同的生物学功能[11,13-15]。推测 BELL-Ⅰ组中的NtBELL1、NtBELL4和NtBELL5蛋白可能主要作为OVATE家族蛋白的伴侣发挥功能;BELL-Ⅱ组中NtBELL2、NtBELL3、NtBELL6、NtBELL7和 NtBE LL8蛋白主要参与根的生长;BELL-Ⅲ组中的BELLs蛋白主要参与分生组织的发育;BELL-Ⅳ组中的NtBELL14和NtBELL15蛋白可能参与调控胚珠的形态发育,而NtBELL11和NtBELL12蛋白则可能参与叶片的形态发育[1,11,15,28-29]。
2.3 烟草NtBELLs基因的结构及蛋白结构域分析
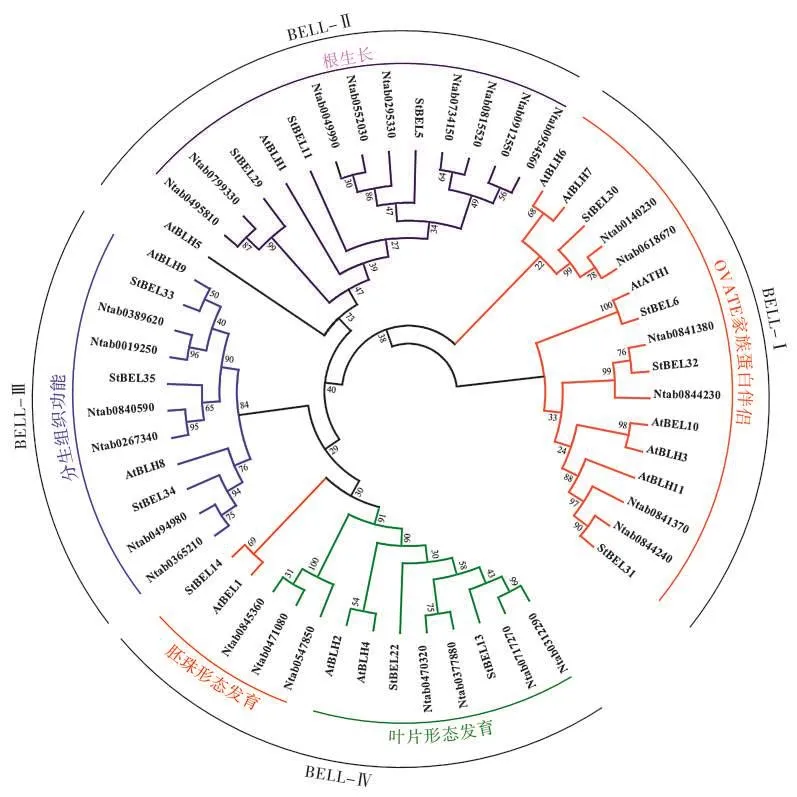
图2 BELL基因家族系统进化分析Fig.2 Phylogenetic analysis of BELL gene families in plants
烟草28个NtBELLs基因的长度差异非常大,最长的基因(Ntab0312290)有11 259 bp,而最短的基因(Ntab0844240)只有1 786 bp,大多数基因的长度在3~5 kb之间(图3)。典型的烟草NtBELLs基因由3个内含子和4个外显子组成,且外显子的长度(尤其是第2和第3个外显子)比较保守。NtBELL1、NtBELL2、NtBELL5、NtBELL8~NtBELL13 基因均包含4个外显子,其中第2个外显子的长度在322~400 bp之间,第3个外显子长度在61 bp左右。其他NtBELLs基因的结构则是在此基础上发生了内含子的插入,形成更多的内含子和外显子结构。例如,NtBELL3基因的第1、2和4号外显子中间分别插入了1个内含子,形成了6个内含子和7个外显子的结构。不同NtBELLs基因同一内含子的长度差异很大,同一NtBELL基因的不同内含子长度也有较大的差异。不同NtBELLs基因中,第1个内含子的长度为300~3 000 bp;NtBELL14基因所有内含子的长度在92~4 700 bp之间。NtBELLs基因内含子长度的差异可能与基因的选择性剪切有关。
比对烟草NtBELLs蛋白的氨基酸序列后发现,有两个保守性很高的区域(图4A),分析发现其分别包含BELLs蛋白的3个典型功能域,即SKY、BEL和HD。用MEME软件进一步分析这3个功能域在所有烟草NtBELLs蛋白中的保守氨基酸(图4B),发现保守性最高的是HD功能域。3个功能域在NtBELLs基因上的分布位置也非常保守,SKY分布在第1和第2个外显子上,BEL和HD功能域连在一起,分布在第2、3和4个外显子上。
2.4 烟草NtBELLs基因的表达模式分析
检测了NtBELLs基因在普通烟草盛花期根、茎、叶、花蕾、花和果实中的表达水平(图5)。几乎每个NtBELLs基因都有两个拷贝(除NtBELL7和NtBELL15),引物设计时很难将同一基因的不同拷贝区分开,因此选择在基因保守区段设计两个拷贝的通用引物。在烟草根、茎、叶、花蕾、花和果实等组织中都能检测到NtBELLs基因的表达,但是不同组织中NtBELLs基因的表达量有明显差异。在根中,NtBELL2、NtBELL3和NtBELL7基因的表达水平明显高于其他NtBELLs基因;在茎中,表达量最高是 NtBELL1、NtBELL2、NtBELL8和 NtBELL13基因;在叶中表达量最高的是NtBELL11和NtBELL12基因;在花中,NtBELL5、NtBELL6、NtBELL11 和NtBELL12基因的表达水平均较高;而在果实中表达水平最高的是NtBELL14和NtBELL15基因。基因表达水平的巨大差异预示着不同的NtBELLs基因可能在烟草各个组织发育中发挥着不同的生物学功能。
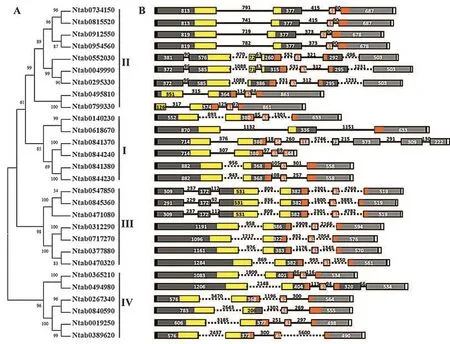
图3 烟草NtBELLs基因的外显子和内含子Fig.3 Exons and introns of NtBELL genes
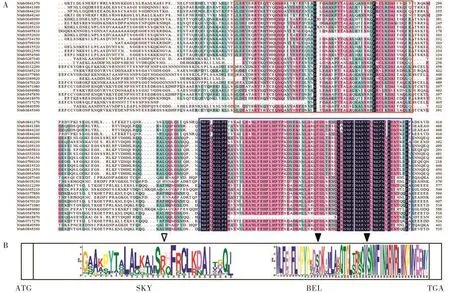
图4 烟草NtBELLs蛋白功能域分析Fig.4 Functional domain analysis of NtBELL proteins
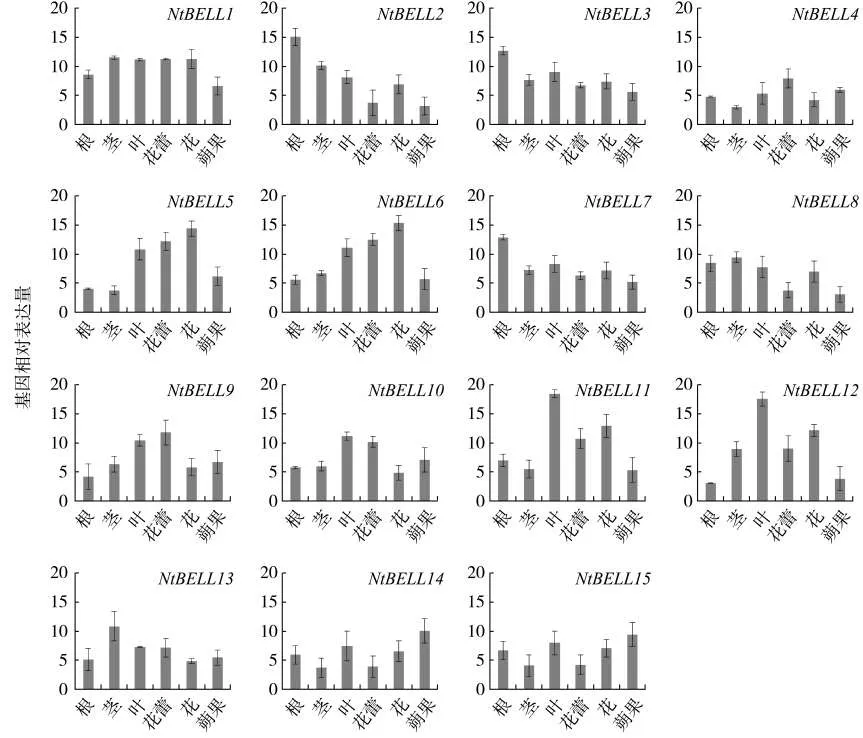
图5 不同组织中NtBELLs基因的表达水平Fig.5 Expression levels of NtBELL genes in different tobacco tissues
为探究NtBELLs基因在烟草抵御环境胁迫过程中的功能,分别检测了NtBELLs基因在干旱和盐胁迫处理条件下的表达水平。如图6所示,大多数NtBELLs基因的表达水平在干旱条件下没有明显变化。与0 d相比,NtBELL2基因的表达水平在干旱处理2 d时升高了两倍,随后一直保持在两倍以 上 的 水 平 。 NtBELL4、NtBELL8、NtBELL10和NtBELL13基因的表达水平都是在干旱处理4 d时开始升高,6 d时达到更高的水平。其中,NtBELL8基因的表达水平在6 d升高了3倍,是所有基因中变化量最大的。干旱胁迫诱导NtBELL8基因的表达水平显著上调,表明其可能参与了烟草的抗旱过程。
NaCl胁迫处理实验发现,不同浓度NaCl对烟草NtBELLs基因表达水平的影响不同。1%NaCl胁迫处理下,所有NtBELLs基因的表达水平都没有明 显 变 化 ,但 是 NtBELL2、NtBELL3、NtBELL6、NtBELL13和NtBELL15基因的表达水平在3%NaCl处理条件下被明显上调(图7),尤其是NtBELL6基因的表达水平被上调了3倍。
3 讨论
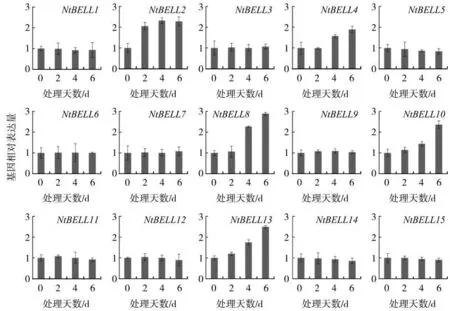
图6 干旱条件下烟草NtBELLs基因的表达水平Fig.6 Expression levels of NtBELL genes under drought treatment
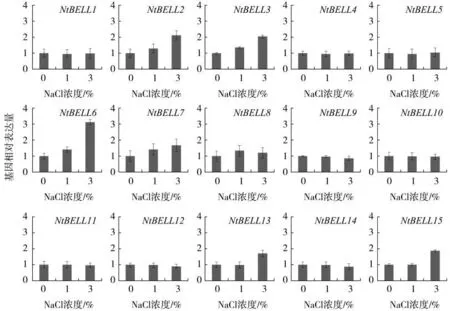
图7 NaCl胁迫下烟草NtBELL基因的表达水平Fig.7 Expression levels of NtBELL genes under NaCl stress
研究表明,多基因家族各成员之间的功能往往会发生明显的分化,系统分析基因家族各成员的序列特征、进化关系、表达模式等可为研究其功能提供指导[30-32]。AtBELLs各成员分别参与了不同组织器官的分化。如AtBLH2(AT4G36870)和AtBLH4(AT2G23760)在拟南芥的叶片、茎、花药等多个组织中表达,在atblh2atblh4的双突变体中,KNOX家族的BP(BREVIPEDICELLUS)基因异位表达,导致突变体叶片呈现卷曲的锯齿状[5,33]。而AtBLH8(AT2G27990)和AtBLH9基因(AT5G02030)的突变体表现出花序节间异常,角果畸形簇生,表明二者能够调控拟南芥花序原基的生长[17,34]。根据拟南芥[13-15]、玉米[9]、马铃薯[11]等已有的同源基因研究信息,本研究中对烟草NtBELLs各成员的功能进行了初步的划分(图2)。NtBELL9、NtBELL10和NtBELL13基因与拟南芥AtBLH8和AtBLH9基因的亲缘关系较近,推测NtBELL9、NtBELL10和NtBELL13基因可能参与调控烟草分生组织;NtBELL11和NtBELL12基因与AtBLH2和AtBLH4基因聚类在一起,表明可能与烟草叶片发育有关;NtBELL2、NtBELL3、NtBELL6、NtBELL7和 NtBELL8基因与ATBLH、StBELL5、StBELL11等基因的同源性较高,表明可能参与根的生长及通过调控ABA信号影响种子萌发和幼苗的形态建成[11,14];NtBELL14和NtBELL15基因与拟南芥AtBEL1基因的亲缘关系很近,后者被证实能够通过调控激素信号影响拟南芥胚珠的发育[19,35]。随后,基因的表达模式分析也在一定程度上证实了NtBELLs基因功能的同源预测。例如,与叶片发育有关的NtBELL11和NtBELL12基因在叶片中的表达水平最高,与根生长相关的NtBELL2、NtBELL3和NtBELL7基因在根中的表达水平明显高于其他基因,而与胚珠发育相关的NtBELL14和NtBELL15基因则只在果实中有较高表达。因此,结合同源基因比较和基因表达模式分析,初步确定了烟草各NtBELLs基因的功能,为后续研究NtBELLs调控烟草植株发育提供参考和依据。
同时,还发现干旱和NaCl胁迫能够显著诱导部分NtBELLs基因的表达,表明该基因家族可能参与了植物抵御非生物胁迫的过程。研究发现,玉米中一些胁迫响应相关基因的表达可能分别受多个ZmBELLs的调控[9],但目前尚没有BELLs基因改变植物抗性的报道。因此,NtBELLs基因调控烟草组织发育和抗性还需进一步验证。
4 结论
通过同源比对和功能域分析,从普通烟草基因组中共鉴定出28个BELLs基因,根据其序列相似性及进化关系,分别将其命名为NtBELL1~NtBELL15。所有NtBELLs基因编码的蛋白都包含SKY、BEL和HD功能域,3个功能域的序列及在基因上的分布位置都高度保守。系统进化分析表明,烟草NtBELLs基因被明显分为4组,每组中的NtBELLs参与了烟草不同的发育过程。NtBELLs基因在不同烟草组织中的表达模式与基因功能预测基本一致。部分NtBELLs基因的表达水平受干旱和NaCl胁迫诱导,表明BELL基因家族可能在烟草抵御非生物胁迫过程中发挥重要作用。
