正交设计优选大麻药总皂苷提取工艺
2020-02-08陈旅翼黄利豪兰洲刘鹏梅之南
陈旅翼,黄利豪,兰洲,刘鹏,梅之南
(1 中南民族大学 药学院, 武汉 430074;2湖北中医药大学 药学院, 武汉 430065)
大麻药(Radix Dolichosae)为豆科植物镰扁豆(DolichosappendiculatusHand.-Mazz)的干燥根.镰扁豆别名麻三段、大九荚、镰叶山扁豆等,主要分布于云南、四川、甘肃、广东等地,尤以云南为多.本品性辛、麻、温,有小毒[1,2],归肺、心经.具有“通气活络,活血止血,消肿止痛,接骨生肌”的功效[3].现代研究还发现大麻药具有利尿、抗痛风、抗肿瘤、抗癌等功效[4-7],其主要化学成分为三萜皂苷、生物碱、黄酮等[8-13].
痛风是嘌呤代谢紊乱引起的一种代谢性疾病。近年来,随着生活习性与饮食结构的改变,痛风的发病率呈逐年上升和年轻化趋势.目前痛风的治疗还局限于缓解急性期的疼痛,和降低血尿酸浓度.而临床所用一线药多具不良反应[14],前期研究发现大麻药总皂苷在抗痛风和治疗心血管系统等疾病方面发挥重要功效,且含量较高.本实验旨在探究大麻药总皂苷提取的最佳工艺[15,16],为工业化生产提供科学依据.
1 仪器与材料
旋转蒸发器、恒温水浴锅(上海亚荣);循环水式多用真空泵(上海贝茵); DHG-9030A鼓风干燥箱(上海一恒);UPH-I-10T实验室超纯水制造系统(成都优普);电子天平(奥豪斯仪器);紫外分光光度计(UV -1800PC, Mapada).
大麻药经中南民族大学药学院陈旅翼副教授鉴定为豆科植物镰扁豆(DolichosappendiculatusHand.-Mazz)的根(批次:云南昆明20170801).大麻药粉碎,过4号筛,粉末备用.大麻药苷B对照品(实验室自制,纯度≥98.0%);无水乙醇、分析纯乙酸、高氯酸、乙酸乙酯均购自国药集团;香草醛(AR,aladdin,批号:43885)
2 方法与结果
2.1 总皂苷含量测定方法学
2.1.1 对照品溶液的制备
大麻药苷B对照品(面积归一法≥98.0%,如图1所示)5.5 mg放于5 mL容量瓶,甲醇定容,超声溶解,放冷,补足重量.配制成1.1 mg/mL的对照品溶液.
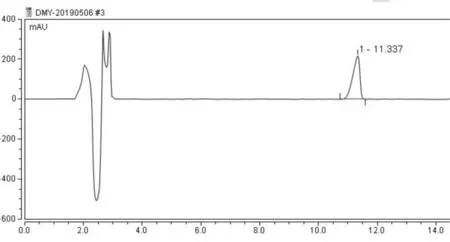
图1 大麻药苷B对照品HPLC图Fig.1 HPLC chromatograms of doliroside B
2.1.2 供试品溶液的制备
大麻药药材粉末50.0 g,加10倍量90%乙醇,浸渍1 h,88 ℃下乙醇回流提取2次,每次2 h,将滤渣及滤器洗涤,合并提取液,定容至1000 mL.
2.1.3 测定波长的选择
取对照品溶液分别置15 mL具塞试管中,挥干,放冷,加入5%香草醛冰醋酸溶液0.2 mL,高氯酸0.8 mL,摇匀,在70 ℃水浴中加热15 min,立即置冰浴中冷却5 min,取出,加入乙酸乙酯适量,摇匀,以相应试剂为空白对照,在400~700 nm波长范围内进行扫描,最终确定在562 nm处有最大吸收,结果如图2所示.
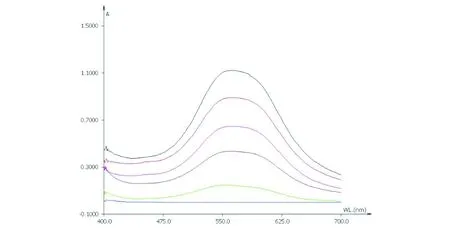
图2 大麻药苷B对照品最大吸收波长扫描图Fig.2 Scanning chart of doliroside B reference
2.1.4 线性关系考察
分别取对照品溶液0.1、0.2、0.3、0.4、0.5 mL,按2.1.3方法在562 nm波长处测定吸光度,以吸光度为纵坐标、浓度为横坐标绘制标准曲线(图3).结果表明,质量浓度在13.75~68.75 mg/L范围内,线性关系良好.回归直线方程为A=19.964C-0.0595,相关系数(R2)为0.9989.

图3 大麻药苷B标准曲线Fig.3 standard curve of doliroside B
2.1.5 精密度、稳定性及重复性考察
取对照品溶液0.2 mL,按2.1.3方法测定吸光度,连续测定6次,以吸光度(A)计算,结果表明,RSD为0(表1).这表明仪器精密度良好.
表1 精密度试验
Tab.1 Precision test

序号吸光度平均值RSD/%10.47820.47830.4780.478040.47850.47860.478
取同一供试品溶液0.05 mL,置15 mL具塞试管,分别于制备后0、15、30、45、60、90、120 min按2.1.3方法测定吸光度,结果显示RSD为0.62%,表明该方法在2 h内稳定性良好(表2).

表2 稳定性试验Tab.2 Stability test
取同一批药材6份,照上述方法制备供试品溶液,取0.05 mL按2.1.3方法测定吸光度,结果显示RSD为1.74%,表明方法重复性良好(表3).

表3 重复性试验Tab.3 Replicate test
2.1.6 加样回收率试验
已知含量的供试品溶液6份,加入对照品溶液(1.1 mg/mL)0.1 mL, 按2.13方法测定吸光度,计算得平均回收率为100.77%.RSD为0.68%(表4),显示该方法回收率良好,结果准确可信.
表4 大麻药总皂苷加样回收率
Tab.4 Recovery test for determination of total saponins from Radix Dolichosae

序号样品中总皂苷含量/mg加入对照品量/mg吸光度回收率/%平均值/%RSD/%10.097980.11000.638101.5020.100080.11000.63999.8530.097080.11000.632100.68100.770.6840.097680.11000.635100.9550.096480.11000.628100.1360.095580.11000.630101.49
2.2 药材中总皂苷含量测定
2.2.1 供试品溶液的制备
大麻药粉末3份,每份2.0 g,分别至150 mL具塞锥形瓶中,加70%乙醇50 mL,超声处理(25 ℃,功率200 W,频率42 Hz)45 min,过滤,滤液置100 mL容量瓶中,用适量70%乙醇分次洗涤滤器和滤渣,洗液并入同一量瓶中,加乙醇至刻度,摇匀.
2.2.2 供试品溶液含量测定
取0.05 mL供试品溶液,按2.1.3方法测定吸光度,根据标准曲线计算总皂苷含量.取10 mL供试品溶液,用差减法测定超声提取物含量.结果测得大麻药总皂苷得率为12.31%,纯度为79.54%,结果见表5.

表5 大麻药总皂苷含量Tab.5 Content of total saponins of Radix Dolichosae
2.3 大麻药总皂苷提取单因素考察
2.3.1 乙醇浓度的影响
称取大麻药粉末50.0 g,分别加入浓度为70%、80%、85%、90%、95%的8倍量乙醇(以药材质量计),浸渍1 h,88 ℃下回流提取2 h,连续2次,合并滤液.取0.03 mL于15 mL具刻度试管,挥干,按2.1方法测定,计算大麻药总皂苷提取率和纯度.结果如图4所示.分析可知70%、80%乙醇浓度下大麻药总皂苷提取率较高,但70%、80%乙醇提取下所得提取物浓缩困难,难以形成浸膏,对后续除杂、干燥产生较大影响,不利于工业生产。
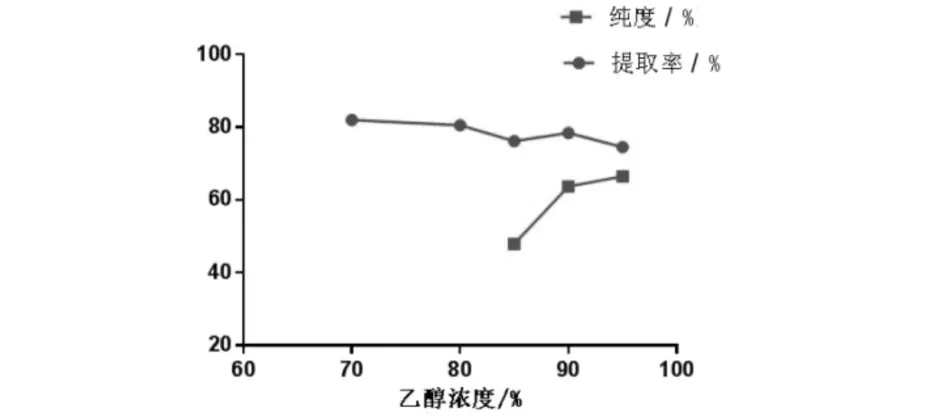
图4 乙醇浓度对大麻药总皂苷提取率和纯度的影响Fig.4 Effect of ethanol concentration on extraction rate and purity of total saponins
对比90%和95%乙醇提取率和纯度,将提取率和纯度两个考察指标各赋50%,得到90%乙醇浓度下为71.11%,95%为70.52%.故选择产品便于处理且提取率和纯度相对较高的90%乙醇浓度.
2.3.2 料液比的影响
称取大麻药50.0 g,分别加入6、8、10、12倍量(以药材质量计)的90%乙醇.按上述方法处理后,测定吸光度并计算大麻药总皂苷提取率和纯度.结果如图5所示.据图同样对料液比1∶8和1∶10各赋50%,综合得到8倍量时为72.34%,10倍量时为70.98%,故选择料液比1∶8进行后续实验.

图5 不同料液比对大麻药总皂苷提取率和纯度的影响Fig.5 Effect of different ratio of solid to liquid on extraction rate and purity of total saponins
2.3.3 提取时间的影响
大麻药粉末50.0 g,乙醇浓度90%,料液比1∶8,提取2次,浸渍1 h,88 ℃下分别回流提取1、2、3、4 h.取0.03 mL提取液按2.1方法测定并计算大麻药总皂苷提取率和纯度.从图6可看出大麻药总皂苷得率和提取率在提取2 h时最高.因此选择提取时间为2 h.

图6 提取时间对大麻药总皂苷提取率和纯度的影响Fig.6 Effect of extraction time on extraction rate and purity of total saponins
2.3.4 提取次数的影响
取大麻药粉末50.0 g,加入8倍量90%乙醇,浸提1 h,88 ℃下分别回流提取1~4次,每次2 h.取提取液适量测定并计算大麻药总皂苷提取率和纯度.结果发现2次提取后提取率和纯度增加幅度较大,而2次与3次提取增幅较小(图7). 考虑工业成本,选择提取2次更符合实际.
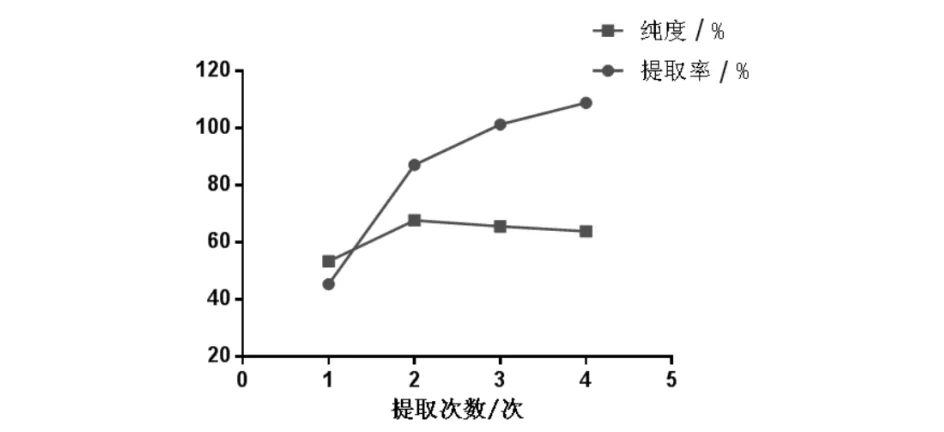
图7 提取次数对大麻药总皂苷提取率和纯度的影响Fig.7 Effect of extraction times on extraction rate and purity of total saponins
2.4 正交实验设计及结果分析
2.4.1 正交实验设计
在单因素实验结果的基础上以大麻药总皂苷提取率和纯度为评价指标设计L9(34)正交表,对乙醇浓度(A)、料液比(B)、提取时间(C)、提取次数(D)进行考察,并下设3个较优水平(表6).

表6 正交实验因素水平表Tab.6 Orthogonal test factors and levels
2.4.2 正交实验结果及分析
大麻药总皂苷提取率及纯度正交实验结果见表7.方差分析提取率结果见表8,总皂苷提取纯度结果见表9.
由表7极差分析结果看出,提取次数对大麻药总皂苷提取得率影响较大,4个因素影响顺序为提取次数>乙醇浓度>料液比>提取时间,以提取率为考察指标最佳工艺为90%乙醇、料液比1∶10、提取时间2 h、提取次数2次.以大麻药提取的总皂苷纯度为评价指标,4个因素对其影响顺序为乙醇浓度>提取次数>提取时间>料液比,最佳工艺为95%乙醇、料液比1∶10、提取时间2 h、提取次数2次.将提取率和提取纯度两个考察指标综合考虑,各赋50%,得出90%乙醇浓度下评价值为76.905%,95%乙醇浓度下为76.685%,综上结果最终确立大麻药总皂苷提取的最佳工艺为90%乙醇、料液比1∶10、提取时间2 h、提取次数2次.
从方差结果分析,提取次数的改变对总皂苷提取率影响较大,其他因素水平的改变对实验结果也有一定影响.相对提取纯度,则乙醇浓度的改变对结果影响较大.综合考虑极差分析和方差分析,优选出大麻药总皂苷提取工艺为 90%乙醇、料液比1∶10、提取时间2 h、提取次数2次.
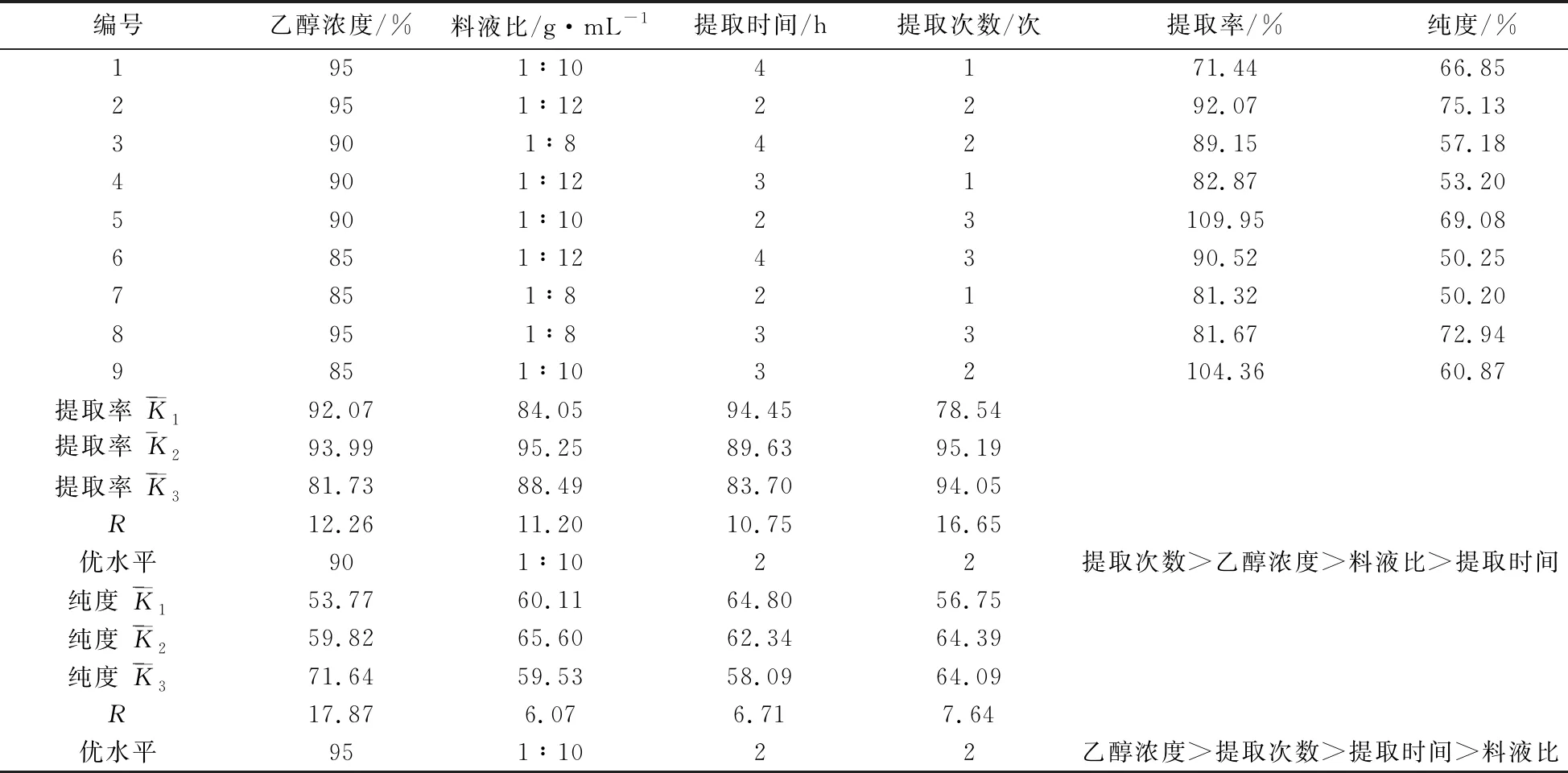
表7 正交实验结果和极差分析

表8 提取率的方差分析Tab.8 Analysis of variance with extraction rate
注:F0.10(2,2)=9.00,F0.05(2,2)=19.00,F0.01(2,2)=99.00
表9 提取纯度的方差分析
Tab.9 Analysis of variance with extraction purity

因素偏差平方和自由度均方F值显著性乙醇浓度1409.3952704.69732.133**料液比181.724290.8624.143提取时间172.717286.3583.938提取次数362.6742181.3378.269误差394.7461821.930
注:F0.10(2,2)=9.00,F0.05(2,2)=19.00,F0.01(2,2)=99.00
2.4.3工艺验证实验
取药材50.0 g,共3份,粉碎,过4号筛,按优选出的工艺进行3次验证实验,测定大麻药总皂苷提取率及纯度.所得结果见表10,大麻药总皂苷平均综合值为77.475%.表明该工艺稳定,可行性且重复性好.

表10 验证实验结果Tab.10 Results of validation test
3 结语
通过以上单因素考察和正交优化,基本确立了大麻药总皂苷提取的最佳工艺为90%乙醇浓度、料液比1∶10、提取时间2 h、提取次数2次.该工艺重复性和稳定性好,所得提取率及纯度较高,总皂苷提取率高达80%左右,提取纯度达70%以上.后续将在此工艺的基础上继续开展中试放大研究,从而对该工艺的工业化生产的可行性进行验证,以期达到操作简单、成本低廉、条件稳定、产率及纯度较高的预期.