华癸中慢生根瘤菌多铜氧化酶基因mco的功能研究
2020-02-08程国军邹倩吴和涛罗莎
程国军,邹倩,吴和涛,罗莎
(中南民族大学 生命科学学院,微生物资源与利用湖北省工程技术研究中心,武汉 430074)
生物固氮是指固氮微生物将大气中的氮转变成氨,供植物利用. 华癸中慢生根瘤菌7653R是一类能够与豆科植物紫云英形成不定型根瘤的革兰氏阴性细菌,属于α-变形菌纲[1]. 它与宿主形成的共生固氮体系,不仅能够自身固氮,而且也是农业中最大的自然氮源[2].
多铜氧化酶(multicopper oxidase, MCO)又称蓝色氧化酶,能够将多种底物氧化,包括酚类化合物和金属,并且将O2还原为H2O[3]. 多铜氧化酶家族包括漆酶、抗坏血酸氧化酶、亚铁氧化蛋白、胆红素氧化酶、亚铜氧化蛋白、金属氧化酶以及铜蓝蛋白[4]. MCO对多种生理过程至关重要,包括木质素的形成,木质素的降解,抗菌素对真菌的解毒作用,色素沉着以及细菌中的铜抗性,且与病菌的致病性有密切联系,参与病原菌的侵染、扩散等过程[5]. 生物体在正常的生理代谢中,可以通过有氧代谢将O2转化为H2O,但当O2不能够被及时充分还原时,就会产生活性氧(ROS),并且在环境胁迫下,也会导致ROS的产生. 生物体本身具有复杂的抗氧化系统来清除产生的ROS,但当ROS的量超过生物体自身的清除能力时,就会导致细胞的氧化损伤[6]. 研究表明大肠杆菌的多铜氧化酶CueO突变体对铜的敏感性与氧化应激有关[7]. 结核分枝杆菌中的多铜氧化酶MmcO蛋白表现出对黄嘌呤-黄嘌呤氧化酶系统中生成的ROS的清除活性,并且具有清除活化THP-1细胞中生成的ROS的能力[8].
多铜氧化酶可以将O2转化为H2O,且不会释放活性氧,降低了氧含量,免除细胞受活性氧的影响[9].MCO在造纸、纺织、化工和食品工业中有巨大的应用,且能参与根瘤菌和豆科植物共生对重金属污染的土壤进行的生物修复[10],但MCO在根瘤菌共生固氮和抗氧化方面的功能及其作用机制还有待深入研究. 本研究在对mco基因进行生物信息学分析的基础上,构建M.huakuiimco基因突变株,进一步研究了mco基因突变对根瘤菌的生长、抗氧化能力的影响以及与紫云英共生过程中的功能,为阐明多铜氧化酶在根瘤菌中的功能及其作用机制奠定了基础.
1 材料与方法
1.1 菌株质粒与培养基
菌株及质粒见表1. 培养根瘤菌所用的培养基是TY完全培养基和AMS基本培养基,培养大肠杆菌所用的培养基是LB培养基,所用的抗生素浓度为卡那霉素(Km)20 μg/mL,四环素(Tc)2 μg/mL,新霉素(Neo)80 μg/mL,链霉素(Str)500 μg/mL.
1.2 主要仪器与试剂
限制性内切酶(XbaI、Hind Ⅲ等)、T4 DNA连接酶、TaqDNA聚合酶、DL 2000 DNA Marker、ExTaq酶等(TaKaRa公司);DNA凝胶回收试剂盒、高纯度质粒DNA小量试剂盒(TsingKe公司);PCR仪(Biometra公司);725型紫外可见分光光度计(上海光谱仪器);HT7700型扫描电镜(日立公司).

表1 菌株,质粒及PCR引物Tab.1 The strains, plasmids and PCR primers
注:下划线为引物序列中的限制性酶切位点
1.3 目的基因的生物信息学分析
根据目的基因的ID名称在NCBI查找目的基因编码的蛋白质序列及名称,然后利用NCBI中的Blastp在线软件对其氨基酸序列进行同源比对分析.
1.4 基因突变体的构建
参考周艳琳等[14]的方法构建突变体,具体步骤如下:先提取华癸中慢生根瘤菌7653R的总DNA以及pK19mob的质粒DNA,再以华癸中慢生根瘤菌7653R的总DNA为模板,mco的上游引物mcoF和下游引物mcoR进行PCR扩增,对扩增得到的片段进行回收. 将回收的mco基因片段与pK19mob载体分别经过XbaI和Hind Ⅲ双酶切,再用T4 DNA连接酶连接过夜. 然后将酶连产物转入大肠杆菌感受态DH5α,转化子经过酶切和测序验证正确后,获得阳性转化子pKmco. 以华癸中慢生根瘤菌7653R为受体菌,大肠杆菌pKmco为供体菌,含有pRK2013质粒的大肠杆菌为辅助菌进行三亲本杂交,经过抗生素筛选排除假阳性及以mcoMap和pK19A为引物的PCR验证后,获得mco基因突变株HKmco.
1.5 菌株生长曲线的测定
参照程国军等[15]的方法测定菌株生长曲线,详细过程如下:将野生型根瘤菌7653R和突变体菌株HKmco接种于含有相应抗生素的TY斜面上,于30 ℃培养2 d后用AMS液体培养基洗脱,并接种于AMS液体培养基中,使其初始OD600值至0.01,每个菌做3组重复. 置于30 ℃、180 r/min的摇床中振荡培养,每隔12 h取样测一次OD600值,记录数据,并绘制生长曲线.
1.6 根瘤菌抗氧化活性的测定
将已经活化好的华癸中慢生根瘤菌7653R和突变体HKmco接种到TY固体斜面培养基上,于30 ℃恒温培养3 d后,用无菌水进行洗脱并稀释,使其OD600值为1. 将100 μL菌液涂布在AMS固体培养基上,等待菌液彻底风干. 再将浸有不同浓度H2O2和CUOOH的圆形滤纸片分别放置在平板的正中央,每个平板只放一张滤纸片,每组实验均3组重复. 将放有滤纸片的平板正置于30 ℃培养箱中培养36 h后,观察抑菌圈大小并测量其直径.
1.7 根瘤菌固氮酶活的测定
无菌蛭石种植紫云英[16],先将蛭石清洗、晾干后,装入塑料烧杯中,加入适量无氮的紫云英营养液,用锡箔纸封口,121 ℃灭菌1 h. 紫云英种子先用75%的乙醇浸泡5 min,再用2%的次氯酸钠溶液浸泡30 min. 用无菌水清洗10次,无菌水浸泡5 h后,再用无菌水清洗3~4次. 挑取大而饱满的种子置于琼脂上,置于暗环境中倒置培养2 d. 待种子发芽后,将其播种于无菌的蛭石烧杯中,加入适量无氮的紫云英营养液,每颗紫云英根部接种1 mL菌液,保鲜膜封口,每个菌3组重复. 将其放在光照培养箱中培养,培养4周后,统计根瘤数量,并用乙炔还原法测定根瘤固氮酶活性[17]. 为了研究mco基因突变后对侵染紫云英形成根瘤的影响,将根瘤用甲苯胺蓝染色后制成石蜡切片,并用光学显微镜观察切片,进一步用扫描电镜观察根瘤含菌细胞的内部结构.
2 结果与分析
2.1 mco基因的生物信息学分析
将mco基因编码的氨基酸序列在NCBI中利用Blastp进行同源比对,结果如图1所示,华癸中慢生根瘤菌7653R中的mco基因(MCHK_7191)大小为700 bp.mco基因编码的蛋白质是多铜氧化酶,属于Suf I超家族,该家族是具有3个铜氧还蛋白结构域的多铜氧化酶,在染色体分配、细胞分裂、细胞周期控制、无机离子转运和代谢方面发挥重要作用. 多铜氧化酶能够将氧气转变成水,并清除活性氧,使细胞免受活性氧的影响,在植物抗氧化能力和生物修复方面发挥重要作用.
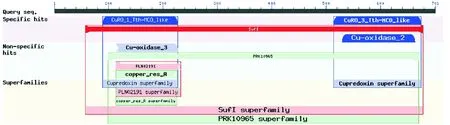
图1 华癸中慢生根瘤菌7653R中MCO蛋白结构域分析Fig.1 Analysis of the protein domains of MCO in M. huakuii 7653R
2.2 紫云英根瘤菌mco基因突变株的构建
以华癸中慢生根瘤菌7653R的总DNA为模板,mcoF/mcoR为引物扩增出700 bp左右的目的片段(图2). 扩增片段与载体pK19mob经双酶切后连接,转入大肠杆菌感受态DH5α. 转化子经过质粒酶切及测序验证正确后,经过三亲本杂交,最后通过抗性筛选及以mcoMap/PK19A或mcoMap/PK19B为引物进行PCR验证,扩增出了1.2 kb左右的片段(图3),mco基因缺失突变株HKmco构建成功.

M) DL2000 DNA Marker;1) mco 基因图2 mco基因的PCR扩增Fig.2 Identification of mco gene by PCR

M) DL2000 DNA Marker; 1)7653R;2) Hkmco;3)7653R;4) HKmco图3 Hkmco菌落PCR验证Fig.3 Verification of Hkmco by conlony PCR
2.3 mco基因突变对菌株生长的影响
将野生型根瘤菌7653R和构建的突变体HKmco分别接种于AMS培养基中,使其初始OD600值为0.01,每隔12 h取样测OD600值,绘制生长曲线. 如图4所示,突变体与野生型菌株的生长趋势基本一致,表明mco基因突变对根瘤菌在AMS培养基上的生长没有影响.

图4 7653R和HKmco菌株在AMS培养基中的生长情况Fig.4 The growth of M. huakuii 7653R and HKmco in AMS medium
2.4 mco基因突变对根瘤菌抗氧化能力的影响
将野生型7653R和HKmco突变体用无菌水洗脱并适当稀释后,涂布于AMS平板上,在平板正中央放置沾有不同浓度的H2O2和CUOOH的滤纸片,培养36 h,测量抑菌圈直径. 结果如表2所示,在沾有浓度为0.5、5 mmol/L的H2O2的滤纸片周围,HKmco形成的抑菌圈直径大小与野生型华癸中慢生根瘤菌7653R在同一浓度H2O2的滤纸片周围形成的抑菌圈直径相比没有显著差异;但是对于浓度为0.1、1 mmol/L的CUOOH,HKmco突变体形成的抑菌圈直径为4.73、6.80 cm,显著大于野生型华癸中慢生根瘤菌7653R在同浓度的CUOOH滤纸片周围形成的抑菌圈. 结果表明,mco基因突变不会影响紫云英根瘤菌抗无机氧化物H2O2的能力,但是会严重影响紫云英根瘤菌抗有机氧化物CUOOH的能力.

表2 不同浓度H2O2和CUOOH的抑菌能力Tab.2 Tolerance of stains to different concentrations of H2O2and CUOOH
注:*表示在0.05水平上mco基因突变株与野生型7653R存在显著差异
2.5 mco基因突变对根瘤菌共生固氮的影响
将紫云英接种菌液,置于光照培养箱中培养4周后取出,统计根瘤数量,并用乙炔还原法测定根瘤固氮酶活性. 结果表明接种突变株HKmco的紫云英形成的根瘤数量与接种野生型7653R的紫云英相比无显著差异,但是与野生型相比,接种HKmco突变体的紫云英根瘤的乙炔还原活性降低了29.8%(表3). 石蜡切片结果如图5 A和B所示,在接种野生型根瘤菌的根瘤中,细胞形态比较规则,大部分细胞大而饱满,含菌细胞数量较多. 而突变体的根瘤内部的含菌细胞数量明显减少,且细胞外部形态有些许变形. 扫描电镜观察根瘤菌含菌细胞的内部结构,结果如图5 C和D所示,在相同的放大倍数下,野生型7653R根瘤内部的类菌体形状规则,大多呈长条形,而接种突变体HKmco根瘤类菌体形态不规则. 研究结果表明,mco基因突变会减少根瘤含菌细胞数量,并导致其固氮活性降低,mco基因在根瘤菌固氮方面发挥着重要的作用.

表3 HKmco的共生性状Tab.3 Symbiotic phenotype of 7653R and HKmco
注:数据是3次重复的平均值,每列数值后面的相同字母表示在0.05水平上没有显著差异(P≤0.05),n为对照,未接种

A)、 C) M.huakuii 7653R;B)、D)M.huakuii HKmco图5 接种4周的根瘤石蜡切片和扫描电镜结构图Fig.5 Structure of 4 weeks nodules of paraffin sections and scanning electron microscope
3 讨论
根瘤菌侵染植物,产生根瘤并固氮,固氮酶在其中发挥了重要的作用. 而固氮酶需要在低氧环境下才能保证其不会遇氧失活.mco基因在抗氧化方面发挥重要作用,通过构建M.huakuiimco基因突变株,本文研究了mco基因在抗氧化和共生固氮方面的作用.
研究发现紫云英根瘤菌mco基因编码多铜氧化酶,该基因突变对华癸中慢生根瘤菌7653R的自身生长没有影响. 多铜氧化酶家族成员漆酶基因lac2突变体在宿主植物组织内部的侵袭后生长没有缺陷[5].mco基因突变株HKmco对无机氧化物H2O2不敏感,但当CUOOH浓度为0.1、1 mmol/L时,mco基因突变会严重影响紫云英根瘤菌抗有机氧化物CUOOH的能力,说明mco基因突变会显著影响紫云英根瘤菌抗有机氧化物CUOOH的能力. 黄红莉等研究了低氧预处理后小鼠抗枯烯过氧化氢能力的变化,经过多次低氧预处理后,小鼠的抗枯烯过氧化氢能力显著降低,推测是热休克蛋白在发挥作用[18].研究表明,多铜氧化酶家族中的铜蓝蛋白CP是一种多功能酶,既有铁氧化酶活性,又具有依赖于谷胱甘肽GSH的过氧化物酶活性,但CP蛋白与典型的GSH过氧化物酶不同,典型的GSH过氧化物酶对无机过氧化物H2O2的活性更高,而CP蛋白对有机氢过氧化物的活性更高,例如叔丁基氢过氧化物. CP蛋白对有机氢过氧化物的活性可以用于除去细胞外液中的有机氢过氧化物,例如脂质氢过氧化物[19]. CUOOH作为一种有机氢过氧化物,可以结合在脂质等上面,从而对细胞中的脂质造成伤害,而多铜氧化酶具有对有机氢过氧化物的活性,可以消除体内的氢过氧化物,这可能是mco基因突变株Hkmco对CUOOH敏感的原因. 而mco基因突变对华癸中慢生根瘤菌的抗无机过氧化物H2O2的能力没有明显影响,可能是由于根瘤菌本身具有GSH过氧化物酶,即使mco基因突变,根瘤菌也可以利用GSH过氧化物酶来清除H2O2.
紫云英盆栽实验表明,接种突变株HKmco的紫云英形成的根瘤数量与接种野生型7653R的紫云英相比无显著差异,但其固氮酶活性与野生型相比降低了29.8%,且接种突变株HKmco的根瘤类菌体数量比野生型少. MCO能够消耗分子氧,降低氧含量,而根瘤菌固氮酶进行固氮需要厌氧环境,MCO在根瘤菌固氮方面发挥重要的作用.本研究表明,mco基因突变会影响根瘤菌抗氧化和共生固氮能力,而多铜氧化酶相关基因在根瘤菌共生固氮中的作用机制值得深入研究.
