以全血细胞减少为首发表现的脾边缘区淋巴瘤1例报告
2020-02-08王安康付文广
何 涛,王安康,蒋 禹,李 秋,付文广, b
西南医科大学附属医院 a.肝胆外科; b.四川省院士(专家)工作站,四川 泸州 646000
脾边缘区淋巴瘤(splenic marginal zone lymphoma,SMZL)是指原发于脾脏的B淋巴细胞性非霍奇金淋巴瘤。SMZL的发病率低,国内以全血细胞减少为首发表现的SMZL报道较少。为提高临床医务人员对SMZL的认识,现将本院诊治的1例报道如下。
1 病例资料
患者女性,76岁,以“腹胀、纳差1年,全血细胞减少3 d”为主诉于2016年6月23日于本院就诊。1年前曾于本院就诊,患者无明显诱因出现腹胀,伴有纳差,无腹痛、腹泻,无畏寒发热,无瘀斑瘀点,无咳嗽咳痰等不适,建议患者进一步检查明确原因,患者予以拒绝。入院前3天,患者来本院检查血常规提示:WBC 1.68×109/L,Hb 98 g/L,PLT 88 g/L。偶有头晕、乏力不适,无畏寒发热、无皮肤巩膜黄染、无腹痛。门诊以“全血细胞减少待诊”收住院。1年体质量下降大约5 kg,既往有乙型肝炎病史5年,未予以治疗,余无特殊病史。查体:全身皮肤无淤斑、淤点,全身浅表淋巴结未触及肿大,腹软,腹部无压痛,左上腹可触及脾脏,肋下8 cm,质硬,不易推动,肝脏未触及,移动性浊音(-),肠鸣音大约4次/min,双下肢轻微水肿。辅助检查:WBC 1.68×109/L,Hb 98 g/L,PLT 88 g/L,淋巴细胞0.75×109/L,Alb 30 g/L,凝血及肝肾功能未见明显异常。腹部彩超和CT均提示:巨脾,怀疑肿瘤。骨髓涂片考虑淋巴增生性疾病,骨髓活组织检查提示:CD20(+)、CD34(-)、CD5(-),不排除边缘区淋巴瘤可能。治疗方面予以升WBC、抗HBV(恩替卡韦)等对症处理,患者于2016年7月8日行脾切除术,术中见:脾脏呈淤血性肿大,质硬,大约15 cm×15 cm×10 cm,与胰尾有轻微黏连,腹腔内无积血积液,肝脏、胆囊、胰腺等未见明显异常。术后病理(图1)结果显示:淋巴细胞增生,脾脏肿瘤,淋巴瘤可能。免疫组化(图2)提示:CD20(+)、CD79a(+)、CD3(+,散在)、CD21(+,部分)、Ki-67(+,5%)、CD5(-)、CD10(-)、CD23(-)、Cyclin D1(-),较符合脾边缘区淋巴瘤,建议行基因重排辅助诊断。基因重排PCR显示:IgK、IgH基因重排在目标条带范围内查见克隆性扩增峰。术后诊断:脾边缘区淋巴瘤(IV B期)。病情稳定后转往血液内科,予以R-CHOP(利妥昔单抗、环磷酰胺、多柔比星、长春新碱及强的松)方案化疗后好转出院。随访3年,患者未出现转移、复发等情况。
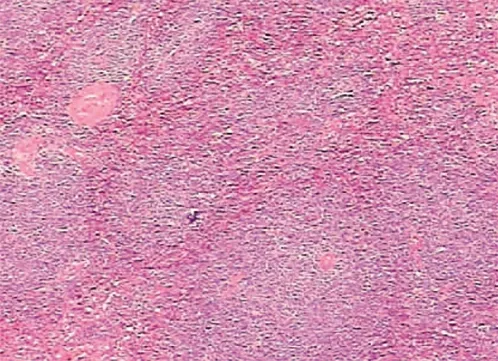
图1 病理结果(HE染色,×100)
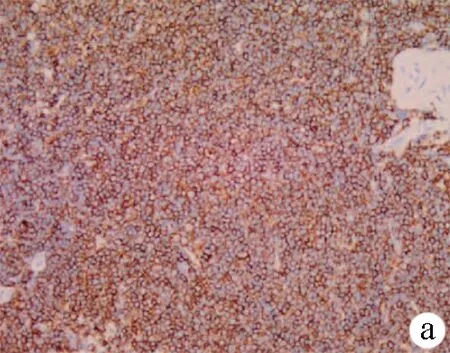

注:a,CD20呈弥漫阳性; b,EBER原位杂交阳性。
2 讨论
SMZL是一种罕见的累及脾脏、骨髓和血液的低度恶性惰性B细胞淋巴瘤,约占所有非霍奇金淋巴瘤的2%[1-2]。SMZL多见于老年患者,中位发病年龄为68岁,男女无差异[3]。SMZL的病因尚不明确,在最近的160例SMZL患者研究[4]中HBsAg阳性率达到了16%,同时Saadoun等[5]报道有10%~16%的SMZL患者患有丙型肝炎,可能肝炎病毒长期刺激脾边缘区B淋巴细胞进一步影响免疫系统对于肿瘤细胞清除作用,最终促使肿瘤细胞生长。本文报道的患者有乙型肝炎病史5年,与文献报道相似。此外,SMZL的发生与遗传学改变有关,Matutes等[6]研究发现70%~80%的病例表现出细胞遗传学和(或)分子遗传学异常,以IgVH基因改变最为常见。
SMZL起病较隐匿,早期可无明显症状,就诊时多为中晚期。临床表现主要包括脾大和脾功能亢进两方面。脾大可引起腹胀、腹痛、纳差等不适,脾功能亢进可引起全血细胞减少,临床上以感染性疾病、出血性疾病为首发表现就诊。此外,部分患者可出现淋巴瘤B组症状(发热、盗汗、体质量下降)。实验室检查可发现外周血淋巴细胞比例增高,有报道[3]64%的患者在就诊时合并贫血,10%~15%的患者合并自身免疫性溶血性贫血[7]。17%~31%合并肝脏增大[8],多累及脾门淋巴结和肝门淋巴结,其余淋巴结少见累及[9-10]。本病骨髓浸润率高达65%,多数患者在就诊时已出现骨髓浸润[10]。本研究患者以全血细胞减少为首发表现,同时伴有纳差、腹胀等不适,这与SMZL的临床表现相符合。
诊断SMZL的金标准依靠病理结果,这就需要行脾切除或者脾穿刺活组织检查。部分患者由于自身原因(高龄、合并其他基础疾病)拒绝手术治疗或者穿刺,这为SMZL的临床诊断增添了困难。胡旸等[11]报道通过流式细胞术可以发现异常增殖的淋巴细胞,尤其是在早期淋巴瘤细胞未完全破坏组织结构时,同时适用于临床不易取到标本的患者。SMZL的病理形态学典型表现为肿瘤细胞浸润白髓和红髓, 从而使得生发中心被破坏结构消失, 最终侵润脾窦区[12]。免疫组化特点是肿瘤细胞多表达CD20、CD79a,而CD10、CD23、Cyclin D1等多为阴性[13]。本研究患者与文献报道一致。
SMZL极易与其他血液系统疾病相混淆,需要与套细胞淋巴瘤、滤泡性淋巴瘤及淋巴浆细胞淋巴瘤等鉴别。套细胞淋巴瘤中Cyclin D1多为阳性,滤泡性淋巴瘤多表达CD10、Bcl-6,而骨髓中CD138阳性的浆细胞是淋巴浆细胞淋巴瘤特征性表现。此外,若能够结合遗传学表现则能更容易做出判断,如出现典型的染色体7q缺失和9q增益则更容易诊断SMZL[14],而淋巴浆细胞淋巴瘤是以6q缺失为特征性改变[15]。对于伴有肝脏转移的SMZL需要与原发性肝脏淋巴瘤相鉴别,后者的CT常呈现轻-中度持续强化,边界清晰,部分可见“血管漂浮征”[16]。此外,注意与脾大等相关疾病相鉴别,如门静脉高压、血吸虫病等,这些疾病有着本身独有特征,比较容易区分开来。
SMZL的治疗目前无明确指南。一般认为无症状的患者可随访观察,但若出现脾大、全血细胞减少等需行手术治疗。手术方式首选脾切除术。尽管手术切除脾脏可以改善脾大、血细胞进一步破环,但由于多数患者就诊时已出现骨髓浸润,导致术后很难获得完全缓解(complete response,CR)。此外,对于全身情况差,不愿意手术治疗的老年患者,化疗可以达到一定治疗效果。化疗包括CHOP、FC、FND方案等,但单纯化疗CR率仅为18%,而手术后化疗CR率可达到37.8%[17]。近年来,SMZL的靶向药物的研究成为热点。有研究[18]认为利妥昔单抗治疗与早期行脾切除术效果类似, 同时避免手术及术后相关并发症。Else等[19]发现脾切除患者使用利妥昔单抗比未切除患者更容易获得CR (P=0.008),而且利妥昔单抗治疗后3年无病生存优于单纯脾切除术(P=0.003),且优于无利妥昔单抗化疗(P=0.004)。对于合并有肝炎病史的SMZL患者需要抗病毒治疗。Kalpadakis等[13]认为合并丙型肝炎的患者应用干扰素可使SMZL患者的淋巴细胞数减少并使脾脏缩小。同样,Koot等[20]报道在使用替诺福韦治疗乙型肝炎后SMZL得到CR。本文患者有乙型肝炎病史,同时未予以治疗,笔者术前给予患者恩替卡韦抗病毒治疗。
SMZL属于惰性淋巴瘤,总体预后较好,但目前对于SMZL的预后因素尚有争议。有学者[21]认为年龄超过65岁,Hb<12 g/dl,血清β2微球蛋白>3 mg/L是影响短期总体生存率的危险因素。Salido等[14]认为14q异常(尤其是14q缺失),可能会导致较差的预后。有报道[19]发现利妥昔单抗后3年的存活率高达98%。
综上所述,本研究SMZL患者以全血细胞减少为首发表现,同时有乙型肝炎病史,采用抗病毒+脾切除术+化疗治疗效果良好。
