肠道菌群及炎性因子联合检测在炎症性肠病患者中的诊断价值研究
2020-02-07杨文宏王维维
杨文宏,王维维
(秦皇岛市第一医院 1.内科ICU;2.输血科,河北 秦皇岛066000)
炎症性肠病(inflammatory bowel disease,IBD)是一种严重威胁人类健康的慢性非特异性肠道炎性疾病,其病情反复,治疗困难,给患者生活造成严重的影响[1]。通常,IBD可分为溃疡性结肠炎(ulcerative colitis,UC) 和克罗恩病(Crohn’s disease,CD)。随着不良饮食习惯及社会压力的加剧,IBD患病人数逐年增加[2]。IBD病因和发病机制尚不明确,目前认为IBD发病与环境因素、遗传易感性、免疫因素、饮食习惯及肠道菌群等多种因素均有关[3,4]。
在正常生理状态,肠道细菌保持一定数量和比例,并与机体处于动态平衡[5]。当人体抵抗力下降,如腹泻、营养不良、免疫力低下、长期大量使用广谱抗生素等,将导致肠道菌群改变。肠道菌群异常将破坏肠道免疫耐受,导致机体免疫系统异常激活,从而导致肠道炎症的发生[6]。研究发现,IBD 患者肠道中真菌菌群失衡,放线菌、白色念珠菌和变形菌数量增加,而拟杆菌、酵母菌、厚壁菌将明显减少[7]。此外,炎性因子,如白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(Tumornecrosisfactor,TNF-α)等在IBD发生和发展中也起到重要作用[8]。在本实验中,通过联合检测IBD患者肠道菌群及血清炎性因子,将有助于进一步阐明IBD的相关发病机制,为临床采取有效干预措施,改善IBD患者预后发挥重要作用。
1 材料与方法
1.1 一般资料
选取2017年6月至2018年5月我院收治的IBD患者174例作为实验对象,分为活动期组和缓解期组。其中,活动期组包括溃疡性结肠炎(Ulcerative colitis,UC)患者60例和克罗恩病(Crohn’s disease,CD)患者38例;缓解期组包括UC患者21例和CD患者55例。IBD诊断分类标准均符合2013年中华医学会消化病学分会的炎症性肠病协作组制订的诊断标准。同时,选取同期在我院进行健康体检者30例作为对照组。此外,排除标准为:严重心脑血管疾病、自身免疫性疾病、其他炎性疾病患者;有短肠综合征;结肠切除术后;患者1月内服用抗生素,近2月内服用过益生菌类药物或酸奶;近2月内做过肠镜检查。
1.2 肠道菌群检测方法
取各组新鲜粪便10 g,对样本进行稀释后取10 μl接种于琼脂培养基,37℃培养48 h后计数菌落数。其中,肠球菌(EC)、酵母菌(SB)、肠杆菌(EMB)需氧培养基培养;双歧杆菌(BL)、拟杆菌(BD)、真杆菌(ES)厌氧菌培养基。细菌经革兰染色、生化试验进行鉴定,计算各组样本所含菌群数量,结果以对数LgN(CFU/g)表示。
1.3 血清炎性因子检测
分别采集对照组、活动期组和缓解期组清晨空腹静脉血5 ml,采用酶联免疫吸附法(enzyme-linked immuno sorbent assay,ELISA)分别检测各组样本中血清IL-6,TNF-α和hs-CRP表达水平。试剂盒购买自美国RayBiotech公司,具体实验操作方法严格按照说明书进行。
1.4 统计学方法采用SPSS17.0统计学软件对所有数据进行统计学处理,计量资料表示为均数±标准差(mean±SD)。采用t检验进行比较,P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料比较
各组间进行比较,性别、身高、体重、BMI均无明显统计学差异(表1,P>0.05)。该结果表明,对照组、活动期组和缓解期组间基线均衡一致,可比性较好。
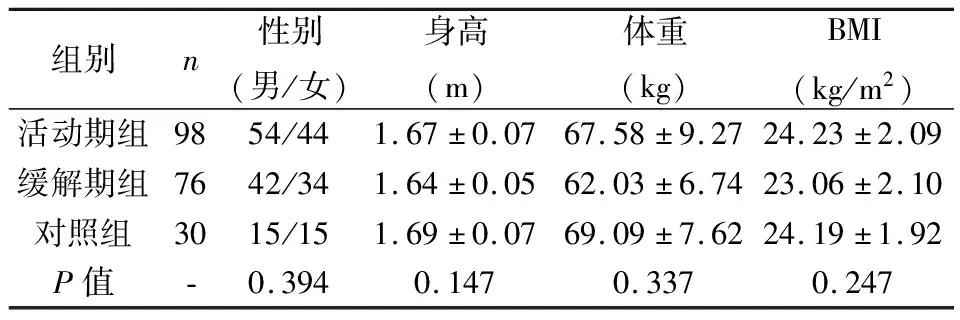
表1 各组一般临床资料比较
2.2 肠道菌群数量
各组肠道菌群数量检测结果表明,与对照组相比,活动期组和缓解期组EC、SB、BL、BD数量明显增加,而ES数量明显减少,差异有统计学意义(P<0.05)。
各组EMB数量无明显差异(P>0.05) ,见表2。

表2 各组肠道菌群数量比较(CFU/g)
2.3 各组肠道菌群检出率
肠道菌群阳性检出率结果显示,与对照组相比,活动期组和缓解期组EC、SB、BD菌群明显增高,而ES菌群明显降低,差异有统计学意义(P<0.05)。而各组EMB和BL菌群阳性检出率无明显差异(P>0.05),见表3。
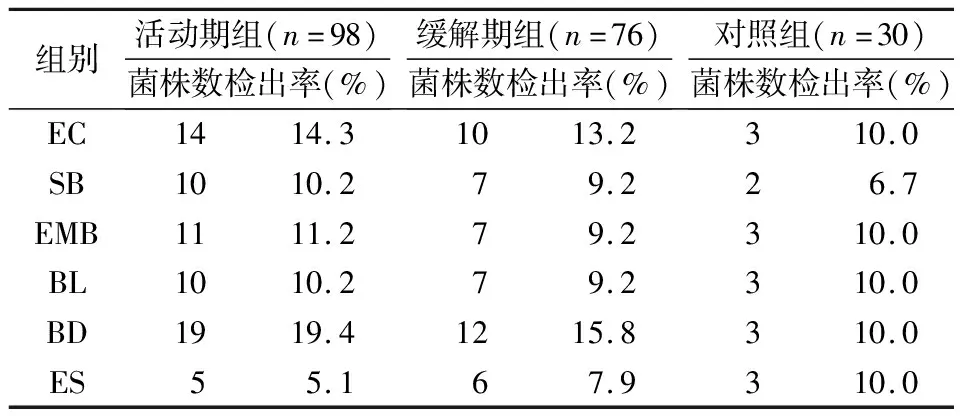
表3 各组肠道菌群阳性检出率
2.4 各组炎性因子表达水平
各组血清炎性因子ELISA检测结果显示,与对照组相比,活动期组和缓解期组IL-6,TNF-α和hs-CRP表达水平均明显增加,差异有统计学意义(P<0.05),见表4。
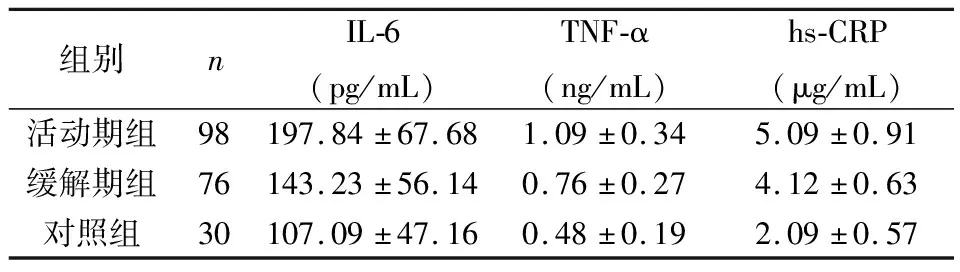
表4 各组炎性因子表达水平比较
3 讨论
炎症性肠病(inflammatory bowel disease,IBD)是一种以肠道黏膜慢性、非特异性炎症反应为主要表现的肠道炎性疾病[9]。流行病学调查数据表明,自20世纪中期开始,IBD的发病率呈现逐渐上升的趋势[10,11]。目前研究发现,IBD发生是环境因素、饮食习惯、遗传基因、肠道菌群以及患者自身免疫因素等多种因素共同作用的结果[12]。
肠道菌群数量庞大,种类繁多。通常,正常生理状态肠道菌群之间互相依存和制约[13]。然而,腹泻、免疫力低及广谱抗生素药物使用等均会造成人体肠道菌群结构改变。研究表明,肠道内菌群失衡可导致肠道黏膜免疫失调,造成肠黏膜屏障功能减退,降低了机体免疫防御力,促使致病菌直接侵袭和损伤肠上皮细胞,从而导致肠道发生炎症反应[14,15]。相关研究发现,IBD患者肠道菌群发生紊乱,其中肠道双歧杆菌、乳酸杆菌和大肠杆菌数量均明显升高[16],而梭状芽胞杆菌数量明显减少[17]。张艳丽等发现IBD活动期大肠杆菌、肠球菌数量较缓解期及健康者明显升高,而益生菌双歧杆菌、乳酸杆菌数量明显降低[8]。在本研究中,我们发现IBD患者活动期和缓解期肠球菌、酵母菌、双歧杆菌和拟杆菌较对照组明显升高,而真杆菌数量明显降低。此外,血清炎性因子对细胞功能和体内生理平衡具有重要调节作用,促炎因子与抗炎因子表达失衡在IBD中也发挥作用[18]。研究表明,IBD患者病情严重程度与血清炎性因子表达水平密切相关,炎性因子表达越高,IBD病变范围越大、病情越重[19]。该实验结果显示,IBD患者活动期和缓解期IL-6,TNF-α和hs-CRP表达水平较对照组均明显增加。
综上所述,肠道菌群结构改变和血清炎性因子表达变化与IBD患者病情明显相关。IBD患者肠道菌群和血清炎性因子含量联合检测将有助于IBD患者的诊断及病情严重程度的判断。
