急性创伤性脑损伤患者脑组织miRNA let-7i 水平变化及其临床意义
2020-02-07童汝有董黎明
童汝有 董黎明
创伤性脑损伤是指暴力作用于头部造成脑组织器质性损伤,我国每年有超过200 万人接受创伤性脑损伤治疗[1-3]。微小RNA(miRNA)是一类小的(19-28nt)内源性RNA 分子,其通过抑制来调节mRNA转录后水平的基因表达。miRNA 与mRNA 中的互补序列结合阻断mRNA 翻译[4-5]。组织中的miRNA 高度稳定,对反复冻融循环和酶促降解具有抗性,并且可以在极端pH 条件下存活。由于这些特性,miRNA 最近已成为许多疾病的新型生物标志物[6]。在轻度至严重急性创伤性脑损伤患者脑组织中发现特定miRNA改变;严重脑损伤时miR-16,miR-92a 和miR-765显著上调,在轻度创伤性脑损伤的情况下,miR-16和miR-92a 显著下调[7-9]。研究已经证实急性肝炎、肺炎患者miRNA let-7i 表达水平上调。本研究拟探讨急性创伤性脑损伤患者脑组织miRNA let-7i 水平变化及其临床意义,报道如下。
1 临床资料
1.1 一般资料 选取2014 年1 月—2016 年4 月在浙江省金华市人民医院就诊的急性创伤性脑损伤患者105 例为观察组,其中高血脂23 例、冠心病41例;患者均无6 周内手术史、下肢外伤史、长期卧床史。按照格拉斯哥昏迷评分(glasgow coma scale,GCS)[10]水平分为三组:轻度组(12~14 分为轻度意识障碍)35 例、中度组(9~11 分为中度意识障碍)56 例、重度组(8 分以下为昏迷)14 例;根据创伤性脑损伤发生至手术时间长短分为<24h 组20 例、≥24h 且≤72h 组45 例和>72h 组40 例;同期选择在浙江省金华市人民医院行脑血管瘤切除术的患者76 例为对照组。观察组及对照组自愿提供创伤性脑损伤脑组织及管瘤边缘少量正常脑组织用于本研究,本研究经浙江省金华市人民医院医学伦理委员会审核批准,患者及家属均签署知情同意书。
1.2 急性创伤性脑损伤诊断标准 参照《颅脑创伤临床救治指南(第3 版)》的诊断标准[11],并经临床表现(脑震荡、颅压增高、头痛呕吐、昏迷、一侧瞳孔或双侧瞳孔散大、去大脑强直、呼吸功能紊乱、心血管功能紊乱)、实验室检查(血常规、血生化)及常规检查确诊。
2 方 法
2.1 创伤性脑损伤脑组织及正常脑组织miRNA let-7i 水平检测 使用Trizol LS 试剂(美国Invitrogen 公司,批号14796)和mirVana miRNA 分离试剂盒(加拿大Ambion 公司,批号XA36954)从急性脑损伤脑组织及正常脑组织分离提取总RNA。具体操作步骤为:将2 体积的Trizol LS 与1 体积的氯仿一起加入样品中。离心后,收集水层并与1.25 体积的无水乙醇混合。然后将其加载到mirVana miRNA分离试剂盒提供的柱上,并根据制造商的方案分离总RNA。总RNA 定量使用Nanodrop 2000 分光光度计(美国Thermo Scientific 公司)进行。用TaqMan microRNA Reverse Transcription Kit(美国Applied Biosystems 公司,批号15696)进行逆转录(RT)。甘油醛-3-磷酸脱氢酶(GAPDH)的管家基因用作内部对照。研究中使用的引物如下所示:miRNA let-7i(3'UTR 序 列)引 物,正 向 5' -TTGCGG -AGGTCACCATAGC-3';反向5'-TTTCCAACAACGGGCTCA-3';GAPDH 引物,正向5'-GGGCTGCTTTTAACTCTG-3';反向5'-TGGCAGGTTTTTCTAGACGG-3'。上述各引物均由上海生工生物工程有限公司设计合成。RT 反应混合物含有大量的茎环状RT 引物(10×)0.8μL,100mM dNTPs(含dTTP)0.2μL,多份逆转录酶(50U/L)1.5μL,10μlRT 缓冲液0.8μL,MgCl2(25mM)0.1μL,RNA 酶抑制剂(20U/L)0.1μL,总RNA 模板(20ng/lL)3μL,无核酸酶水加至终体积7.5μL。在TC-3000G(英国Techne Corp 公司,批号AS3652)上进行PCR,在95℃下保持5min,然后进行40 个循环(95℃15s 和60℃1min)。所有qPCR 反应一式三份进行。使用比较Ct 方法计算倍数变化。
2.2 两组患者血清IL-4、IL-8、IL-12、IFN-γ、TNFα、hs-CRP 水平测定 两组患者清晨空腹及肱静脉抽血,取静脉血10mL 置于无菌管中,室温静置30min,3000rpm 离心,10min,分离血清,MK3-3 酶标仪测定白细胞介素-4(interleukin-4,IL-4)、白细胞介素-8(interleukin-8,IL-8)、白细胞介素-12(interleukin-12,IL-12)、γ-干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、超敏C-反应蛋白(hypersensitive c-reactive protein,hs-CRP)。IL -4、IL -8、IL -12、IFN -γ、TNF -α、hs -CRP Elisa 试剂盒购于(上海鑫乐生物科技有限公司;批号QA654197、OM169215、MN549651、ZP149218、BC120987、NB016746)。
2.3 随 访 对急性创伤性脑损伤患者进行3 年随访,随访截止日期为2019 年4 月。随访方式为电话随访,随访内容为:生存质量、病情变化、治疗效果、进展(死亡)情况等。急性创伤性脑损伤患者组死亡20 例。
2.4 统计学方法 应用SPSS 23.0 进行统计分析。计量资料以均数±标准差()表示,采用单因素方差分析及t 检验比较,多重比较采用LSD-t 检验;相关分析采用Pearson 分析,采用多因素Logistic 逐步回归模型(α 入=0.05、α 出=0.10)探讨急性创伤性脑损伤患者死亡发生的危险因素,检验水准α=0.05。
3 结果
3.1 两组患者一般资料比较 两组患者在性别、年龄、吸烟、饮酒分布及BMI、收缩压、舒张压水平比较,差异无统计学意义(P>0.05),具有可比性,见表1。
3.2 各组不同程度急性脑损伤患者一般资料比较轻度组、中度组、重度组性别、年龄、吸烟、饮酒分布及BMI、收缩压、舒张压水平比较,差异无统计学意义(P>0.05)。见表2。
3.3 不同脑损伤时间段组别间基础资料比较 <24h组、≥24h 且≤72h 组、>72h 组性别、年龄、吸烟、饮酒分布及BMI、收缩压、舒张压水平比较,差异无统计学意义(P>0.05)。见表3。
3.4 观察组与对照组脑组织miRNA let-7i 水平比较 观察组脑组织miRNA let-7i 水平(5.98±2.18)ng/mL 高于对照组(0.95±0.34)ng/mL,差异有统计学意义(t=8.173,P<0.01)。
3.5 观察组与对照组血清IL-4、IL-8、IL-12 水平比较 观察组血清IL-4、IL-8、IL-12 水平高于对照组(P<0.01)。见表4。
表1 观察组与对照组一般资料比较()

表1 观察组与对照组一般资料比较()
注:观察组为急性创伤性脑损伤患者;对照组为脑血管瘤切除术患者;BMI 为体质指数
表2 各组不同损伤程度急性脑损伤患者一般资料比较()

表2 各组不同损伤程度急性脑损伤患者一般资料比较()
注:轻度组为格拉斯哥昏迷评分(GCS)12~14 分;中度组为GCS 9~11 分;重度组为GCS<8 分;BMI 为体质指数;1mmHg=0.133kPa
3.6 观察组与对照组血清IFN-γ、TNF-α、hs-CRP水平比较 观察组血清TNF-α、hs-CRP 均高于对照组(P<0.05),IFN-γ 低于对照组(P<0.01)。见表5。
3.7 各组不同损伤程度急性脑损伤患者脑组织miRNA let-7i 水平比较 随着脑损伤严重程度的增加,miRNA let-7i 水平逐渐增加,差异有统计学意义(P<0.01)。见表6。
3.8 各组不同脑损伤时间急性脑损伤患者脑组织miRNA let-7i 水平比较 随着脑损伤时间段的延长,miRNA let-7i 水平逐渐增加,差异有统计学意义(P<0.05)。见表7。
表3 各组不同损伤时间急性创伤性脑损伤患者一般资料比较()
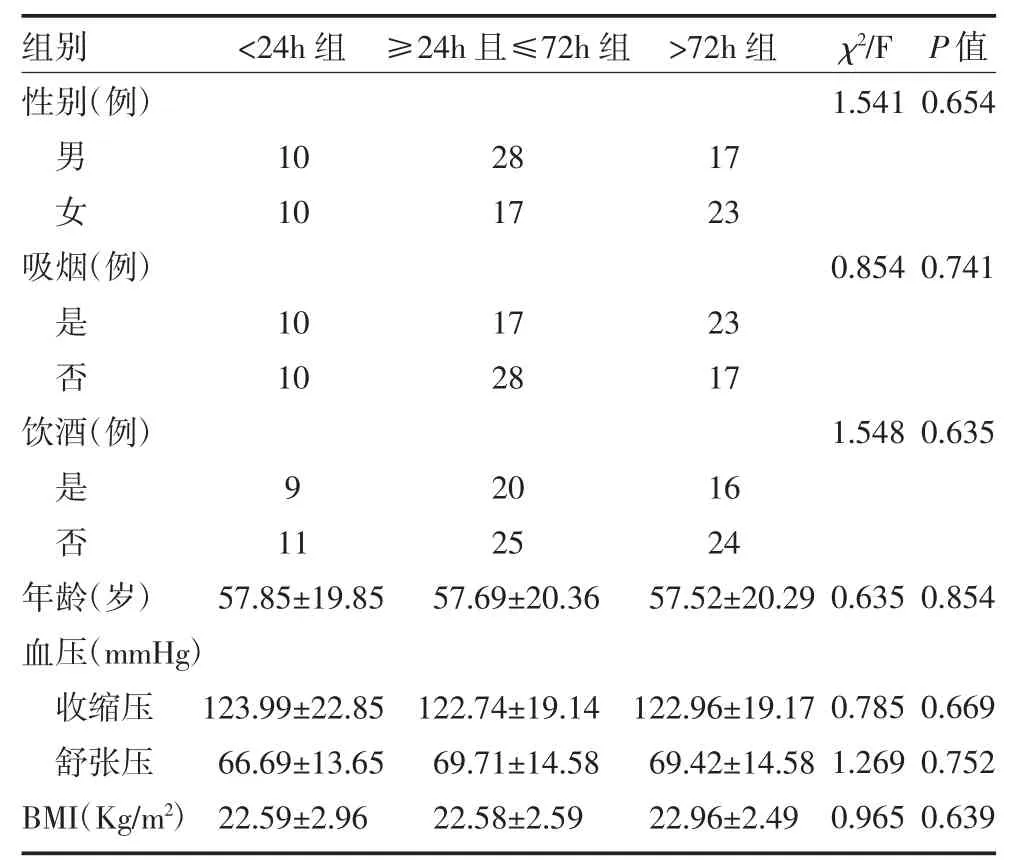
表3 各组不同损伤时间急性创伤性脑损伤患者一般资料比较()
注:BMI 为体质指数;1mmHg=0.133kPa
表4 观察组与对照组血清IL-4、IL-8、IL-12 水平比较(pg/mL,)

表4 观察组与对照组血清IL-4、IL-8、IL-12 水平比较(pg/mL,)
注:观察组为急性创伤性脑损伤患者;对照组为脑血管瘤切除术患者;IL-4 为白细胞介素-4;IL-8 为白细胞介素-8;IL-12 为白细胞介素-12
表5 观察组与对照组血清IFN-γ、TNF-α、hs-CRP 水平比较()
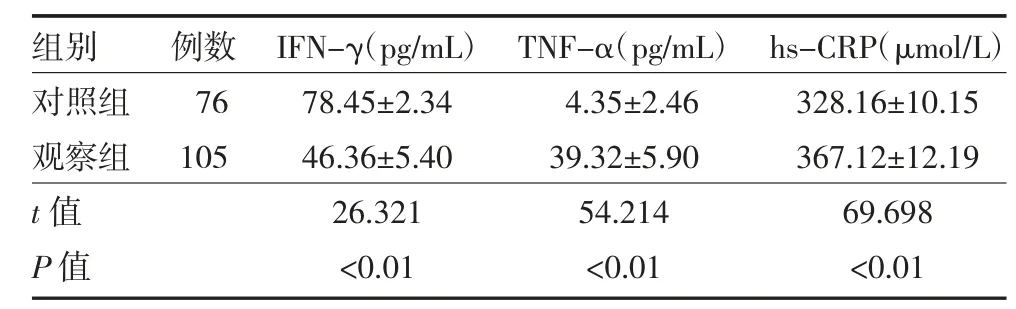
表5 观察组与对照组血清IFN-γ、TNF-α、hs-CRP 水平比较()
注:观察组为急性创伤性脑损伤患者;对照组为脑血管瘤切除术患者;IFN-γ 为γ-干扰素;TNF-α 为肿瘤坏死因子-α;hs-CRP 为超敏C-反应蛋白
表6 各组不同程度急性脑损伤患者脑组织miRNA let-7i水平比较()

表6 各组不同程度急性脑损伤患者脑组织miRNA let-7i水平比较()
注:轻度组为格拉斯哥昏迷评分(GCS)12~24 分;中度组为GCS9~11分;重度组为GCS<8 分;miRNA let-7i 为微小核糖核酸let-7i;与轻度组比较,aP<0.05;与中度组比较,bP<0.05
表7 各组不同脑损伤时间急性脑损伤患者脑组织miRNA let-7i 水平比较()

表7 各组不同脑损伤时间急性脑损伤患者脑组织miRNA let-7i 水平比较()
注:miRNA let-7i 为微小核糖核酸let-7i;与<24h 组比较,aP<0.05;与≥24h 且≤72h 组比较,bP<0.05
3.9 存活组、死亡组脑组织miRNA let-7i 水平比较死亡组脑组织miRNA let-7i 水平(7.81±0.35)高于存活组(5.24±1.44),差异有统计学意义(t=12.365,P<0.01)。
3.10 miRNA let-7i 与各变量相关性分析 miRNA let-7i 与IL-4、IL-8、IL-12、TNF-α、hs-CRP 呈正相关关系(r=0.572、P=0.002;r=0.483、P=0.001;r=0.494、P=0.001;r=0.438、P=0.004;r=0.523、P=0.021),与IFN-γ 呈负相关(r=-0.747、P=0.010)。
3.11 急性创伤性脑损伤患者发生死亡的多元Logistic 回归分析 对急性创伤性脑损伤患者进行3年随访,发生死亡事件20 例。以急性创伤性脑损伤患者是否发生死亡为应变量(是=1,否=0),单因素分析有意义的因素为自变量进行多因素Logistic 逐步回归分析,结果发现高水平的miRNA let-7i、GCS、TNF-α 均为急性创伤性脑损伤患者发生死亡的危险因素(P<0.05)。见表8。

表8 急性创伤性脑损伤患者发生死亡的多元Logistic 回归分析
4 讨论
创伤性脑损伤是复杂的级联事件。在脑损伤后,趋化因子启动整合素,将淋巴细胞募集到损伤部位,并引导它们进入大脑,随后这些淋巴细胞与神经细胞一起参与促炎细胞因子介导的内皮激活和趋化因子分泌的刺激。近期研究表明,miR let-7i 是人单核细胞和淋巴细胞的选择性生物引诱剂,是一种C-Cβ趋化因子[12-13]。急性胰腺炎时miR let-7i 能诱导CD8+T 细胞、血小板、巨噬细胞、嗜酸性粒细胞、成纤维细胞、单核细胞、嗜碱性粒细胞趋化至炎症和感染的部位[14-15]。体外细胞学试验已经证明,miR let-7i 通过两个途径刺激T 细胞,第一条途径是通过GPCR 介导的途径瞬时Ca2+动员导致细胞极化和迁移;第二条途径是依赖于蛋白酪氨酸激酶(PTK)介导的持续Ca2+激增,导致多种细胞反应,包括T 细胞增殖或凋亡,IL-2、IL-5、IFN-γ 和MIP-1β 的释放。除诱导趋化性外,miR let-7i 还可作为体外T 细胞的抗原非依赖性激活剂[16]。本研究结果显示,观察组脑组织miR let-7i 水平高于对照组;随着脑损伤严重程度的增加,miR let-7i 水平逐渐增加;随着脑损伤时间段延长,miR let-7i 水平逐渐增加;miR let-7i 与IL-4、IL-8、IL-12、TNF-α、hs-CRP 正相关,与IFN-γ 呈负相关。这与上述讨论符合,同时说明,急性创伤性脑损伤患者脑组织miR let-7i 水平升高,其与脑损伤严重程度及脑部炎症反应密切相关。
本研究也发现,高水平miR let-7i、GCS、TNF-α均为急性创伤性脑损伤患者死亡的危险因素。由于miR let-7i 趋化因子的神经毒性功能,针对创伤性脑损伤的靶向特异性疗法,结合本研究结果,靶向调节miR let-7i 依赖性途径的治疗可能成为治疗大脑和神经退行性疾病等炎症性脑病的潜在靶点。
