基于整体柱的糖基化蛋白质分离富集方法的研究进展
2020-02-06温雪郑海娇张扬贾琼
温雪 郑海娇 张扬 贾琼
摘 要 蛋白质糖基化作为一种重要的翻译后修饰,不仅可以反映机体的健康状况,还可以充当药物治疗的靶点。因此,阐明蛋白质糖基化的修饰规律对疾病的诊断和治疗具有重要意义。然而,生物样品中糖基化蛋白质相对丰度低,复杂程度高,动态范围宽,适宜的样品前处理步骤必不可少。近年来,整体柱因具备分离快速、灵敏、高效、生物兼容性好等优点,在糖基化蛋白质分离富集领域得到了广泛关注。本文对近年来基于整体柱的糖基化蛋白质分离富集方法的研究进展进行了评述,并对其未来发展趋势进行了展望。
关键词 整体柱; 糖基化蛋白质; 样品前处理; 分离; 富集; 评述
1 引 言
蛋白质糖基化是指不同类型的糖基在特定糖基转移酶的作用下共价连接到蛋白质上的过程,其作为一种重要的后修飾广泛存在于哺乳动物细胞中。糖基化蛋白质常作为胞质外的结构组分起到连接、支撑等作用,并广泛参与到细胞的识别、粘附及迁移等过程,调控细胞的增殖与分化[1~3]。异常的蛋白质糖基化可扰乱人体稳态,引起癌症、免疫失调等疾病 \[4,5]。根据糖苷键的类型可将蛋白质糖基化分为四类:(1)O-糖苷键型,以苏氨酸、丝氨酸、羟赖氨酸和羟脯氨酸中的羟基为连接点形成; (2)N-糖苷键型,以天冬酰胺的酰胺基、N-末端氨基酸的α-氨基和赖氨酸(Lysine, Lys)或精氨酸的ω-氨基为连接点形成; (3)脂糖苷键型,以天冬氨酸或谷氨酸的游离羧基为连接点形成; (4)S-糖苷键型,以半胱氨酸的巯基为连接点形成。
糖基化蛋白质组学的研究对于临床疾病的监测以及药物靶点的发现具有重要意义[6,7]。相较于凝胶电泳法、液相色谱法等传统鉴定技术,具有高效、灵敏、快速等优点的生物质谱技术近年成为糖基化蛋白质组学鉴定的主要方法[8,9]。然而,由于蛋白质糖基化的不均一性及大量非糖肽的干扰[10],使得通过上述技术直接对糖蛋白及糖肽进行检测鉴定难度很大。因此,通过合适的样品前处理技术分离富集得到足够量的糖蛋白或糖肽是对其进行检测鉴定的基本前提。目前,常见的糖蛋白及糖肽的分离富集方法主要包括[11]凝集素亲和富集法[12~15]、硼酸亲和富集法[16~19]、肼化学富集法[20~22]、亲水相互作用色谱法(Hydrophilic interaction chromatography, HILIC)[23~28]等。
整体柱(Monolithic column)因具有传质速度快、生物相容性好及孔隙结构可调节等特点,在糖蛋白及糖肽分离中得到了越来越多的关注[29]。整体柱又称为连续床,是一种在石英毛细管、聚醚醚酮管、不锈钢管或芯片中, 通过有机或无机聚合方法, 经原位聚合得到的整体、连续的柱材料[30]。目前,基于整体柱材料的分析分离方法已广泛应用于蛋白质组学、代谢组学、环境科学、药学和食品科学等领域[31~35]。
2 整体柱概述
2.1 整体柱的分类
依据内部填充物质种类,整体柱主要分为无机硅胶整体柱、有机聚合物整体柱、无机-有机杂化整体柱三大类。无机硅胶整体柱主要采用溶胶-凝胶法合成,所合成的整体柱机械性能良好、孔隙率高、比表面积大,但制备过程较复杂、柱体易开裂且需要包覆,除此之外,还存在材料适用pH值范围窄、柱效低等问题[36,37]。有机聚合物整体柱是由不同比例的单体、交联剂、致孔剂和引发剂通过光引发或热引发聚合而成的一种拥有连续多孔结构的整体材料,具有制备简单、适用pH值范围宽、生物相容性好、单体种类繁多、易于修饰等优点[38,39],同时也存在机械稳定性较差、易溶胀等缺点。无机-有机杂化整体柱则综合二者部分优点,拥有较高的表面积、较大的机械强度、较好的热稳定性[40],其制备方法主要包括溶胶-凝胶法[41]、“一锅法”[42]、基于含硅试剂的聚合反应法[43]等。
2.2 整体柱的改性
为了提高整体柱对糖蛋白及糖肽的吸附选择性,研究者采取不同手段对整体柱进行了改性,主要包括简单掺杂法[44]、共同聚合法[45]和聚合后修饰法[46]。近年来,针对蛋白质糖基化研究的整体柱改性材料主要分为以下几类。
2.2.1 采用纳米无机材料改性 纳米无机材料具有比表面积大、机械稳定性强、量子和表面效应等独特的性质。将其作为整体柱改性材料,可改善整体柱材料的表面化学性质,制备出比表面积更大、机械性能更强的整体柱; 同时对糖蛋白及糖肽也有一定的亲和作用。该类改性材料主要包括碳纳米材料、金属与金属氧化物纳米材料和硅纳米材料等。
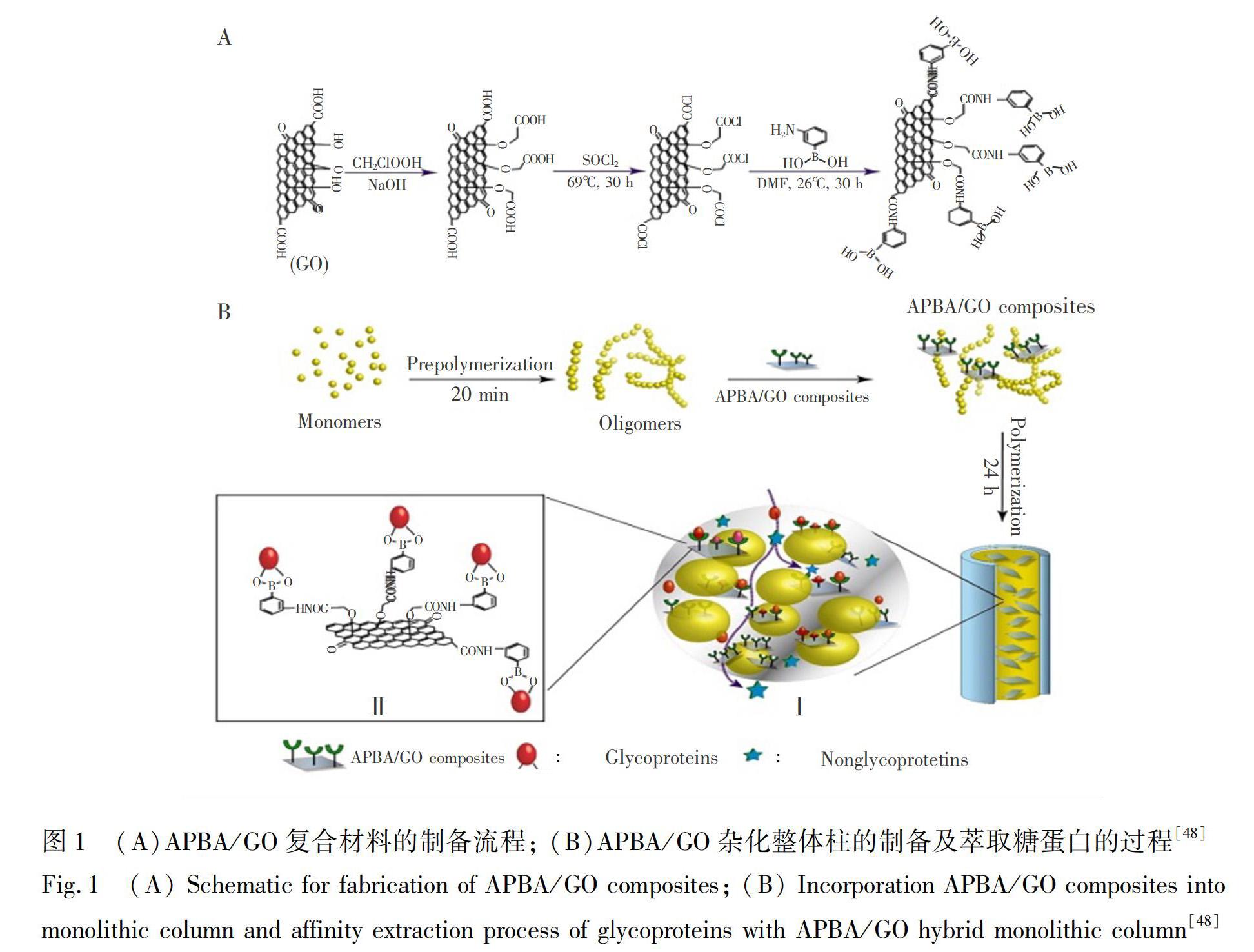
作为一种碳纳米材料,氧化石墨烯(Graphite oxide, GO)是石墨烯(Graphene, GN)的氧化物,除了具有与GN类似的超高比表面积、较强的稳定性外,还含有丰富的羟基、羧基、环氧基等含氧官能团,比GN亲水性更好,更适用于糖蛋白及糖肽的分离富集[47]。Li研究组[48]将硼酸修饰后的GO加入到含有甲基丙烯酸、乙二醇二甲基丙烯酸酯的低聚物混合液中,在不锈钢管中合成了硼酸化GO掺杂的整体柱。GO的引入不仅使材料的BET表面积从6.3 m2/g扩大到169.4 m2/g,而且提供了丰富的硼酸基团结合位点,提高了糖蛋白的富集效率(图1)。
金纳米粒子(Gold nanoparticles, AuNPs)具有高的比表面积、良好的稳定性及生物相容性,可通过与巯基、氨基等基团的作用为材料后续的功能化修饰提供连接点[49]。Wu等[50]将4-巯基苯硼酸和2-巯基乙胺键合到AuNPs修饰的聚(甲基丙烯酸缩水甘油酯-聚乙二醇二丙烯酸酯)整体柱上,成功捕获了混合蛋白样品中的糖蛋白组分。
金属氧化物表面具有较多的活性基团,不仅易与整体柱结合,还能够提供糖蛋白及糖肽的吸附位点。Yang等[51]首次报道了一种SiO2/TiO2杂化的硼酸亲和整体柱,与传统的硼酸亲和整体柱相比,该整体柱可在中性条件下成功捕获含有顺式二羟基结构的小分子和糖蛋白。在钛原子强吸电子作用的影响下,该杂化整体柱具备超强的亲水性,克服了疏水作用对富集过程的影响,可在无有机溶剂的情况下富集抗体类物质。
2.2.2 采用离子液体改性 离子液体是一种由阴、阳离子组成的熔点低于100℃的有机熔融盐[52]。离子液体可通过亲水、疏水、离子交换、氢键等作用与分析物结合,同时还具有粘度可调、热稳定性高、溶解性强、蒸气压小等特点。Liu等[52]制备了一种新型二维整体材料,可实现糖蛋白的在线富集与分离。其中,硼酸功能化的石墨烯整体材料为富集段,聚(胍盐离子液体-甲基丙烯酸-N,N-亚甲基双丙烯酰胺)整体材料为分离段。该新型二维整体材料被作为毛细管电色谱的固定相,成功实现了5种糖蛋白(鸡卵清白蛋白(Ovalbumin, OVA)、辣根过氧化酶(Horseradish peroxidase, HRP)、转铁蛋白、核糖核酸酶A、甲胎蛋白)的在线富集与分离。硼酸功能化的石墨烯整体柱与聚胍盐离子液体整体柱的相互配合使得分离效率大大提高。
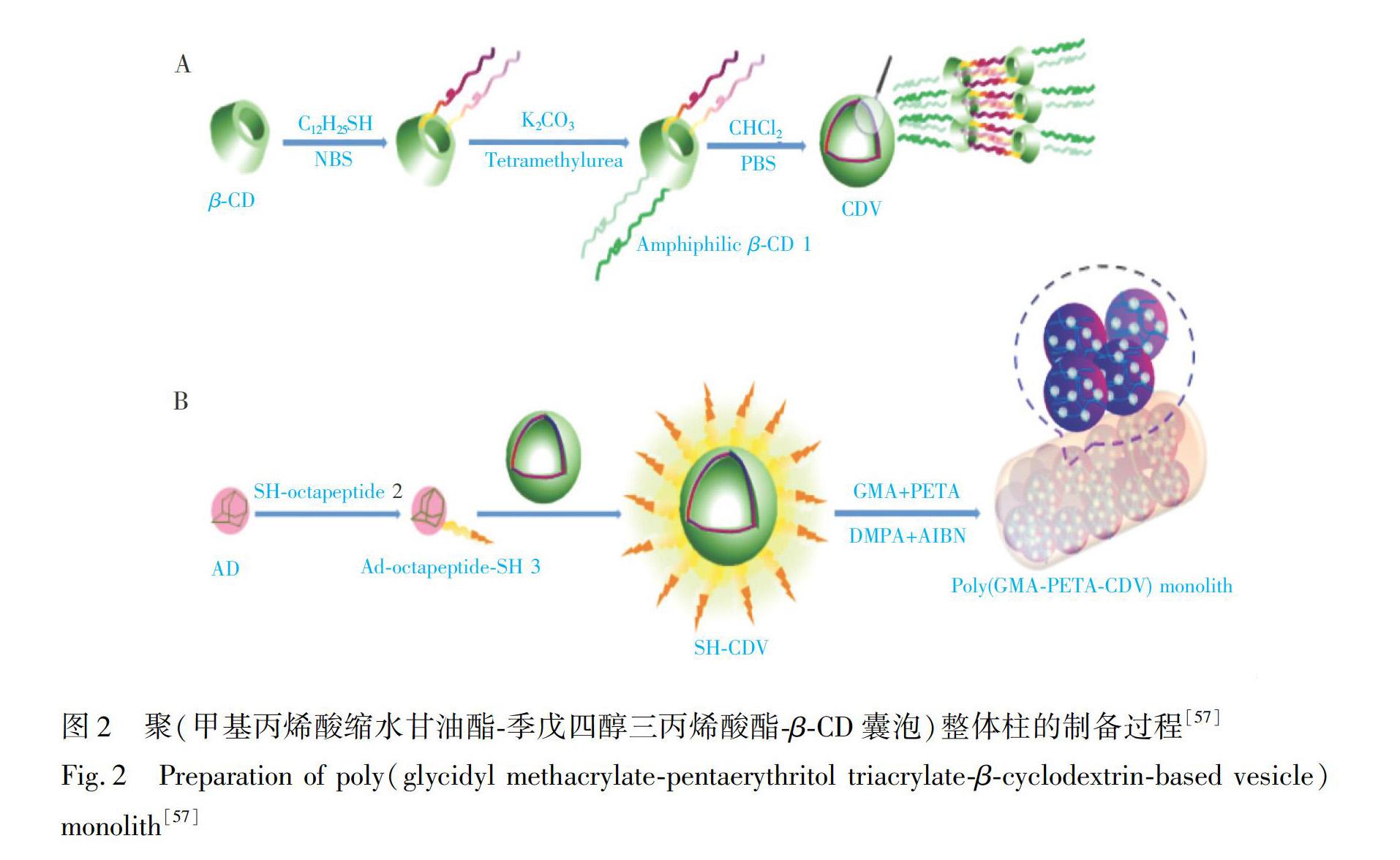
2.2.3 采用大环化合物改性 大环化合物主要包括冠醚、环糊精(Cyclodextrin, CD)、杯芳烃及葫芦脲等,其表面存在丰富的化学基团,有利于进一步的修饰,且这类化合物还具有独特的主客体相互作用。因此,研究者将这类物质与整体柱结合,以期获得兼具大环和整体柱多种优势的材料。大环化合物修饰的整体柱的制备难点主要在于对大环化合物进行功能化修饰,以改善其自身的一些限制,以及将大环化合物简便结合到整体柱上。本研究组结合质谱检测手段,在环糊精改性整体柱富集糖蛋白及糖肽方面进行了一系列研究[53~57],主要包括:基于HILIC机理的糖基化β-CD(Glycoβ-CD)修饰的聚(甲基丙烯酸羟乙酯-季戊四醇三丙烯酸酯-Glycoβ-CD)整体柱及β-CD分子管修饰的聚(甲基丙烯酸羟乙酯-季戊四醇三丙烯酸酯-谷氨酸-β-CD分子管)整体柱、基于花生凝集素(Peanut agglutinin, PNA)亲和机理的聚(甲基丙烯酸羟乙酯-乙二醇二甲基丙烯酸酯-PNA-β-CD)整体柱、基于Lys亲和机理的聚(甲基丙烯酸甲酯-乙二醇二甲基丙烯酸酯-甲基丙烯酸羟乙酯-Lys-β-CD-生物素)整体柱、基于pH敏感响应机理的聚(甲基丙烯酸缩水甘油酯-季戊四醇三丙烯酸酯-β-CD囊泡)整体柱。其中,本研究组[57]首次将巯基功能化的pH响应型β-CD自组装囊泡修饰到聚(甲基丙烯酸缩水甘油酯-季戊四醇三丙烯酸酯)整体柱上,得到pH敏感响应型的整体柱(图 2),并将其成功应用于心脏疾病标记物——肌红蛋白的研究,该方法的检出限低至0.1 fmol(S/N > 3),日内与日间精密度分别为2.3%和3.5%。在随后的实际样品分析中,成功从人血液样品中鉴定出166个N-糖基化位点和对应的130种糖蛋白。
3 整体柱在糖基化蛋白质分离富集中的应用
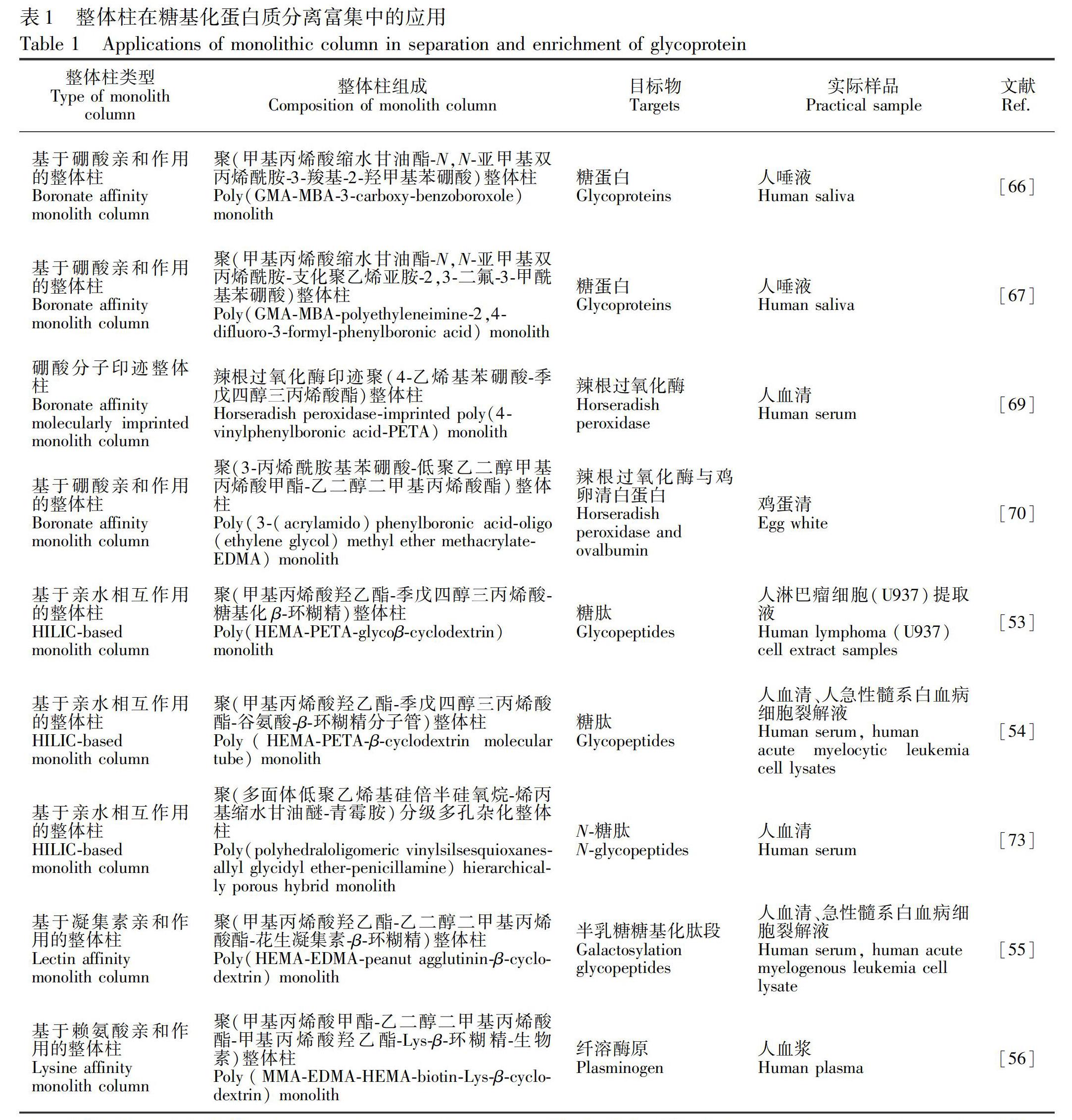
整体柱不仅具备快速分离、灵敏高效等优点,而且其内部丰富的功能基团与糖蛋白或糖肽之间存在亲水、静电、氢键、偶极-偶极等多種作用。因此,整体柱作为糖蛋白和糖肽的分离材料已逐渐得到应用(表1)。目前,依据富集机理的不同,用于糖蛋白或糖肽分离富集的整体柱主要分为以下
3.1 基于肼化学富集法的整体柱
该方法首先将糖链上的邻二醇氧化成醛基,然后与整体柱材料上的肼基发生共价反应形成腙,再洗去非糖肽,随后通过一定的方法将糖肽中的肽段部分释放,与糖链分离,实现糖蛋白或糖肽的分离富集(图3)。该方法的优点为非特异性吸附少,富集后糖肽含量高于90%[58,59]。Bai等[60]用3-巯基丙烷-1,2-二醇修饰的多面体低聚乙烯基倍半硅氧烷,与二硫苏糖醇通过巯烯点击聚合反应合成大孔的亲水有机-无机杂化整体柱,而后将肼基引入整体柱,并运用肼化学法富集糖蛋白。然而,由于这类方法反应繁琐复杂且不易调控,富集后因为糖链部分的缺失而只能用于肽骨架的研究,限制了该方法的使用。
3.2 基于硼酸亲和作用的整体柱
硼酸亲和法富集糖蛋白或糖肽的原理为: 硼酸分子与糖链上的顺式二羟基结构在碱性条件下形成五、六元环酯,该环酯结构在酸性条件下发生水解。通过调控此可逆反应,可达到分离富集糖蛋白或糖肽的目的[61]。该方法的优点在于硼酸分子与顺式二羟基之间通过共价键连接,较为稳固,可经受强力洗脱,从而有利于削弱非特异性吸附; 且该方法具有可逆性,可通过调节pH值实现对糖蛋白或糖肽的吸附与解吸。此外,在富集过程中,该方法不破坏糖基结构,有利于后续对糖基结构的研究[50]。Liu研究组[62]采用原位自由基引发聚合机理,以4-乙烯基苯基硼酸为单体、N,N-亚甲基双丙烯酰胺为交联剂,制备了硼酸亲和整体柱,用于对糖蛋白的特异性识别。在碱性条件下,糖蛋白与4-乙烯基苯基硼酸之间因存在亲和作用而被保留,非糖蛋白被洗脱; 切换到酸性条件下,则可将糖蛋白洗脱下来。
传统的硼酸亲和整体柱富集糖蛋白,其碱性工作环境易使糖蛋白水解,结合力较差,特异性不强[63]。为了防止糖蛋白在碱性条件下被水解,调节硼酸基团作用时的pH值至中性或弱酸性非常必要。为此,研究者将多种新型硼酸分子应用于糖蛋白的分离富集,主要包括改进Wulff 型苯硼酸、苯环上连有吸电子基的取代苯硼酸等[64]。其中,改进Wulff 型苯硼酸因具有较好的亲水性及在中性环境下对含顺式二羟基的化合物有良好的富集效果而被广泛利用。Liu研究组[65]合成了一种3-羧基-2-羟甲基苯硼酸修饰的聚(甲基丙烯酸缩水甘油酯-N,N-亚甲基双丙烯酰胺)硼酸亲和整体柱。在pH低至5时,腺苷仍然能够完全保留于整体柱上。随后,该研究组[66]利用3-羧基-2-羟甲基苯硼酸制备出结构均匀的整体柱,结合质谱检测,从HRP胰蛋白酶消化液中鉴定出22种糖肽。而后又从人唾液中成功检测出6种完整的糖蛋白。此外,该研究组[64]还设计合成了含2,3-二氟-3-甲酰基苯硼酸的整体柱,用于人尿液中核苷的富集,并考察了间隔臂的长度对硼酸亲和整体柱富集效率的影响。
研究者将聚合物等材料引入整体柱以扩增硼酸配体的数目,提高了对糖蛋白及糖肽的亲和力[61]。Liu研究组[67]将支化聚乙烯亚胺(Polyethyleneimine, PEI)修饰到聚(甲基丙烯酸缩水甘油酯-N,N-亚甲基双丙烯酰胺)整体柱上,获得的聚(甲基丙烯酸缩水甘油酯-N,N-亚甲基双丙烯酰胺)整体柱对糖蛋白的结合常数可达10类型。
6~10/L。PEI的加入不仅扩增了结合位点,还增加了整体柱的亲水性。另外,研究者通过表面引发聚合反应接枝聚合物链以达到相似的效果,反应简便快捷、可控性强[61]。如Dong等[68]采用两步原子转移自由基聚合法合成了4-乙烯基苯硼酸链接枝的多孔聚合物整体柱,增加了硼酸分子的数目,有效地增强了对含两个顺式二羟基结构的分子的亲和力。此外,将硼酸亲和法与分子印迹技术结合设计合成的硼酸印迹整体柱也可大幅提升对糖蛋白的亲和力。该类整体柱拥有对模板分子超强的专一性,可将特定糖蛋白从复杂样品中分离出来[63]。Lin等[69]通过多巴胺自聚机理设计合成了以HRP为模板的聚(4-乙烯基苯硼酸-季戊四醇三丙烯酸酯)整体柱,由于结合了硼酸亲和原理和表面印迹技术,去除模板分子后整体柱内部存在精准和稳定的识别位点,有利于增强模板分子与材料的结合能力,重现性良好, 使用寿命长。该分子印迹整体柱被成功应用于复杂样品中HRP的富集。
硼酸亲和整体柱在分离富集糖蛋白时还需要高的特异性。除了增强硼酸分子对糖蛋白的亲和力外,还要尽可能削弱不利于糖蛋白富集的二级作用。 Zhou等[70]合成了含有亲水单体低聚乙二醇甲基丙烯酸甲酯(Oligo(ethylene glycol) methyl ether methacrylate, OEG)的硼酸亲和整体柱,即聚(3-丙烯酰胺基苯硼酸-OEG-乙二醇二甲基丙烯酸酯)整体柱。加入OEG后,该整体柱对HRP及OVA的回收率提高了30%,说明引入亲水大分子单体有效提高了硼酸亲和整体柱对糖蛋白的亲和力。
3.3 基于亲水相互作用的整体柱
亲水相互作用色谱的概念在20世纪90年代由Alpert首次提出[71]。HILIC的固定相与正相色谱相似,均为极性固定相; 其流动相又与反相色谱类似,主要由水与有机溶剂组成。HILIC具有较高的糖基化覆盖率、优良的重现性、良好的质谱兼容性,是常见的糖肽分离富集方法[28]。
本研究组[53]利用巯烯点击化学法制备了Glyco β-CD,再将Glyco β-CD键合到聚(甲基丙烯酸羟乙酯-季戊四醇三丙烯酸酯)整体柱中,随后将该整体柱与质谱联用并富集检测复杂样品中的糖肽。Chen研究组[72]通过两相接枝共聚法合成硫酸葡聚糖功能化丙烯酸多缩乙二醇双酯整体柱,一步完成了整体柱的糖基化修饰,并研究了整体柱的HILIC机理。Ye等[73]在聚己内酯(Polycaprolactone, PCL)存在下,通過自由基聚合制备了基于多面体低聚乙烯基硅倍半硅氧烷与烯丙基缩水甘油醚的整体柱,随后用盐酸溶液降解PCL,得到环氧功能化的分级多孔杂化整体柱。通过调节单体的摩尔比和PCL的含量,该整体柱的比表面积可达 636.7 m2/g。 而后将青霉胺修饰到整体柱上,并将所获得的材料与质谱联用,用于N-糖蛋白的富集,从人血清中成功鉴定出385个N-糖肽和283个N-糖基化位点。
3.4 基于凝集素亲和作用的整体柱
凝集素是一类来源于植物或动物、可使细胞凝集或使含糖复合物沉淀的蛋白。凝集素可特异性识别一种或某几种糖基,如刀豆凝集素(Concanavalin A, Con A)特异性结合甘露糖型[74,75]、PNA特异性结合半乳糖型[76],橙黄网胞盘菌凝集素(Aleuria aurantia lectin, AAL)特异性结合岩藻糖型[77]。凝集素法富集糖蛋白是利用每一种凝集素特异性结合一种或几种类型的糖基,将糖蛋白从样品中分离出来。凝集素整体柱具有特异性强、富集过程不破坏糖基等优点。
本研究组[55]利用PNA特异性结合半乳糖型糖基的机理制备了PNA改性的β-CD化合物,将该化合物键合到聚(甲基丙烯酸羟乙酯-乙二醇二甲基丙烯酸酯)整体柱上,并制备成微萃取装置与质谱仪进样口连接,在线解吸检测复杂样品中的半乳糖糖基化肽段,检出限低至0.5 fmol(图4)。
凝集素法分离富集糖蛋白只能捕获与凝集素表位相关的糖链结构,限制了其在糖蛋白整体分析中的应用。而采用多种不同凝集素联合使用的策略可尽可能覆盖更多的糖型。Rassi等[78]开发了一种由凝集素亲和色谱组成的液相分离平台,并通过液相色谱-二级串联质谱对捕获到的人血清中的糖蛋白进行分析鉴定。该平台由3个表面分别固定了Con A、小麦胚芽凝集素(Wheat germ agglutinin, WGA)和蓖麻凝集素-I(Ricinus communis agglutinin-I, RCA-I)的整体柱串联组成。就捕获蛋白的数量而言,最适宜的凝集素串联顺序是WGA→ Con A →RCA-I(记作WCR),该研究通过寻找乳腺癌患者与非乳腺癌患者血清中差异表达的糖蛋白,成功寻找到一组共23个候选生物标志物。
3.5 基于抗原抗体免疫亲和作用的整体柱
该类整体柱利用抗原抗体结合的专一性,通过使用具有特异性的单克隆抗体对相应的糖蛋白进行分离[79]。Gordan等[80]报道了一种固定单克隆抗人纤维蛋白原抗体的整体材料,在半高通量模式下快速纯化人血浆中的纤维蛋白原(Fibrinogen, FIB)。该工作成功应用于10例健康人的FIB免疫亲和分离,随后应用超高效液相色谱对其进行N-糖基化分析。该类方法虽然灵敏度高、特异性好,但是抗体价格高昂、稳定性差,且操作较为复杂[79]。
3.6 基于赖氨酸亲和作用的整体柱
15 Du K, Dan S. J. Chromatogr. A, 2018, 1548: 37-43
16 Wang S, Ye J, Bie Z, Liu Z. Chem. Sci., 2014, 5(3): 1135-1140
17 Li D, Chen Y, Liu Z. Chem. Soc. Rev., 2015, 44(22): 8097-8123
18 Zhang X, Wang J, He X, Chen L, Zhang Y. ACS Appl. Mater. Interfaces, 2015, 7(44): 24576-24584
19 Yao J, Wang J, Sun N, Deng C. Nanoscale, 2017, 9(41): 16024-16029
20 Horak D, Balonova L, Mann B F, Plichta Z, Hernychova L, Novotny M V, Stulik J. Soft Mat., 2012, 8(9): 2775-2786
21 Zhang L, Jiang H, Yao J, Wang Y, Fang C, Yang P, Lu H. Chem. Commun., 2014, 50(8): 1027-1029
22 Bai H, Pan Y, Qi L, Liu L, Zhao X, Dong H, Cheng X, Qin W, Wang X. Talanta, 2018, 186: 513-520
23 He X, Liang X, Chen X, Yuan B, Zhou P, Zhang L, Feng Y. Anal. Chem., 2017, 89(18): 9712-9721
24 CHEN Cheng, WANG Hong-Xi, KANG Hong-Jian, YAO Yao, QING Guang-Yan, LI Xiu-Ling, LIANG Xin-Miao. Chinese J. Anal. Chem., 2017, 45(8): 1149-1154
陳 成, 王宏喜, 康虹健, 姚 要, 卿光焱, 李秀玲, 梁鑫淼. 分析化学, 2017, 45(8): 1149-1154
25 Xia C, Jiao F, Gao F, Wang H, Lv Y, Shen Y, Zhang Y, Qian X. Anal. Chem., 2018, 90(11): 6651-6659
26 Hong Y, Zhao H, Pu C, Zhan Q, Sheng Q, Lan M. Anal. Chem., 2018, 90(18): 11008-11015
27 Chen H, Li Y, Wu H, Sun N, Deng C. ACS Sustainable Chem. Eng., 2019, 7(2): 2844-2851
28 Chen Y, Sheng Q, Hong Y, Lan M. Anal. Chem., 2019, 91(6): 4047-4054
29 PANG Ji-Lei, LIN Zi-An, LIN Yao, HUANG Hui, ZHANG Lan, CHEN Guo-Nan. Journal of Instrumental Analysis, 2011, 30(5): 582-587
庞纪磊, 林子俺, 林 瑶, 黄 慧, 张 兰, 陈国南. 分析测试学报, 2011, 30(5): 582-587
30 LU Yan, GUO Jian-Yu, ZHANG Xiang-Min. Chinese J. Anal. Chem., 2006, (10): 1463-1466
鲁 彦, 郭建宇, 张祥民. 分析化学, 2006, (10): 1463-1466
31 Zhang H, Huang J, Wang H, Feng Y. Anal. Chim. Acta, 2006, 565(2): 129-135
32 LIU Jing, WANG Fang-Jun, ZHANG Zhen-Bin, ZOU Han-Fa. Chinese J. Anal. Chem., 2013, 41(1): 10-14
刘 静, 王方军, 张振宾, 邹汉法. 分析化学, 2013, 41(1): 10-14
33 Cai J, Zhu G, He X, Zhang Z, Wang R, Feng Y. Talanta, 2017, 170: 252-259
34 Zajickova Z. J. Sep. Sci., 2017, 40(1): 25-48
35 Fang W, Xia L, Huang X, Guo X, Ding J, Wang H, Feng Y. Chromatographia, 2018, 81(10): 1381-1389
36 Pirozzi D, Abagnale M, Minieri L, Pernice P, Aronne A. Chem. Eng. J., 2016, 306: 1010-1016
37 Seto H, Matsumoto H, Shibuya M, Akiyoshi T, Hoshino Y, Miura Y. J. Appl. Polym. Sci., 2017, 134(4): 44385
38 Zhang M, Wei F, Zhang Y, Nie J, Feng Y. J. Chromatogr. A, 2006, 1102(1-2): 294-301
39 Zhang H, Huang J, Lin B, Feng Y. J. Chromatogr. A, 2007, 1160(1-2): 114-119
40 Ou J, Lin H, Zhang Z, Huang G, Dong J, Zou H. Electrophoresis, 2013, 34(1): 126-140
41 Yan L, Zhang Q, Zhang W, Feng Y, Zhang L, Li T, Zhang Y. Electrophoresis, 2005, 26(15): 2935-2941
42 Wu M, Wu R, Wang F, Ren L, Dong J, Liu Z, Zou H. Anal. Chem., 2009, 81(9): 3529-3536
43 Wu M, Wu R, Li R, Qin H, Dong J, Zhang Z, Zou H. Anal. Chem., 2010, 82(13): 5447-5454
44 Tong S, Liu Q, Li Y, Zhou W, Jia Q, Duan T. J. Chromatogr. A, 2012, 1253: 22-31
45 Wang H, Wei S, Zhang H, Jia Q. RSC Adv., 2016, 6(43): 36256-36263
46 Tong S, Zhou X, Zhou C, Li Y, Li W, Zhou W, Jia Q. Analyst, 2013, 138(5): 1549-1557
47 Wang R, Chen Z. J. Sep. Sci., 2018, 41(13): 2767-2773
48 Zhou C, Chen X, Du Z, Li G, Xiao X, Cai Z. J. Chromatogr. A, 2017, 1498: 90-98
49 Daniel M C, Astruc D. Chem. Rev., 2004, 104(1): 293-346
50 Wu C, Liang Y, Zhao Q, Qu Y, Zhang S, Wu Q, Liang Z, Zhang L, Zhang Y. Chem. Eur. J., 2014, 20(28): 8737-8743
51 Yang Q, Huang D, Zhou P. Analyst, 2014, 139(5): 987-991
52 Liu C, Deng Q, Fang G, Huang X, Wang S, He J. ACS Appl. Mater. Interfaces, 2015, 7(36): 20430-20437
53 Zheng H, Ma J, Feng W, Jia Q. J. Chromatogr. A, 2017, 1512: 88-97
54 Zheng H, Li X, Jia Q. ACS Appl. Mater. Interfaces, 2018, 10(23): 19914-19921
55 Zheng H, Zhu T, Li X, Ma J, Jia Q. Anal. Chim. Acta, 2017, 983: 141-148
56 Zheng H, Song N, Li X, Jia Q. Analyst, 2017, 142(24): 4773-4781
57 Zheng H, Li X, Jia Q. ACS Appl. Mater. Interfaces, 2018, 10(6): 5909-5917
58 Sun Z, Qin H, Wang F, Cheng K, Dong M, Ye M, Zou H. Anal. Chem., 2012, 84(20): 8452-8456
59 Yang S J, Zhang H. Anal. Chem., 2012, 84(5): 2232-2238
60 Bai J, Liu Z, Wang H, You X, Ou J, Shen Y, Ye M. J. Chromatogr. A, 2017, 1498: 37-45
61 Li H, Zhang X, Zhang L, Cheng W, Kong F, Fan D, Li L, Wang W. Anal. Chim. Acta, 2017, 985: 91-100
62 Ren L, Liu Y, Dong M, Liu Z. J. Chromatogr. A, 2009, 1216(47): 8421-8425
63 Liu Z, He H. Acc. Chem. Res., 2017, 50(9): 2185-2193
64 Li Q, Lu C, Liu Z. J. Chromatogr. A, 2013, 1305: 123-130
65 Li H, Wang H, Liu Y, Liu Z. Chem. Commun., 2012, 48(34): 4115-4117
66 Bie Z, Chen Y, Li H, Wu R, Liu Z. Anal. Chim. Acta,2014, 834: 1-8
67 Li D, Li Y, Li X, Bie Z, Pan X, Zhang Q, Liu Z. J. Chromatogr. A, 2015, 1384: 88-96
68 Dong Q, Chi S, Deng X, Lan Y, Peng C, Dong L, Wang X. Eur. Polym. J., 2018, 100: 270-277
69 Lin Z, Wang J, Tan X, Sun L, Yu R, Yang H, Chen G. J. Chromatogr. A, 2013, 1319: 141-147
70 Zhou X, Mo C, Chen M, Huang Y, Liu Z. J. Chromatogr. A, 2018, 1581: 8-15
71 Alpert A J. J. Chromatogr. A, 1990, 499: 177-196
72 Xiong X, He H, Shu Y, Li Y, Yang Z, Chen Y, Ma M, Chen B. Talanta, 2016, 161: 721-729
73 Ma S, Zhang L, Wang S, Zhang H, You X, Ou J, Ye M, Wei Y. Anal. Chim. Acta, 2019, 1058: 97-106
74 Kohn M, Benito J M, Mellet C O, Lindhorst T K, Fernandez J M G. Chembiochem, 2004, 5(6): 771-777
75 Zhong H, El Rassi Z. J. Sep. Sci., 2009, 32(10): 1642-1653
76 Zhang M, Wu P, Dou W T, Han H, He X, Tan C, Jiang Y. Chem. Commun., 2017, 53(41): 5625-5628
77 Fujihashi M, Peapus D H, Kamiya N, Nagata Y, Miki K. Biochemistry, 2003, 42(38): 11093-11099
78 Selvaraju S, El Rassi Z. J. Sep. Sci., 2012, 35(14): 1785-1795
79 ZHANG Li-Xia, DU Xiu-Fang, ZENG Ying. Acta Chimica Sinica, 2016, 74(2): 149-154
張丽霞, 杜秀芳, 曾 盈. 化学学报, 2016, 74(2): 149-154
80 Vidic U, Trbojevic Akmacic I, Cernigoj U, Albers M, Gaspersic J, Pucic-Bakovic M, Vidic J, Strancar A, Lauc G. Electrophoresis, 2017, 38(22-23): 2922-2930
81 Tang Z, Liu X, Luan Y, Liu W, Wu Z, Li D, Chen H. Polym. Chem., 2013, 4(22): 5597-5602
Abstract As a post-translational modification, protein glycosylation not only reflects on body health, but also serves as the target of drug treatment. Therefore, it is of great significance to study protein glycosylation for the diagnosis and treatment of diseases. However, many glycoproteins of biological importance exhibit relatively low abundance, high complexity, and wide dynamic range in biological samples. It is indispensable to explore highly efficient sample pretreatment methods. In recent years, monolithic columns have attracted extensive attention in the field of separation and enrichment of glycoproteins due to their advantages of rapid separation, high efficiency, and good biological compatibility. In this paper, recent progress of monolithic columns in the field of separation and enrichment of glycoproteins is surveyed, and the future development is briefed.
Keywords Monolithic column; Glycoprotein; Sample pretreatment; Separation; Enrichment; Review
