短时程脊髓电刺激治疗带状疱疹后遗神经痛合并爆发痛的疗效分析
2020-02-06
(华中科技大学同济医学院附属武汉市中心医院疼痛科,湖北 武汉 430061)
带状疱疹后遗神经痛(postherpetic neuralgia,PHN)作为一种临床常见的神经病理性疼痛,常表现为局部皮肤疱疹破溃愈合后出现的受累区域的持续或者间断性疼痛,好发于中老年及机体免疫力低下的人群,临床症状多表现为持续性烧灼样痛、闪电样痛、间隙性针刺样痛、刀割样痛、痛觉过敏、感觉异常及感觉迟钝,其发病机制目前仍不清楚[1-3]。爆发性疼痛(breakthrough pain,BTP)指在已用阿片类药物对患者稳定形式的疼痛(持续痛)进行了充分治疗的基础上,仍出现的短暂、剧烈发作的恶性疼痛(简称爆发痛),一般发生在肿瘤患者中后期[4]。临床上部分带状疱疹后遗神经痛患者也会出现类似爆发痛,口服非甾体类及阿片类药物控制不明显,我科于2016年4月至2019年4月采用脊髓电刺激治疗带状疱疹后遗神经痛引起的爆发痛患者33例,取得较好临床疗效,现报告如下。
1 资料与方法
1.1 临床资料
本组33例患者中,男19例,女14例;年龄 38~76岁,病程3个月至2年。病变部位:左侧肢体16例右侧肢体17例,1例在植入电极期间出现发热,为避免硬膜外感染而终止治疗,3例失访;最终29例患者成功随访3个月。本研究经我院伦理委员会批准。术前完善相关检查,排除了原发性病因。病例纳入标准:①符合带状疱疹后遗神经痛的诊断,间断性出现爆发痛;②病程在3个月内,疱疹结痂脱落;③给予药物控制3周以上,且疼痛控制不佳;④完善相应脊柱节段无占位性病变及感染;⑤患者签订知情同意书。排除标准:①病程在3个月以上;②肿瘤转移合并部分脏器受损;③合并心脑血管疾病,长期口服抗凝药物;④脊柱区域手术后或者椎关节强直或严重脊柱侧弯;⑤沟通后患者及家属不配合后期治疗。
1.2 方法
电极植入位置准确是脊髓电刺激(spinal copol sermulation, SCS)成功的关键,术中根据带状疱疹累及的皮节决定刺激的脊髓节段,在脊髓节段对应的椎体水平置入电极。本研究以胸背部及腹部带状疱疹性疼痛区域的电刺激植入手术方法为例,为了更好地调整电刺激以治疗疱疹后遗神经痛引发的下肢间断性爆发痛,更好地覆盖疼痛部位,采用双电极置入[5]。患者取俯卧位,常规消毒铺单,在DSA透视下定位穿刺点,通常以T12~L1椎板间隙处的体表投影定位硬膜外穿刺点,局部麻醉后,以30°~45°的穿刺进针角度使用Tuohy针进行穿刺进针,持续透视下于椎弓根内侧进针,进针时保持Tuohy针斜面朝向脊髓,直到针尖到椎板后偏向椎板外缘缓慢进针,同时在正位透视下调整椎板终板确认椎板间隙下缘,针尖抵达椎板边缘后拔出针芯,测试负压,以阻力消失判定进入硬膜外间隙,拔出针芯,将球管调至正位,在DSA下置入8触点电极(图1)。调整电极位置在T11椎体下缘的硬膜外腔正中稍偏左/偏右[5],电极之间的距离为2~4 mm,连接延长线和脉冲发射器测试,依据测试结果刺激覆盖下肢原有疼痛区域,调试到患者可以接受的刺激强度后退出Tuohy针,固定电极导线,进行2周左右的试验性治疗。
术后绝对卧床休息24 h,常规静脉滴注抗生素预防感染,脱水及活血药物应用3 d,1周后评定疗效。
1.3 观察指标
匹兹堡睡眠质量指数(pirsburgh sleepquality index, PSQI)评定睡眠质量,总分为0~21分,分数越高,代表睡眠质量越差。测试者依据量表内容来评估患者术前及术后1 d、1周、2周、1个月、3个月的睡眠质量。
疼痛程度评定:包括治疗前和治疗后1 d、1周、2周、1个月、3个月数字化疼痛评分(numeric rating scales,NRS)和BTP次数。采用简式Mcgill疼痛量表
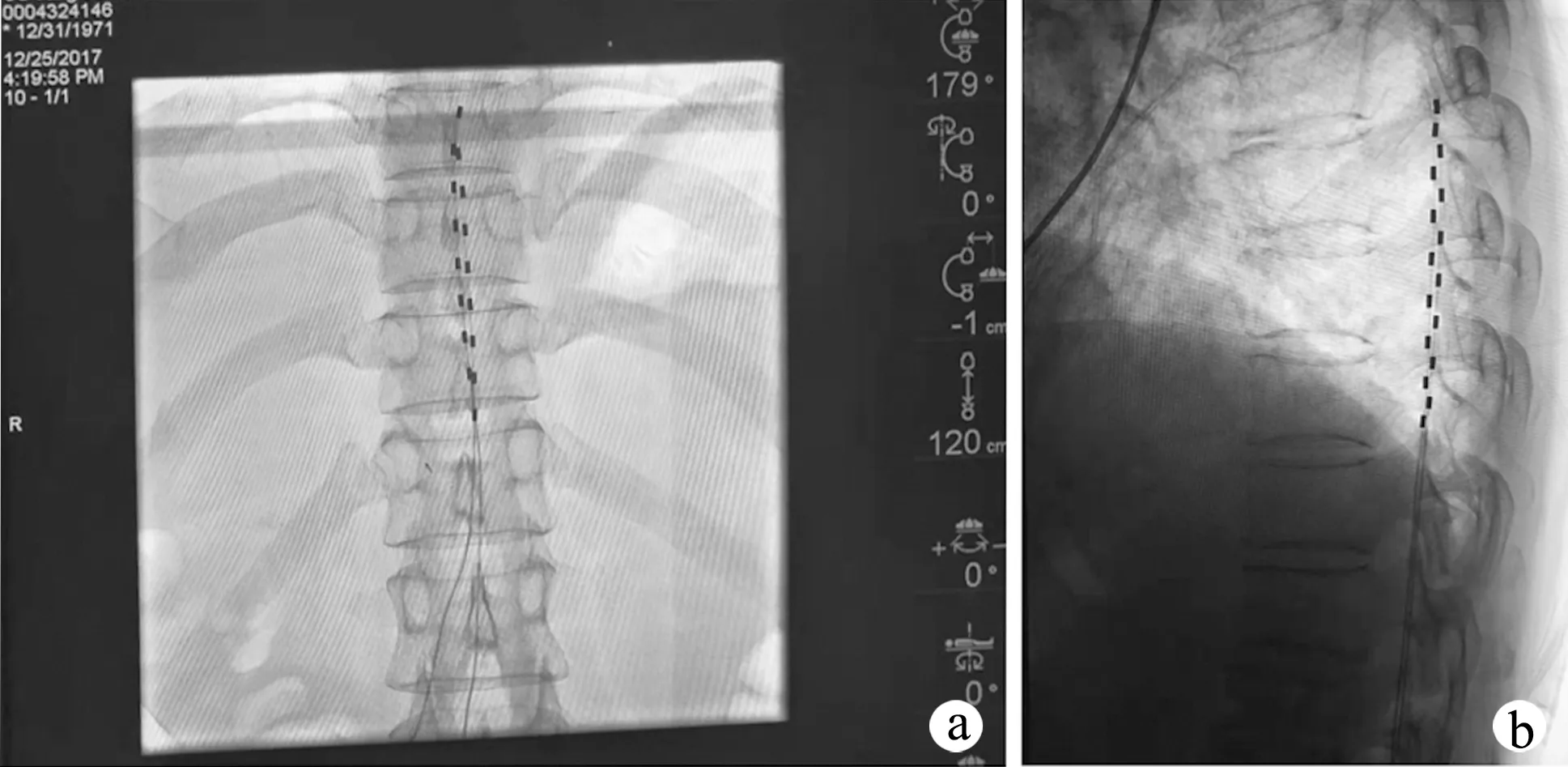
a:正位; b:侧位
(简化MPQ)评定治疗前后疼痛的缓解情况[5]。疼痛评估指数(pain rating index,PRI)评分表中感觉分、情绪分及总分由医护人员进行评定。视觉模拟评分(vasual analogue scales,VAS)及现有疼痛强度(present pain index,PPI)评分由患者标识评定。
以床头询问、电话随访、预约复诊的方式分别在治疗前和治疗后1 d、1周、2周、1个月、3个月统计PRI、VAS、PPI的疼痛分数变化。
1.4 统计学分析
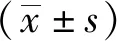
2 结果
2.1 治疗前及治疗后随访MPQ量表积分比较
PRI评分,治疗后1 d、1周、2周、1个月与治疗前比较,差异有统计学意义(P<0.05);治疗后3个月与治疗前比较,差异有极显著性统计学意义(P<0.01)。PPI评分及VAS,治疗后1 d、1周、2周与治疗前比较,差异具有统计学意义(P<0.05);治疗后1个月、3个月与治疗前比较,差异具有极显著性统计学意义(P<0.01),见表1。
2.2 治疗前后NRS、BTP次数及PSQI比较
NRS、BTP次数及PSQI,治疗后1 d、1周、2周与治疗前比较,差异具有统计学意义(P<0.05);治疗后1个月、3个月与治疗前比较,差异具有极显著性统计学意义(P<0.01),见表2。
表1 治疗前后MPQ量表积分比较
*:与治疗前比较,P<0.05;#:与治疗前比较,P<0.01
表2 治疗前后NRS、BTP次数、PSQI积分比较
*:与治疗前比较,P<0.05;#:与治疗前比较,P<0.01
3 讨论
PHN表现为受累神经分布区域的持续性疼痛,其发病机制被认为是疱疹病毒侵犯背根神经节,脊髓上行抑制传导系统受累,导致过量兴奋性信号传入中枢,引起外周及中枢神经系统病理性改变,表现为炎性脱髓鞘改变[6]。爆发痛是指在持续镇痛治疗的基础上,出现超过背景疼痛的突发性、短时间剧烈疼痛,在一定程度上与癌痛机制相似[7]。有研究发现,中枢神经敏化在神经病理性疼痛的发病过程中表现为疼痛区域扩大且反复出现爆发性疼痛,患者对疼痛的耐受降低[8]。在慢性疼痛动物模型上,神经损伤后脊髓背角突触前γ-氨基丁酸(γ-aminobutyric acid,GABA)释放减少,从而不能抑制痛觉过敏现象,引起自发、持续性疼痛[9]。PHN引起的爆发痛与中枢敏化对痛觉信号传导的增强有关[10]。中枢神经敏化在PHN爆发痛的发病过程中表现为疼痛区域的扩大(实际痛觉区域超出神经受损控制区域),痛觉超出平时疼痛的感觉传入,并且反复爆发性疼痛,降低患者对起始疼痛感的耐受[11]。有研究发现,带状疱疹的神经损害为炎性脱髓鞘改变,并认为PHN的发生与患者脊髓后根神经纤维受损有关,因此治疗十分困难[12]。老年PHN患者由于免疫功能低下,修复神经的功能降低,神经组织修复过程较慢,易发生后遗神经痛。目前临床上治疗PHN以营养神经及治疗神经病理性疼痛药物、激素治疗为主,部分患者长期依赖药物产生诸多并发症,影响生活质量。目前SCS治疗PHN已在临床广泛应用,取得良好疗效,临床及基础研究报道较多。但对于PHN合并爆发痛的治疗的报道不多,本研究采用SCS治疗PHN合并爆发痛,疗效显著。
SCS在治疗PHN合并爆发痛时的电极置入尤其重要。电极在脊髓不同的位置直接影响到临床疗效,一般靠近脊髓中间背角位置可以达到覆盖疼痛部位的目的。在爆发痛发生的时间节点上,需要不断地调整刺激参数,以达到对背景痛和爆发痛的刺激覆盖。SCS镇痛机理一般认为是基于闸门理论学说,通过不断刺激脊髓背角,减少疼痛信号传导,降低了神经可塑性改变,遏制了神经中枢敏化[13];此外,由于神经电刺激双向传导作用亦可改善外周神经有害神经递质释放,抑制外周敏化的持续作用,从而达到治疗目的[14]。本研究显示,在患者术后2周取出测试电极后,其疼痛并未复发。这提示电刺激除了有即时止痛的效果外,还具有促进受损神经修复的作用,带状疱疹患者神经系统遭到带状疱疹病毒广泛而严重损伤后,不仅机体脊髓后根神经节脱水、发生 Wallerian退变、囊性变、神经节神经元数量显著降低,而且外周神经纤维轴突明显减少及胶原化,脊髓后根神经节内也有慢性炎性细胞浸润[15]。因此对于带状疱疹患者,促进受损神经修复也是重要治疗策略之一。有研究显示,电刺激对神经的不断刺激能增加施万细胞活性,促进其分泌神经生长因子,使神经生长因子呈梯度分布,利于神经轴突生长,引起离子运动,调节细胞内外离子分布,减轻钙离子内流,稳定细胞内环境,阻断神经元凋亡,起到保护修复神经的作用[16-17]。
随着对SCS镇痛机制研究的不断深入,在动物实验研究中发现SCS的镇痛机制可能与调节脊髓内抑制性神经递质(GABA及5-HT)有关[18]。有研究发现,SCS可诱导导水管周围灰质释放GABA,通过激活位于脊髓后角的GABA受体,产生突触前和突触后抑制效应,释放大量调节兴奋性神经递质,抑制伤害性信息的传递,达到镇痛目的。此外,袁保红等[19]通过SCS对大鼠脊髓初级出入神经元中的降钙素基因相关肽(calcitonin gene related peptide,CGRP)与P物质(substance P,SP)的研究发现,CGRP使脊髓背角内兴奋性氨基酸浓度增高,通过上调受体引起神经元兴奋性增强,兴奋性增强的神经元受CGRP等神经肽的释放而异化,使疼痛感觉阈值增加;同时发现脊髓背根神经节和神经元合成的SP通过增强谷氨酸等释放参与了伤害性信号传递,当受到伤害性刺激时其向脊髓背角释放,作用于突触后膜NK1受体,进而增强脊髓背角神经元敏化;在痛觉调节协同作用中,CGRP抑制与SP降解有关酶的活性,增强SP的作用[20]。由此推测,SCS通过对脊髓背角的不断电刺激,下调脊髓背角SP和CGRP的表达,抑制兴奋性神经递质谷氨酸等释放,降低中枢神经元兴奋性,从而缓解神经病理性痛[21]。其他相关机制则认为,在脊髓节段水平上,SCS刺激脊髓后柱Aβ纤维后激活脊髓Ⅱ区胶质区(substantia gelatinosa,SG),导致脊髓深层(板层Ⅳ和Ⅴ)感受伤害性刺激的神经元受到抑制;同时刺激后柱顺行激活大脑(包括皮质、丘脑感觉核团和脑干),由大脑发出疼痛抑制信号激活下行疼痛抑制通路,期间多个神经递质(5-HT、ACh、阿片肽、NE等)及受体参与,从而起到镇痛作用。
综上所述,虽然目前对SCS镇痛及预防PHN的确切机制尚不清楚,且SCS并不能完全控制疼痛,镇痛过程中(尤其是合并的爆发痛)需要不断地调整刺激参数,甚至患者体位的变化也会影响到刺激量及刺激部位的改变,但其对神经病理性疼痛有着良好的疗效[22]。本研究证实,SCS对PHN爆发痛有着良好的疗效,但由于本研究样本量少及观察时间短,加上长时程电极置入量不足,其远期疗效有待今后临床工作中进一步探讨。
