大黄素调控miR-21介导细胞自噬减轻糖尿病肾病小鼠肾脏氧化性损伤机制研究
2020-02-02齐宝宁熊永爱潘艳芳徐守竹纪明睿王嘉欣邹佳盈
齐宝宁,熊永爱,潘艳芳,徐守竹,纪明睿,王嘉欣,王 一,邹佳盈
1陕西中医药大学校医院,西安712046;2遵义医科大学药学院,遵义563000;3陕西中医药大学公共卫生学院,西安712046
糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的严重继发性肾小球疾病,也是慢性肾衰竭的常见原因。血糖过高可引发肾脏氧化应激,导致活性氧(reactive oxygen species,ROS)在肾脏固有细胞内蓄积,可造成足细胞、内皮细胞、肾小管上皮细胞和系膜细胞等的氧化损伤,加剧DN的发生发展[1]。自噬是真核细胞内维持细胞内环境稳定的重要内降解机制,作用在通过溶酶体蛋白的降解,清除受损的结构或过度表达的蛋白,参与维持细胞更新和细胞内稳态。DN病理生理过程与内质网应激、线粒体功能障碍及炎症反应密切相关,细胞自噬清除错误的折叠蛋白和受损细胞器,促使自噬体形成和自噬-溶酶体的融合,缓解内质网应激和细胞凋亡。氧化应激状态下产生的ROS可诱导自噬发生,自噬可以清除自由基缓解氧化应激对肾组织和细胞的损伤,是细胞的重要促生存机制。有效诱导自噬,控制炎症过程是治疗DN的有效策略。
近年来研究表明,微RNAs(microRNAs,miRNAs)在DN患者中异常表达并参与系膜细胞外基质(extracellularmatrix,ECM)聚集及足细胞损伤等DN的病理过程,尤其是microRNA-21(miR-21)更是成为研究的热点。miR-21普遍存在并调节细胞分化、增生、凋亡,国内外多项研究发现,DN患者血清miR-21浓度显著高于正常人,且在DN患者肾组织活检中发现miR-21与肾小管间质纤维化呈正相关[2,3]。因此,沉默miR-21或抑制其表达对抑制糖尿病长期或短期并发症有重要意义。而miR-21被报道可通过调控Akt/mTOR、PTEN等信号通路调控细胞自噬[4]。但目前国内外文献中未见通过调控miR-21介导细胞自噬减轻糖尿病肾病肾脏氧化性损伤相关报道。
大黄素(emodin,EM)是蓼科植物掌叶大黄RheumpalmatumL.、唐古特大黄RheumtanguticumMaxim.ex Balf.和药用大黄RheumoffcihaleBaill.的有效活性成分,属于蒽醌类化合物,具有抑菌、抗炎、调节免疫、抗肿瘤、改善肾功能等药理作用[5,6]。前期研究发现[7],大黄素可通过抑制高糖诱导的肾小球膜细胞增殖,促进系膜细胞凋亡来延缓DN的进展。预实验结果也显示,25 mmol/L葡萄糖可以显著促进肾小球系膜细胞miR-21的表达。本研究拟从调控miR-21介导细胞自噬探讨大黄素减轻糖尿病肾病小鼠肾脏氧化性损伤的作用机制。
1 材料与仪器
1.1 实验材料
SPF级小鼠,体重18~22 g,雌雄各半,购自空军军医大学实验动物中心。实验动物质量合格证号:SCXK(陕)2012-002。
大黄素(emodin,CAS:518-82-1,成都格利普生物科技有限公司);anti-P62(货号ab227207,英国abcam公司);anti-Atg7(货号ab80639,英国abcam公司),anti-LC3(货号ab128025,英国abcam公司);小鼠血尿素氮(BUN)Elisa试剂盒(货号YS06475B,上海雅吉生物科技有限公司);肌酐(Cr)Elisa试剂盒(货号YS059871B,上海雅吉生物科技有限公司);尿白蛋白排泄率(uAE)Elisa试剂盒(货号YS035742B,上海雅吉生物科技有限公司);链脲佐菌素(STZ)购自Sigma公司。血糖试纸购自三诺生物传感股份有限公司。
1.2 实验仪器
JEM-F200型透射电镜(日本电子株式会社);BJ005266型PCR仪(美国Bio-Rad公司);BG-verMIDI型垂直式电泳仪(北京百晶生物技术有限公司);Image Lab型凝胶分析系统(美国BIO-RAD公司);MK3型多功能酶标仪(美国ThermoFisher仪器有限公司);FPMIC-razoII型病理切片机(孚光精仪(中国)有限公司)。
2 实验方法
2.1 DN模型建立
实验小鼠适应性饲养3天后,喂养高脂高糖饲料(实验室自制。配方:猪油∶蔗糖∶蛋黄∶基础饲料=18∶20∶3∶59),连续8周,自实验第1天开始按100 mg/kg剂量腹腔注射STZ柠檬酸钠溶液,连续7天。实验第8天尾静脉检测小鼠血糖水平,以血糖大于16.7 mmol/L为糖尿病模型成模标准。DN小鼠需具备以下条件:随机血糖大于13.8 mmol/L,并伴有胰岛素抵抗;出现尿蛋白、肾功能异常及相应肾组织病理学特征,视为模型建立成功[5]。造模及各实验组给药时间节点见图1。

图1 造模及各实验组给药时间节点Fig.1 Model and administration time points of each group
2.2 分组与给药
选择模型建立成功的小鼠,按体重随机分为模型组(model)、格列美脲组(glim,0.6 mg/kg/d,ig)、Emo高剂量组(50 mg/kg/d,ig)、Emo低剂量组(25 mg/kg/d,ig),每组10只。另取10只未建立模型小鼠作为正常组(normal)。自造模第7周开始灌胃(ig)给药,连续7天。实验第8天,尾静脉取血检测血糖(blood glucose,BG),取血后用2%戊巴比妥钠腹腔注射麻醉小鼠,颈椎离断处死后取肾脏,置冰台上去除被膜,滤纸吸干血迹后称质量。部分小鼠肾脏处理如下:取少量左肾上极皮质固定于预冷的2.5%戊二醛中,用于电镜检测;其余肾脏纵向切开,1/4置于10%中性福尔马林中固定,然后进行PAS染色,另外1/4肾脏进行冰冻切片。部分小鼠肾脏用于分离肾小球。
3 检测指标
3.1 肾脏重量系数检测
以左右两侧肾脏重量(mg)除以小鼠体重(g)来作为肾脏重量系数(mg/g)。
3.2 病理形态学检测
实验结束后,取各实验组小鼠肾脏组织,经10%中性福尔马林固定48 h,梯度酒精脱水,二甲苯透明,石蜡包埋,切片,HE染色,电子显微镜检测肾脏病理形态改变。
3.3 肾小球ROS含量检测
采用ROS荧光探针-二氢乙啶法(dihydroethidium,DHE)检测各实验组小鼠肾脏ROS含量。DHE可自由透过活细胞膜进入细胞内,并被细胞内ROS氧化形成氧化乙啶,氧化乙啶可掺入染色体DNA中,产生红色荧光。再利用流式细胞仪测定ROS阴性细胞和ROS阳性细胞的比值即可表征肾小球ROS含量。
3.4 肾脏生化指标检测
取各实验组小鼠肾脏组织,以生理盐水为匀浆介质手动匀浆,3 000 rpm离心10 min,取上清匀浆液,ELISA测定肾脏组织BUN、Cr、uAE含量。
3.5 电镜检测
取小鼠肾脏皮质组织,用3%的戊二醛固定3 h,再用1%的锇酸固定1 h,50%~90%的丙酮梯度脱水,Epon812包埋。取包埋块进行薄切片,甲苯胺蓝染色,光镜下半薄定位后进行超薄切片,醋酸铀和枸橼酸铅双染色,最后在透射电镜下观察各实验组肾脏足细胞自噬情况。
3.6 RT-qPCR检测
TRIzol法提取肾脏组织RNA,使用逆转录试剂盒获得cDNA,进一步使用SYBR-Green在PIKO Red96 RT-PCR扩增仪上进行qPCR。以U6为内参,检测各实验组小鼠肾脏miR-21水平。所用引物如下:miR-21:5′-UACTAUUCCAAAGAAGTCACCAC-3′;U6:5′-CGATGTTGACATCCGTAAAGACC-3′。
3.7 Western blot检测
取肾脏组织约100 mg,样品加适量RIPA buffer细胞裂解液,细胞样品器反复吹打,组织样品使用超声波细胞破碎仪进行破碎,然后冰上孵育30 min。12 000 rpm,4 ℃离心20 min,转移上清至新管。使用Lowry法测定上清液中蛋白含量,根据蛋白含量制作样品。SDS-PAGE凝胶电泳,然后将蛋白电转到硝酸纤维素膜上,用含5%脱脂奶粉的TBS中封闭,加入一抗,4 ℃封闭过夜;第2天用TBS洗膜3次,加入辣根过氧化物酶偶联的二抗室温下摇床上孵育1 h;取出 PVDF膜,用TBST洗3次,每次5 min。应用全自动数码凝胶成像系统成像,使用ScionImage软件对蛋白电泳带进行灰度值分析,以β-actin作为内参照蛋白进行校准,采用目标蛋白条带灰度值/β-actin条带灰度值来表示p62、Atg7、LC3的相对蛋白表达水平。
3.8 统计学分析
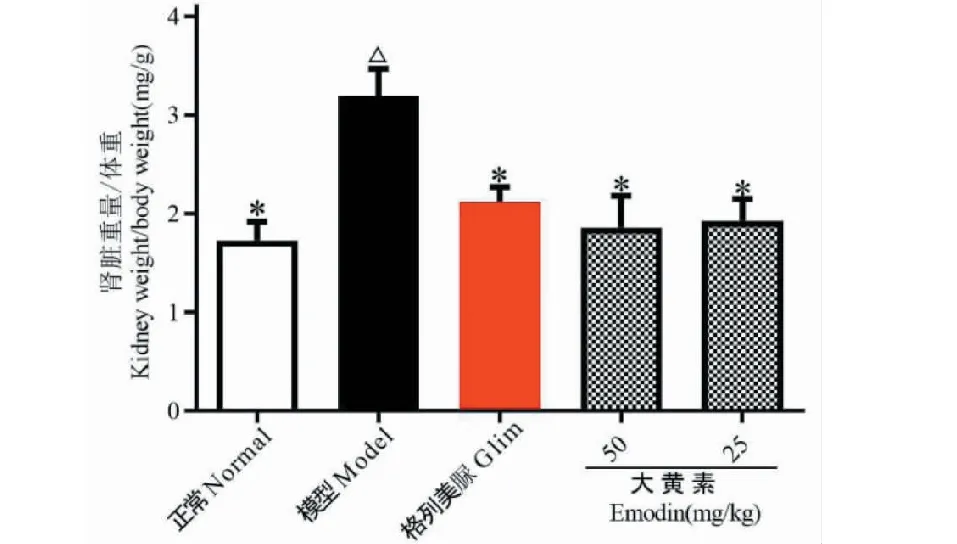
图2 大黄素对DN小鼠肾脏重量指数的影响Fig.2 Effects of emodin on kidney weight index in DN mice注:与正常组比较,△P<0.05;与模型组比较,*P<0.05。Note:Compared with normal,△ P<0.05;Compared with model,* P< 0.05.
4 实验结果
4.1 对小鼠肾脏重量系数的影响
实验结果如图2所示。与正常组比较,模型组小鼠肾脏重量系数显著增大(P<0.05);与模型组比较,大黄素给药组小鼠肾脏重量系数显著减小(P<0.05)。表明大黄素口服给药可明显减轻DN小鼠肾脏炎性水肿。同时Glim组小鼠肾脏重量系数较模型组比较也显著减小(P<0.05)。
4.2 对小鼠肾脏病理形态的影响
实验结果如图3所示。图3A所示,正常组小鼠毛细血管清晰,呈网状,系膜区未见增生。DN小鼠炎症性水肿、纤维化明显,如图3B所示。大黄素高、低剂量组小鼠肾脏结构基本恢复正常,图3D和图3E所示。
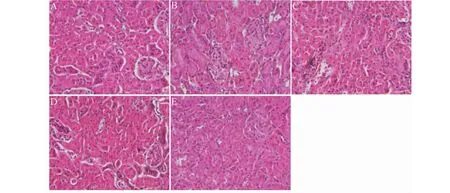
图3 各实验组小鼠肾脏病理形态(HE,×200)Fig.3 Pathological morphology of mouse kidney in each experimental group(HE,×200)注:A:Normal;B:Model;C:Glim;D:Emo 50 mg/kg;E:Emo 25 mg/kg,下同。 Note:A:Normal;B:Model;C:Glim;D:Emo 50 mg/kg;E:Emo 25 mg/kg,the same below.
4.3 各实验组小鼠肾脏ROS含量比较
实验结果如图4所示。与正常组比较,模型组小鼠肾脏ROS含量显著增大(P<0.05);与模型组比较,大黄素给药组小鼠肾脏ROS含量显著减少(P<0.05)。表明大黄素口服给药可明显清除DN小鼠肾脏ROS。Glim组小鼠肾脏ROS与模型组比较无显著变化。
4.4 对DN小鼠血糖(BG)和肾脏BUN、Cr、uAE含量的影响
实验结果如表1所示。与正常组比较,模型组小鼠BG、BUN、Cr和uAE含量均显著增大(P<0.05);与模型组比较,大黄素高、低剂量组小鼠BG、BUN、Cr和uAE含量均显著降低(P<0.05)。同时Glim组小鼠BG、BUN、Cr和uAE含量较模型组也均显著降低(P<0.05)。
4.5 各实验组小鼠肾脏足细胞自噬的透射电镜观测结果
实验结果如图5所示。从图5A可见,正常组小鼠肾脏足细胞可见较多自噬体及凋亡小体,表明正常情况下,肾脏足细胞自噬程度较高;DN发生时,足细胞自噬体和凋亡小体明显减少;而大黄素作用后,小鼠肾脏足细胞自噬体及凋亡小体明显增多,如图5D、5E所示,表明大黄素口服可显著促进DN小鼠肾脏足细胞自噬。Glim组小鼠肾脏足细胞也能观测到少量自噬体,但和模型组比较无明显变化(见图5C)。
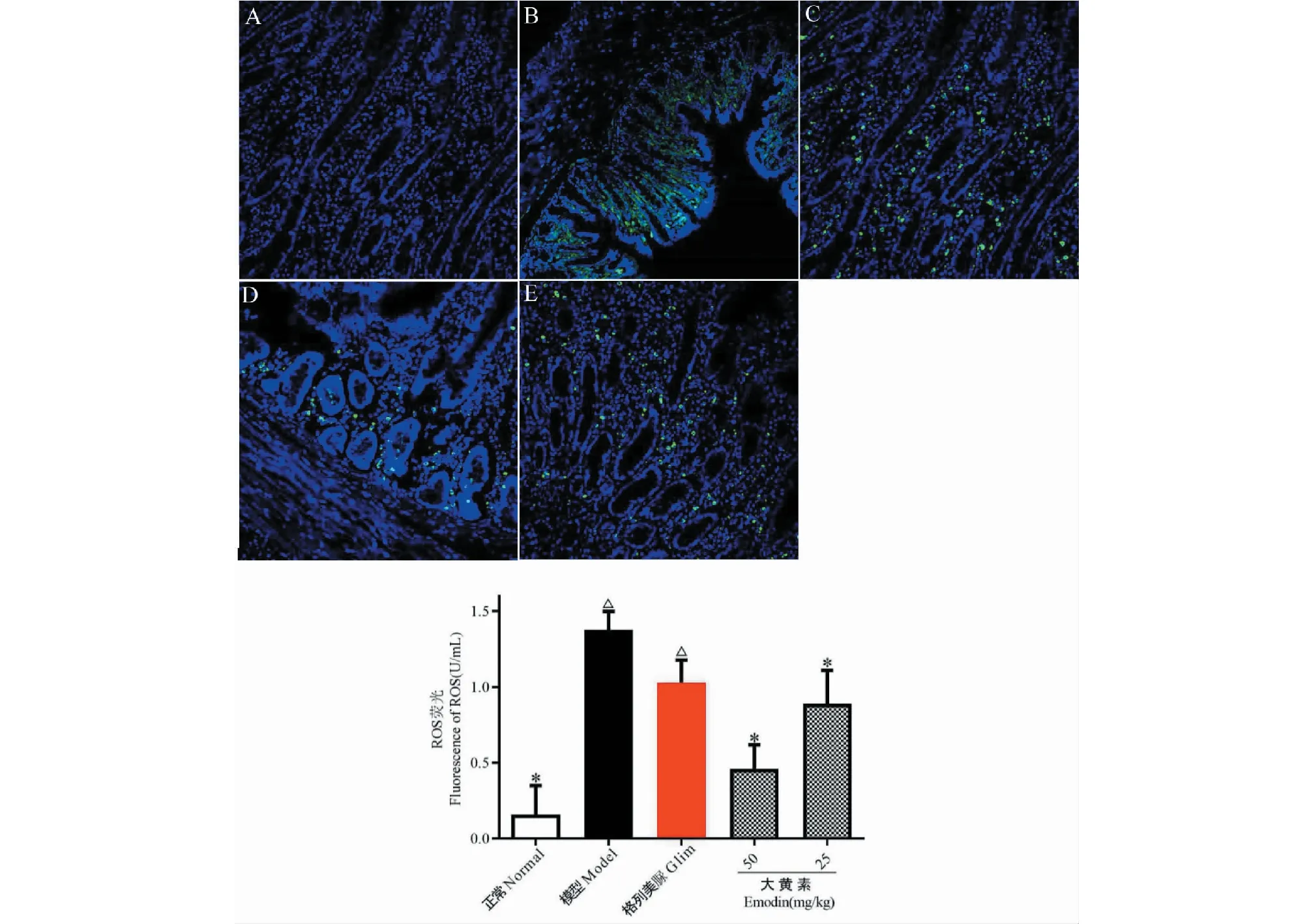
图4 各实验组小鼠肾脏ROS含量Fig.4 ROS content in kidney of mice in each experimental group注:与正常组比较,△ P<0.05;与模型组比较,* P<0.05。Note:Compared with normal,△P<0.05;Compared with model,*P<0.05.
表1 各实验组小鼠血糖和肾脏BUN、Cr、uAE含量Table 1 Blood glucose and kidney BUN,Cr,uAE contents of mice in each experimental group
4.6 对DN小鼠肾脏miR-21表达的影响
实验结果如图6所示。与正常组比较,模型组小鼠肾脏miR-21表达显著增多(P<0.05);表明miR-21与DN的发生呈正相关。与模型组比较,大黄素给药组小鼠肾脏miR-21表达显著减少(P<0.05),提示大黄素可下调DN小鼠肾脏miR-21的表达。
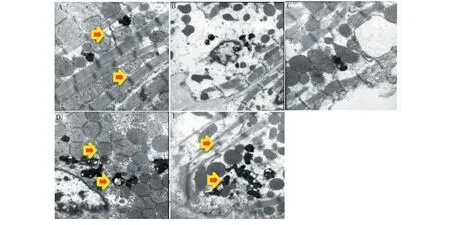
图5 各实验组小鼠肾脏足细胞自噬的电镜检测Fig.5 Electron microscope detection of autophagy of kidney podocytes of mice in each experimental group
4.7 各实验组小鼠肾脏p62、Atg7、LC3蛋白表达
实验结果如图7所示。与正常组比较,模型组小鼠肾脏p62、Atg7、LC3蛋白表达显著减少(P<0.05);与模型组比较,大黄素给药组小鼠肾脏p62、Atg7、LC3蛋白表达显著上调(P<0.05)。
5 讨论与结论
糖尿病肾病患者及动物模型肾组织中已被证实有氧化应激和凋亡发生,体外实验也发现高糖环境可诱导足细胞发生氧化应激、凋亡、炎症等事件。肾脏足细胞对于维持肾小球滤过屏障的完整性、调节肾小球的通透性具有重要作用。在此过程中,肾小球足细胞自噬与糖尿病肾病发病密切相关。一旦足细胞自噬活性改变,过度激活或者被抑制,都会造成足细胞炎性损伤、滤过屏障受损[8,9]。本实验中我们也观察到DN小鼠肾脏足细胞自噬严重不足,同时ROS显著增多,ROS是足细胞线粒体内的信号分子,是糖尿病及其并发症发生发展始动的环节[10],减少ROS产生是一种潜在的预防DN 进展的方法。小鼠灌胃给与大黄素以后,我们观察到肾脏ROS显著减少,自噬程度得到增强,进而一系列级联反应得到改善,如肾脏炎性病理损伤明显减轻、BUN、Cr和uAE含量显著降低。因此,通过促进自噬清除高糖诱导的小鼠肾脏ROS可能是大黄素改善DN小鼠的重要机制。同时我们也看到,Glim也可显著降低DN小鼠BUN、Cr和uAE水平。Glim为磺酰脲类降糖药物,其作用机制是通过与胰腺β-细胞表面的磺酰脲受体结合而在体内均匀、缓慢释放。同时Glim可增强周围组织对胰岛素敏感性,同时具有改善胰岛素抵抗作用,周围组织对葡萄糖的利用增加,血糖下降明显。血糖达标后,糖基化终末产物生成减少,对肾脏的损害减轻。
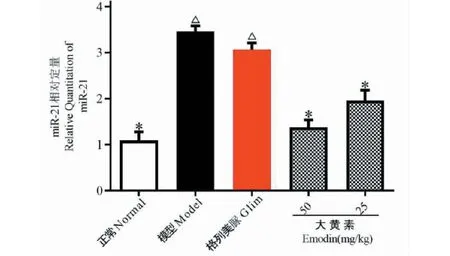
图6 各实验组小鼠肾脏miR-21表达Fig.6 MiR-21 expression in mouse kidney of each experimental group注:与正常组比较,△P<0.05;与模型组比较,*P<0.05。Note:Compared with normal,△P<0.05;Compared with model,*P< 0.05.
miR-21作为广谱基因,已被证实与DN发病成正相关。国内外已有文献表明,miR-21可通过介导TGF-β/Smad、PTEN/Akt、MMP-S/TIMPS等信号通路参与DN的发生发展[11]。自噬方面,也有文献报道miR-21可干预Akt/mTOR信号通路抑制肾脏足细胞自噬而加重DN的发病[12]。这些证据都表明,抑制miR-21进而调控其下游通路是改善DN的有效策略。本研究也看到,DN小鼠较正常组小鼠肾脏miR-21表达显著上调,这可能与DN小鼠肾脏自噬减弱有关系。在非DN疾病中,miR-21也被证明通过负调控自噬参与到肺纤维化、巨噬细胞、缺氧卵圆细胞等生命活动中。大黄素给药后,DN小鼠肾脏miR-21表达显著下调,而自噬抑制得到解除。但大黄素是否直接介导自噬还是通过调控miR-21介导细胞自噬需要借助靶基因预测分析进行确证,因为也有研究者报道大黄素可通过溶酶体途径、线粒体途径调控自噬,但是否与调控miR-21有关需要深入研究。
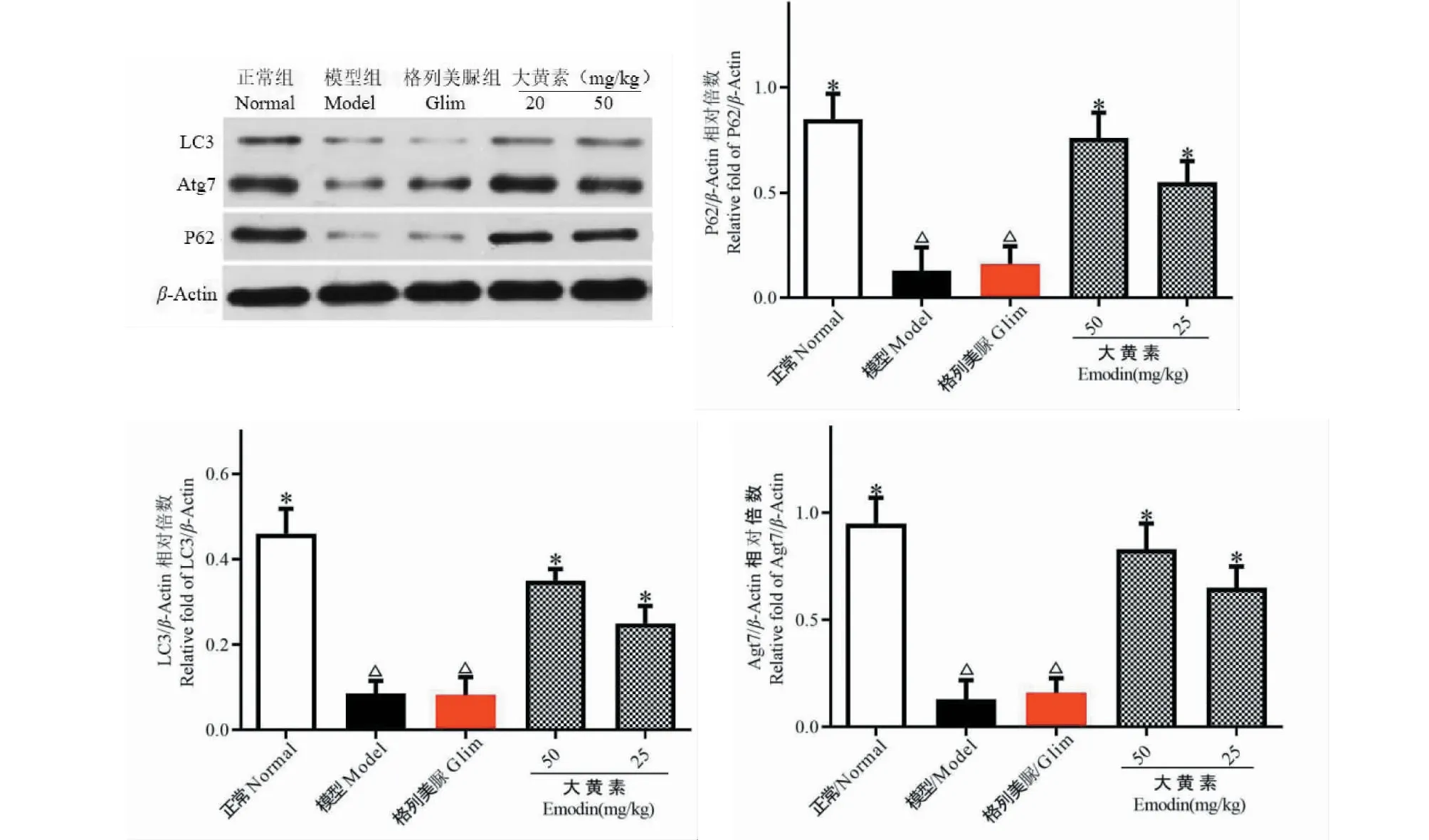
图7 各实验组小鼠肾脏LC3、Atg7、p62蛋白表达Fig.7 Expression of LC3,Atg7 and p62 proteins in the kidneys of mice in each experimental group注:与正常组比较,△P<0.05;与模型组比较,*P<0.05。Note:Compared with normal,△P<0.05;Compared with model,*P<0.05.
在自噬机制探索方面,我们检测了P62、Atg7和LC3三个经典的自噬标志性蛋白的表达,这三个蛋白是自噬溶酶体途径的关键成员,而自噬溶酶体途径在消除、降解受损细胞器、变性蛋白质等生物大分子具有重要作用,是细胞的重要修复机制[13]。故我们推测大黄素增强自噬恢复DN小鼠肾脏病理、生理功能可能与自噬溶酶体途径有关。结果表明,大黄素给药后DN小鼠肾脏P62、Atg7和LC3三种蛋白表达上调,提示大黄素可能作用于肾脏足细胞自噬溶酶体途径对DN小鼠肾脏产生保护作用。
