LncRNA DCST1-AS1结合ALDOA促进三阴性乳腺癌细胞的侵袭 *
2020-02-01王琴唐莉
王琴,唐莉
(江苏省肿瘤医院&江苏省肿瘤防治研究所&南京医科大学附属肿瘤医院检验科,南京 210009)
三阴性乳腺癌(triple negative breast cancer,TNBC)是雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)均为阴性的异质性疾病,具有侵袭程度高、易远处转移等特点,是乳腺癌中预后较差的亚型,而寻找有效的分子诊断指标和治疗靶标是解决这一困境的有效途径。
DC-STAMP域包含1-反义链1(DC-STAMP domain containing 1-antisense 1,DCST1-AS1)是本课题组采用长链非编码RNA(long non-coding RNA,LncRNA)芯片在TNBC组织中筛选获得的上调表达的LncRNA并证实DCST1-AS1可作为TNBC有效的分子诊断指标,且能够通过与miR-873-5p和致癌基因MYC形成正调控环以促进TNBC细胞的增殖和转移[1]。此外,笔者还发现DCST1-AS1可以通过与膜联蛋白A1(ANXA1)结合通过促进上皮-间质转化(EMT)以增强TNBC细胞的化学耐药性[2]。本研究拟进一步分析DCST1-AS1通过结合果糖二磷酸醛缩酶A(fructose-bisphosphate aldolase A,ALDOA)促进TNBC细胞侵袭的机制。
1 材料和方法
1.1细胞系、主要试剂及仪器 三阴性乳腺癌细胞系MDA-MB-231和BT-549(中国科学院上海细胞库),LncRNA芯片(上海康成公司),L-15培养基、RPMI 1640培养基、胰蛋白酶-EDTA(0.25%)和胎牛血清(fetal bovine serum,FBS)均购自美国Gibco公司,PrimeScript RT试剂盒和TB Green®Premix Ex TaqTMⅡ试剂盒(日本TaKaRa公司),Magna RIP RNA结合蛋白免疫沉淀试剂盒(美国Merck Millipore公司),RIPA裂解液(上海碧云天公司),多克隆兔抗体anti-ALDOA(ab245469)和羊抗兔anti-IgG(ab205718)购自美国Abcam公司,ALDOA小干扰RNA(small interfering RNA, siRNA)和阴性对照(small interfering negative control, siNC)购自上海吉玛公司),转染试剂Lipofectamine RNAiMAX(美国Invitrogen公司)。LightCycler PCR仪(美国Roche公司),Trans-Blot SD半干转膜仪(美国Bio-Rad公司),Corning®BioCoatTM肿瘤浸润24孔板(美国Corning公司),OneDrop超微量分光光度仪(南京五义公司),Triple TOFTM 5600-plus液质联用质谱仪(美国AB Sciex公司)。
1.2细胞培养 MDA-MB-231细胞使用含10%FBS的L-15培养基,置于37 ℃、空气培养箱中培养。BT-549细胞使用含10%FBS的RPMI 1640培养基,置于37 ℃、5%CO2培养箱中培养。
1.3RNA提取及RT-PCR反应 用Trizol试剂提取细胞总RNA,单次提取RNA的细胞总数不少于106个,使用OneDrop超微量分光光度仪检测吸光度(A260/280 nm)值,取A260/280 nm值在1.9~2.1间的样本用于后续检测。按照PrimeScript RT试剂盒说明书将总量为1 μg RNA逆转录为cDNA,样本置于-20 ℃保存。使用Primer Premier 6.0软件设计引物,由上海生工公司合成。DCST1-AS1(NR_040773.1)上游引物序列:5′-CCACTCACCAGCTTCTTC-3′;下游引物序列:5′-CTTCTGCTATGTCTCACAC-3′,退火温度为56 ℃,扩增片段长度为236 bp。ALDOA(NM_001127617.2)上游引物序列:5′-TGTCAGGGGCTTCAGGTTTC-3′;下游引物序列:5′-TAGTAGCAAGTTCCTGCGGC-3′,退火温度为56 ℃,扩增片段长度为203 bp,以GAPDH作为内参计算相对mRNA表达[3]。使用LightCycler PCR仪及TB Green®Premix Ex TaqTMⅡ试剂盒进行实时荧光定量PCR检测。PCR总反应体积为20 μL,包括:TB GreenPremix Ex Taq Ⅱ(2×)10 μL,上、下游引物(10 μmol/L)各0.8 μL,DNA模板2 μL,灭菌水6.4 μL。使用两步法进行PCR扩增,循环参数: 95 ℃ 30 s; 95 ℃ 5 s,56 ℃ 20 s,共40个循环。在56 ℃时收集每个循环的荧光信号,进行熔解曲线分析。采用仪器自带软件分析扩增曲线和熔解曲线中的荧光信号,并计算平均阈值循环数(Ct值)。通过2-ΔΔCt法计算待测基因的相对表达量,公式:ΔCt实验组=Ct实验组待测基因-Ct实验组GAPDH,ΔCt对照组=Ct对照组待测基因-Ct对照组GAPDH;ΔΔCt=ΔCt实验组-ΔCt对照组。
1.4RNA pulldown和质谱测定 通过体外转录获得DCST1-AS1的正义链和反义链,并使用T4 RNA连接酶将单个脱硫生物素化胞苷二磷酸酯连接至RNA链的3′末端。将1 μg生物素化的DCST1-AS1正义链和反义链分别与50 μL重悬的链霉亲和素标记的磁珠混合,4 ℃温育过夜,再加入BT-549细胞的裂解液中室温温育1 h,同时加入RNase抑制剂。用Triple TOFTM 5600-plus液质联用质谱仪分析与RNA结合的蛋白质。通过Proteinpilot软件分析结果:在可信度≥95%,至少包含1个肽段时读取数据,同时剔除角蛋白、抗体蛋白、血清清蛋白等常见污染蛋白质。用于转录的DCST1-AS1上游引物序列:5′-TAATACGACTCACTATAGGGAAAGCCCGGGAGCGCGCAGACTTGGCTGTGCG-3′;下游引物序列:5′-TTTTTTCACACTTTACAGAGTTTGTTTAATGT-3′。用于扩增反义DCST1-AS1的上游引物序列:5′-TAATACGACTCACTATAGGGTTTTTTCACACTTTACAGAGTTTGTTTAATGT-3′;下游引物序列:5′-AAAGCCCGGGAGCGCGCAGACTTGGCTGTGCG-3′。
1.5RNA免疫沉淀试验测定 按照Magna RIP RNA结合蛋白免疫沉淀试剂盒说明书操作进行RNA免疫沉淀(RNA immunoprecipitation, RIP),用以测定TNBC细胞中能与ALDOA蛋白结合的DCST1-AS1。用于免疫沉淀的ALDOA抗体加入量为每反应管5 μg,以IgG作为阴性对照。按照上述实时荧光定量PCR步骤扩增anti-ALDOA和IgG沉淀中的DCST1-AS1和GAPDH,并以IgG沉淀组中的DCST1-AS1作为阴性对照。通过2-ΔΔCt法计算anti-ALDOA沉淀组中DCST1-AS1的相对表达量。
1.6western blot 使用本课题组前期工作[1]中制备的用慢病毒作为载体的稳定干扰DCST1-AS1的BT-549-sh细胞及其阴性对照BT-549-NC,稳定过表达DCST1-AS1的MDA-231-exp细胞及其阴性对照MDA-231-NC。将细胞分别接种于6孔细胞培养板中,当细胞融合度达90%、单孔细胞总数不少于106个时,收集细胞,用预冷的PBS洗涤并用RIPA缓冲液裂解。使用标准Bradford试剂盒测定细胞裂解液中的蛋白质水平,用10%SDS-PAGE电泳分离总蛋白质,使用Trans-Blot SD半干转膜仪调节稳定电流为200 mA,转膜120 min,将蛋白质转移至聚偏二氟乙烯膜,用TBST充分洗涤。随后用含5%BSA的TBST封闭,室温摇床振荡温育2 h。再次用TBST充分洗涤后,加入多克隆兔抗体anti-ALDOA(1∶1 000稀释)与膜在4 ℃摇床温育过夜。加入辣根过氧化物酶偶联的山羊抗兔抗体anti-IgG(1∶2 000稀释)与膜在室温摇床振荡反应2 h。用GAPDH作为蛋白质表达的内参照。使用SYNGENE G:BOX chemiXR5系统(英国Syngene公司)采集图像,并使用Gel-Pro32软件读取并计算ALDOA和GAPDH的蛋白质灰度值。
1.7细胞侵袭能力测定 预包被基质胶的Corning®BioCoatTM肿瘤浸润24孔细胞培养板[该小室由Transwell膜滤器(孔径为8 μm)插入24孔细胞培养板中组成],用不含血清的培养基将待测细胞密度调节至2.5×105mL,取200 μL细胞悬液加入小室上室中,并将500 μL含10%FBS的培养基加入小室下室中,置于37 ℃细胞培养箱中温育10 h。使用棉签擦去小室膜上层的基质胶和未穿过膜的细胞。用4%多聚甲醛固定膜下层细胞后用结晶紫染色,通过倒置显微镜观察比较穿过基质胶与膜小孔的细胞。
1.8统计学分析 采用GraphPad Prism 7统计软件处理数据,所有实验数据至少重复3次。配对t检验用于RT-PCR中实验组与对照组差异的比较。单尾ANOVA用于TCGA乳腺癌阵列中肿瘤组织与正常组织的基因表达差异的比较。Pearson相关性系数用于分析DCST1-AS1与靶蛋白表达之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1DCST1-AS1的靶蛋白分析 通过RNA pulldown测定,共计有25种蛋白质能特异性与DCST1-AS1正义链结合。将这25种蛋白质与本课题组前期检测的三阴性乳腺癌组织LncRNA芯片数据中显著上调表达的2 092种基因[1]进行整合(Gene Expression Omnibus GSE115275),结果发现磷酸三糖异构酶1(triosephosphate Isomerase 1, TPI1)、ALDOA和角蛋白(corneodesmosin, CDSN)同时存在于这2项检测中(图1)。TPI1、ALDOA、CDSN蛋白分子中与DCST1-AS1结合的序列分别为SNVSDAVAQSTR、ALANSLACQGK和SNVSDAVAQSTR。

图1 韦恩图分析乳腺癌组织芯片检测结果和pulldown蛋白的质谱检测结果
2.2DCST1-AS1与ALDOA表达的相关性分析 通过GEPIA2分析癌症基因组图集(The Cancer Genome Atlas,TCGA)中的乳腺癌阵列结果发现,ALDOA在乳腺癌中显著上调表达,TPI1、CDSN在乳腺癌组织和正常组织中的表达差异无统计学意义(图2)。Pearson相关性分析发现,DCST1-AS1与ALDOA表达量呈正相关(r=0.19,P<0.01),而与TPI1(r=0.013,P=0.65)、CDSN(r=0.045,P=0.12)的表达量均无相关性。

注:T,肿瘤组织(红色);N,正常组织(灰色);TPM,每百万映射读取的转录本;**,P<0.01。
2.3DCST1-AS1与ALDOA结合并影响其表达 RT-PCR检测发现,与阴性对照组(100%)相比,ALDOAmRNA的相对表达量在DCST1-AS1缺失时下调至58.8%(t=15.6,P<0.05),而在DCST1-AS1过表达时上调至368.8%(t=35.6,P<0.05);TPImRNA在DCST1-AS1缺失时下调至98.0%(t=1.10,P=0.33),而在DCST1-AS1过表达时上调至119.1%(t=2.46,P=0.07);CDSNmRNA在DCST1-AS1缺失时上调至112.2%(t=2.21,P=0.10),而在DCST1-AS1过表达时上调至132.1%(t=2.23,P=0.09)(图3A)。western blot检测结果表明,ALDOA在蛋白质水平的变化趋势与mRNA水平相同(图3B)。进一步用剩余的拉下蛋白液进行western blot鉴定,发现只有DCST1-AS1正义链拉下的蛋白液中检测到ALDOA(图3C)。RIP结合RT-PCR实验表明,在ALDOA蛋白的RNA沉淀物中检出的DCST1-AS1表达量是阴性对照组的455.7倍(t=51.5,P<0.05)。

注:A,RT-PCR检测DCST1-AS1缺失和过表达时TPI1、ALDOA和CDSN mRNA的变化,*,P<0.05;B,western blot检测DCST1-AS1敲减和过表达时ALDOA蛋白质水平的变化;C,western blot检测DCST1-AS1的正义链和反义链拉下蛋白液中的ALDOA。
2.4DCST1-AS1结合ALDOA促进乳腺癌细胞的侵袭 RT-PCR结果表明,ALDOA siRNA能有效干扰MDA-MB-231细胞中的ALDOAmRNA,将ALDOA mRNA下调至对照组的10.8%(t=29.8,P<0.05),而DCST1-AS1表达并未受到明显影响(t=1.91,P=0.13)(图4A)。Transwell侵袭试验表明,干扰ALDOA的表达抑制了MDA-231-exp细胞的侵袭(图4B)。
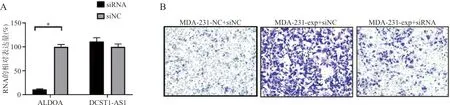
注:A,RT-PCR检测ALDOA siRNA的干扰效率,*,P<0.05;B,Transwell侵袭试验检测ALDOA对DCST1-AS1侵袭能力的影响(×200)。
3 讨论
LncRNA的失调是在各种癌症中观察到的特征标志之一[4]。本课题组前期研究发现,DCST1-AS1在TNBC中上调表达且与癌组织的远端转移(P=0.024)及病理组织学(P=0.026)分级相关;DCST1-AS1能够促进乳腺癌细胞的增殖、转移和化疗耐药性[1-2]。除了乳腺癌,DCST1-AS1作为促癌因子发挥作用也在其他类型的癌症中得到了证实。有学者指出,DCST1-AS1在子宫内膜癌中表达上调并通过影响Notch1蛋白促进癌症侵袭和转移[5]。DCST1-AS1参与调节AKT/mTOR信号通路,促进肝癌细胞的增殖、转移和自噬[6]。DCST1-AS1可以通过竞争内源性miR-605-3p调节胃癌细胞的增殖、迁移、侵袭和凋亡[7]。在本研究中,笔者提出DCST1-AS1能够与ALDOA直接结合,通过调控ALDOA的表达以促进三阴性乳腺癌细胞的侵袭。
ALDOA是关键的糖酵解酶,在包括乳腺癌在内的多种类型的癌症中呈高表达,被认为是独立的癌症临床预后标志物[8]。ALDOA在促进癌症转移方面的功能得到了广泛的研究;有学者证实ALDOA能够促进上皮间质转化(EMT),从而促进宫颈癌恶性进程[9];ALDOA的过表达增加了肺癌细胞系在体外的迁移和侵袭以及体内转移性肺癌灶的形成[10]。以抑制ALDOA功能为目的全身治疗可以显著增加转移性乳腺癌异种移植模型的总体存活率,因此,有学者提出ALDOA可作为癌症潜在治疗靶点[11]。通过分析TCGA中的乳腺癌阵列,我们发现DCST1-AS1和ALDOA的表达呈正相关,干扰ALDOA的表达能抑制DCST1-AS1的促侵袭能力,表明ALDOA协同DCST1-AS1在TNBC细胞的侵袭过程中发挥作用。本研究证实了DCST1-AS1可结合ALDOA,具有促癌功能,后续的工作将围绕DCST1-AS1与ALDOA蛋白结合的具体序列,DCST1-AS1上调ALDOA的表达的具体机制等问题展开。
癌症相关LncRNAs的鉴定和功能分析成为全面了解癌症生物学和随后的诊断和治疗的重要步骤[12]。本课题组前期研究已经证实DCST1-AS1上调表达在TNBC诊断、增殖、侵袭、耐药中的作用,本研究进一步证实DCST1-AS1通过结合ALDOA促进乳腺癌的侵袭。围绕DCST1-AS1的研究将有助于我们拓宽对TNBC进程中关键分子之间调控机制的认识,并从LncRNA角度为临床的分子诊断和治疗提供了新的思路。
