脓毒症患儿循环外泌体中长链非编码RNA HOXA11-AS的表达及临床价值
2020-02-01施芬罗汉清
施芬,罗汉清
(华中科技大学同济医学院附属武汉中心医院新洲院区&新洲区人民医院儿科,武汉 430400)
儿童脓毒症是造成患儿死亡的重要原因之一[1]。脓毒症患儿早期临床表现缺乏特异性,且诊断手段有限,常因此延误诊治而导致不良预后。寻找新的儿童脓毒症诊断标志物对提高脓毒症诊治水平具有极其重要的意义。外泌体是由多种类型细胞分泌的直径为30~150 nm 的小囊泡, 其含蛋白质、mRNA及长链非编码RNA(LncRNA)等,可在细胞间转运,介导细胞间信息的传递,并参与机体感染、炎症及氧化过程[2-3]。
研究表明,LncRNA HOXA11-AS在非小细胞肺癌和感染性疾病中的表达水平显著增加,是潜在的炎症标志物[4]。本研究旨在检测脓毒症患儿外周循环外泌体中LncRNA HOXA11-AS的表达水平,分析其对脓毒症筛查的临床价值。
1 材料和方法
1.1研究对象 收集2018年10月至2019年10月在新洲区人民医院儿科诊断和接受治疗的脓毒症患儿80例作为脓毒症组,其中男45例、女35例,年龄4个月~5岁。患儿入院时符合儿童脓毒症诊断标准[5],即具备以下2项或2项以上条件:(1)体温>38 ℃或<36 ℃;(2)心率>90 次/min;(3)呼吸频率>20次/min或PaCO2<32mmHg;(4)外周血WBC计数>12.0×109/L或<4.0×109/L,或未成熟粒细胞比例>10%。排除标准:(1)具有严重药物过敏史者;(2)先天性免疫功能缺陷者;(3)治疗配合不佳者。脓毒症患儿于确诊后行全身感染相关性器官功能衰竭(sepsis-related organ failure assessment,SOFA)评分,该评分系统包括呼吸系统、血液系统、肝脏、心血管系统、中枢神经系统及肾脏共6个系统评估,每项评分范围为0~4分,总分值范围为0~24分[6]。选取同期在儿科保健中心体检健康儿童60例作为对照组,其中男35例、女25例,年龄3个月~5岁。脓毒症组与对照组间年龄、性别差异均无统计学意义(P均>0.05)。
1.2主要仪器及试剂 蛋白质电泳仪(美国Bio-Rad公司),Jem-100cx Ⅱ型透射电子显微镜(日本日立电子公司),Nanosight NS300纳米颗粒跟踪分析仪(英国Malvern 公司),721型分光光度计(上海伯乐生命医学产品公司),7500 型实时定量PCR仪(美国ABI 公司)。逆转录试剂盒、qPCR 试剂盒、外泌体提取试剂盒(美国ABI 公司),Trizol试剂(美国Invitrogen公司),蛋白质印迹试剂盒(武汉博士德公司),C反应蛋白(CRP)检测试剂盒(上海依科赛生物制品公司),羊抗兔CD9、CD63及GAPDH单克隆抗体(美国BD公司),外泌体裂解液ExoSimple-Lysis(上海和序生物科技公司)。
1.3方法
1.3.1标本采集及血常规指标检测 脓毒症患儿在确诊后4 h内(对照组在入院体检时)采用乙二胺四乙酸二钾抗凝管采集静脉血标本5 mL, 335.4×g离心5 min,血浆置于-20 ℃保存。血常规指标由新洲区人民医院检验科中心实验室用全血细胞分析仪进行全血细胞分析,并计数WBC[参考范围:(1~3)×103/μL]。
1.3.2CRP浓度检测 采用夹心ELISA法,按照CRP检测试剂盒说明书操作,使用721型分光光度计检测吸光度(A450 nm)值,儿童CRP参考范围:0.17~2.2 μg/mL。
1.3.3外泌体提取和鉴定 取500 μL血浆,按照外泌体分离试剂说明书操作分离外泌体。提取的外泌体经4%多聚甲醛固定后滴加到铜网上,乙酸双氧铀负染,使用Jem-100cx Ⅱ型透射电子显微镜观察并鉴定外泌体的形态。
1.3.4western blot 取上述外泌体提取物,加入外泌体裂解液ExoSimple-Lysis,并以12 000×g离心25 min,采用BCA法测定蛋白质浓度。以每孔30 μg总蛋白质量上样,浓缩胶80 V电泳40 min,分离胶100 V电泳2 h,在蛋白质电泳仪上行常规湿法,电转膜至纤维素膜,PBST漂洗3次后加入羊抗兔CD9、CD63及GAPDH单克隆抗体(1∶200稀释)4 ℃温育过夜,50 g/L脱脂奶粉封闭过夜,PBST漂洗3次后,加入羊抗兔IgG二抗(1∶500稀释)于37 ℃温育4 h,PBST漂洗3次,ECL液显影,自动化一体机曝光,采用Quantity One 1-D分析软件对蛋白质印迹条带进行定量,以GAPDH为内参照,分析条带灰度值。目的蛋白质相对表达量=目的蛋白质灰度测定值/GAPDH条带灰度值,实验重复3次,取均值。
1.3.5实时荧光定量PCR(qRT-PCR)检测外泌体LncRNA HOXA11-AS表达 采用Trizol试剂提取上述血清外泌体中的总RNA,并使用721型分光光度计测量提取RNA的浓度和纯度,取吸光度(A260/280 nm)值为1.8~2.0的样本。按逆转录试剂盒说明书将RNA逆转录为cDNA,样本置4 ℃保存。以U6为内参照,按荧光定量PCR试剂盒说明书操作在LightCycler 480荧光定量PCR仪上进行PCR反应。PCR引物由上海吉玛生物科技公司设计及合成。引物序列参照文献[7]: LncRNA HOXA11-AS上游引物序列:5′-GCCCGTAACAGTCTACAGCCAT-3′,下游引物序列:5′-GCAGGGTCCGAGGTATTC-3′,退火温度 50 ℃,产物片段大小253 bp;U6上游引物序列:5′-CTCGCTTCGGCAGCACA-3′,下游引物序列:5′-AACGCTTCACGAATTTGCGT-3′。 PCR扩增体系为25 μL,包括ddH2O 15.2 μL,10×Taq buffer 2.5 μL,dNTP Mix(2 mmol/L) 2.5 μL,10 μmol/L上、下游引物各1 μL,MgCl2(25 mmol/L) 1.5 μL,Taq DNA Polymerase(5 U/μL) 0.3 μL,DNA模板1 μL。反应条件:95 ℃ 1 min;94 ℃ 30 s,60 ℃ 30 s,74 ℃ 30 s,共38次循环。采用SteponeTM软件进行熔解曲线分析,采用2-ΔΔCt法计算两组患者外泌体中LncRNA HOXA11-AS的相对表达量。
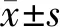
2 结果
2.1血清外泌体鉴定 外泌体在电镜下为圆形脂质双层膜囊状颗粒,大小为80~100 nm,见图1A;western blot结果证实,外泌体表面标志蛋白TSG101、CD9、CD63呈高表达, 见图1B。

注:A,外泌体透射电镜结果;B,western blot检测外泌体标志蛋白的表达。
2.22组LncRNA HOXA11-AS的表达、WBC计数及CRP浓度的比较 脓毒症患儿循环外泌体中LncRNA HOXA11-AS的表达水平显著高于对照组(1.54±0.89 vs 0.53±0.17,t=15.23,P<0.001); 此外,脓毒症组WBC计数[(14.53±1.44)×103/μL vs (8.53±1.04)×103/μL,t=9.43,P=0.021 ]和CRP浓度[(140.50±14.89) μg/mL vs (70.50±14.07)μg/mL,t=10.23,P=0.002 ]均显著高于对照组。
2.3SOFA评分与外泌体LncRNA HOXA11-AS及WBC和CRP的关系 脓毒症组患者外泌体中LncRNA HOXA11-AS的表达水平与SOFA评分[(8.35±4.39)分]呈正相关(r=0.589,P<0.001); 脓毒症组循环中WBC计数和SOFA评分无显著相关性(r=0.338,P=0.543),但CRP浓度和SOFA评分呈正相关(r=0.432,P<0.01)。
2.4脓毒症患儿外泌体LncRNA HOXA11-AS与外周血WBC计数和CRP浓度的关系 脓毒症组患儿外泌体中LncRNA HOXA11-AS的表达水平分别与WBC及CRP浓度呈正相关(r分别为0.561、0.614,P均<0.001)。
2.5脓毒症患儿各指标筛查效能的比较结果 以儿童脓毒症诊断标准为金标准,将脓毒症组和对照组患儿LncRNA HOXA11-AS的相对表达量、WBC计数及CRP浓度纳入ROC曲线分析,评估LncRNA HOXA11-AS筛查儿童脓毒症的效能。结果表明,外周循环中CRP浓度筛查脓毒症的ROC曲线下面积(area undercurve,AUCROC)为0.748(95%CI:0.639~0.817),当cut-off值为131.52时,敏感性为62.0%,特异性为71.3%;WBC计数筛查脓毒症的AUCROC为0.601(95%CI:0.513~0.669),当cut-off值11.67时,敏感性为64.5%,特异性为67.9%;外泌体LncRNA HOXA11-AS筛查脓毒症的AUCROC为0.947(95%CI:0.898~0.981),当cut-off值1.23时,敏感性为90.9%,特异性为93.9%。见图2。
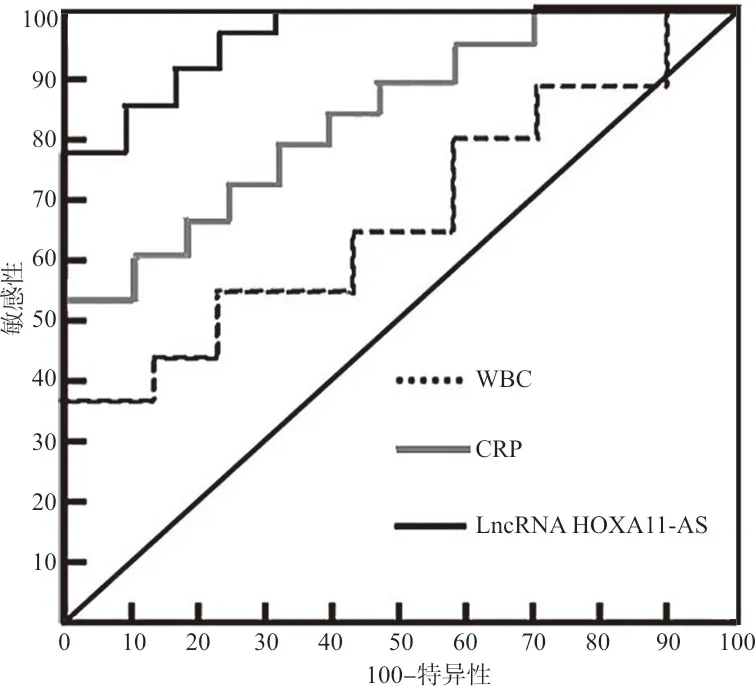
图2 外泌体LncRNA HOXA11-AS、CRP及WBC计数筛查脓毒症的ROC曲线
3 讨论
机体不受控制的炎症反应及免疫功能紊乱是脓毒症进展的主要原因之一。WBC计数和CRP浓度常用于诊断或评估脓毒症预后,但其特异性低,诊断效能不佳。研究发现,多种miRNA及LncRNA参与调控炎症及免疫过程,可用于脓毒症诊断及预后评估[8]。
外泌体是由多种类型细胞分泌的小囊泡,可通过释放包含于其内的蛋白质、RNA等小分子干预细胞生理过程。本研究提取各研究对象外周循环中的外泌体,并证实其表达外泌体标志物CD9和CD63蛋白,表明在健康儿童和脓毒症患儿中均存在高浓度的外泌体[9]。研究表明,外泌体与脓毒症发病关系密切。例如,内皮祖细胞分泌的外泌体富含miR-126分子,并可抑制高迁移率族蛋白1和血管黏附分子1表达,改善微血管内皮功能及脓毒症预后[10]。外泌体 SOCS-1 可作为脓毒症的标志物;而血小板衍生的外泌体等也可作为脓毒症多器官损伤的介质[11]。
LncRNA HOXA11-AS 基因定位于7p15.2染色体上,其在非小细胞肺癌(NSCLC)和肾脏炎症[12]中表达上调。LncRNA HOXA11-AS 可抑制miR-200b表达,促进上皮间质转化(EMT),进而促进NSCLC侵袭。有学者[4]证实, LncRNA HOXA11-AS在NSCLC和感染性疾病中的表达水平显著增加,可作为炎症标志物。据此,本研究检测了脓毒症患儿及健康儿童血清外泌体中LncRNA HOXA11-AS的表达水平,结果发现与健康儿童相比,脓毒症患儿循环外泌体中LncRNA HOXA11-AS的表达上调。然而,LncRNA HOXA11-AS 表达增加的机制目前尚不清楚,有文献报道,其可能与在感染和应激状态下免疫系统激活、炎症和NF-κB级联反应有关[13]。
SOFA 评分在临床上常用于评估脓毒症病情程度及预后,可客观反映脓毒症患者器官功能障碍程度。吴云朵等[14]证实,SOFA评分是判断脓毒症患儿预后的可靠指标。本研究发现脓毒症组外周血中WBC计数和CRP浓度高于对照组,且循环中LncRNA HOXA11-AS的表达水平和CRP浓度均与SOFA评分呈正相关,这与明颖等[15]报道的研究结果相一致。外泌体LncRNA HOXA11-AS的表达水平与WBC计数和CRP浓度呈正相关,提示LncRNA HOXA11-AS 水平与CRP浓度可评估脓毒症患儿病情严重程度。本研究结果还发现,WBC计数与SOFA评分无相关性,提示与脓毒症患儿病情严重程度缺乏相关性。
本研究进一步通过ROC曲线分析结果显示,脓毒症患儿外周循环外泌体中LncRNA HOXA11-AS筛查脓毒症的ROC曲线下面积﹑敏感性及特异性均明显高于WBC和CRP,提示外周循环外泌体中LncRNA HOXA11-AS 对脓毒症的筛查价值更优。此外,本研究虽证实外泌体中LncRNA HOXA11-AS与SOFA评分呈正相关,但其是否可用于判断脓毒症的严重程度,尚需要扩大样本量进一步研究。
