红麻谷胱甘肽还原酶基因(HcGR)的克隆及盐胁迫下表达分析
2020-01-21梁国旺李增强周步进常蒙蒙陈涛陈鹏
梁国旺 李增强 周步进 常蒙蒙 陈涛 陈鹏


摘要:【目的】克隆紅麻谷胱甘肽还原酶基因(HcGR)并分析其组织表达特性及不同盐胁迫下的表达模式,为深入研究HcGR基因在响应盐胁迫的分子调控机制提供理论参考。【方法】基于红麻转录组测序结果,克隆HcGR基因,对其序列进行生物信息学分析,并利用实时荧光定量PCR检测HcGR基因在红麻不同组织及不同盐度胁迫[CK(0 mmol/L NaCl)、T1(50 mmol/L NaCl)、T2(100 mmol/L NaCl)和T3(200 mmol/L NaCl)]下的表达情况。【结果】克隆获得的HcGR基因开放阅读(ORF)长度为1698 bp,其编码蛋白相对分子量为60 kD,由555个氨基酸残基组成,理论等电点(pI)为8.46,为亲水性蛋白,定位于叶绿体;HcGR蛋白二级结构以无规则卷曲为主,以α-螺旋、延伸链和β-转角为辅,所占比例分别为44.14%、27.75%、22.16%和5.95%,其三级结构由无规则卷曲、α-螺旋和延伸链3种结构元件相互盘绕而成;该蛋白与榴莲GR蛋白亲缘关系较近。HcGR基因在红麻根、茎和叶中均有表达,且相对表达量存在显著差异(P<0.05,下同),相对表达量排序为叶>根>茎,表明HcGR基因具有明显的组织表达特异性。在红麻的根和叶中,HcGR基因相对表达量随NaCl胁迫浓度增加整体上呈先升高后降低的变化趋势,且均在T1处理下达峰值,显著高于CK、T2和T3处理。HcGR基因在茎中的相对表达量随NaCl胁迫浓度增加呈波动变化趋势,但T1、T2和T3处理均高于CK,其中T1和T3处理显著高于CK。【结论】HcGR基因在红麻根、茎和叶中的表达具有明显组织特异性,且可被不同浓度NaCl诱导响应盐胁迫信号,并通过上调各组织中的转录水平以提高抗盐胁迫能力,故推测该基因在红麻抗盐胁迫机制中发挥重要调控作用。
关键词: 红麻;谷胱甘肽还原酶(GR);基因克隆;盐胁迫;实时荧光定量PCR;表达分析
中图分类号: S563.5 文献标志码: A 文章编号:2095-1191(2020)10-2412-08
Cloning of glutathione reductase gene(HcGR) and its expression in response to salt stress of kenaf (Hibiscus cannabinus)
LIANG Guo-wang1, LI Zeng-qiang1, ZHOU Bu-jin1, CHANG Meng-meng1,
CHEN Tao2, CHEN Peng1*
(1College of Agriculture, Guangxi University/Guangxi Colleges and Universities Key Laboratory of Plant Genetics and Breeding,Nanning 530004, China; 2Guangxi Subtropical Crops Research Institute, Nanning 530001, China)
Abstract:【Objective】To clone the glutathione reductase gene(HcGR) of kenaf(Hibiscus cannabinus) and analyze its tissue expression pattern under different concentrations of salt stress,so as to provide theoretical reference for further study on the molecular regulation mechanism of HcGR in response to salt stress. 【Method】The HcGR gene of kenaf was cloned based on the related fragments of kenaf transcriptome and analyzed by bioinformatics; the expression of HcGR in different tissues and salt stress[CK(0 mmol/L NaCl), T1(50 mmol/L NaCl), T2(100 mmol/L NaCl) and T3(200 mmol/L NaCl)] was studied by real-time fluorescence quantitative PCR. 【Result】The length of HcGR open reading frame(ORF) was 1698 bp,the relative molecular weight of encoded protein was 60 kD, encoding 555 amino acids,with theoretical isoelectric point(pI) of 8.46,and was predicted to be a hydrophilic protein and located in chloroplast. HcGR protein se-condary structure was dominated by irregular curl,α- helix,extension chain and β- turn,each with 44.14%,27.75%,22.16,and 5.95%. The tertiary structure consisted of irregular curl,α- helix and extension chain,and with a high homology with GR protein in durian. HcGR gene was expressed in the roots,stems and leaves of kenaf,and showed significant difference in tissue expression(P<0.05, the same below), with the relative expression level of leaf>root>stem. This indicated that HcGR had tissue expression specificity. The relative expression level in the roots and leaves increased firstly and then decreased with the increase of NaCl stress concentration,and reached the peak value under T1 treatment,which was significantly higher than that of CK, T2 and T3. In stem, the HcGR showed a fluctuated trend with the increase of NaCl concentration, however, the expression level under T1, T2 and T3 treatments(T1 and T3 reached significantly level) were higher than that in CK. 【Conclusion】The expression of HcGR in the roots,stems and leaves of kenaf has obvious tissue specificity and can be induced by NaCl at various concentrations to respond salt stress. up-regulating transcriptional level in different tissues can increase salt resistance ability. It is speculated that HcGR plays an important regulatory role in the mechanism of resistance to salt stress in kenaf.
Key words: kenaf; glutathione reductase(GR); gene cloning; salt stress; real-time fluorescence quantification PCR; expression analysis
Foundation item: National Natural Science Foundation of China(31560421,31960368);National Hemp Industry Technology System Construction Project(CARS-16-E14)
0 引言
【研究意义】土壤盐渍化是阻碍农业生产可持续发展的主要因素之一,已成为世界性的环境问题(赵可夫和范海,2002)。在盐胁迫的生长条件下,植物细胞代谢受阻而产生大量O2-、OH-及H2O2等活性氧(Reactive oxygen species,ROS),进而破坏ROS产生和清除间的动态平衡,致使蛋白质降解及核酸水解,最终引起细胞程序性死亡(Iahikawa et al.,2010;王康君等,2018)。谷胱甘肽还原酶(Glutathione reductase,GR)是植物抗氧化酶类中的关键成员之一,也是生物体中广泛存在的一种黄素蛋白氧化还原酶,对还原型谷胱甘肽(L-glutathione reduced,GSH)再生、维持胞内GSH/GSSG的高比率及细胞氧化还原平衡等植物生命过程和抗性生理发挥重要作用(邓治等,2014)。红麻(Hibiscus cannabinus)是锦葵科(Malvaceae)木槿属(Hibiscus)的一年生草本韧皮纤维作物,具有耐盐碱、易栽种等特性,是盐碱地改良的优势作物(陳涛等,2011)。因此,探究盐胁迫对红麻生长发育的影响,了解红麻耐盐机制,对增强红麻的盐碱地抗性和经济产量具有极其重要的社会经济和生态效应。【前人研究进展】GR通过抗坏血酸—谷胱甘肽(Ascorbate-glutathione,ASA-GSH)循环参与清除植物体内多余的ROS(Noctor et al.,2012;Gill et al.,2013),具体清除机制:GR将NADPH作为唯一的还原力和电子供体,催化氧化型谷胱甘肽(Oxidized glutathione,GSSG)还原为GSH(赵可夫和范海,2002)。目前,已从水稻(Wu et al.,2013)、苎麻(朱守晶等,2015)和拟南芥(Garnik et al.,2016)等植物中克隆鉴定出GR基因,并分析其表达模式,结果证实GR参与响应逆境胁迫。宋贵方等(2012)研究显示,陆地棉GR基因受干旱胁迫诱导上调表达;康太等(2016)研究表明,随着干旱程度的加深,柠条锦鸡儿叶片中CkGR基因的表达量与其酶活性呈逐渐上升趋势,说明CkGR基因对提高柠条锦鸡儿的耐旱性具有重要调控作用;张腾国等(2018)研究表明,高盐、高温、干旱和低温胁迫可诱导油菜GR1和GR2基因表达;李慧等(2019)研究表明,镉胁迫下豆梨PcGRchl和PcGRcyt基因在叶片中的表达量与对照(无镉胁迫)相比呈明显上调趋势。【本研究切入点】至今,鲜见有关红麻GR基因的相关研究报道。【拟解决的关键问题】基于红麻转录组测序结果,克隆红麻GR基因(HcGR),对其序列进行生物信息学分析,并利用实时荧光定量PCR检测HcGR基因在红麻不同组织及不同盐胁迫下的表达模式,为深入研究红麻耐盐性的分子调控机制提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为广西大学农学院周瑞阳教授馈赠的红麻P3A。主要试剂:FastPure Gel DNA Extraction Mini Kit、Taq Master Mix、FastPure Plasmid Mini Kit、DNA Marker、RNase A、DNase I(RNase-free)及HiScript? III RT SuperMix for qPCR反转录试剂盒等均购自北京全式金生物技术有限公司;其他化学试剂如氯化钠(NaCl)、苯酚、过硫酸铵和异戊醇等为进口或国产分析纯。主要仪器设备:紫外分光光度计(Thermo Scientific,美国)、PCR仪(BIO-RAD,美国)等。
1. 2 试验方法
1. 2. 1 盐胁迫处理及样品采集 2019年4月选取籽粒饱满、大小均匀的红麻种子,经清水冲洗干净置于40 ℃蒸馏水中浸种1 h,再用3% H2O2消毒10 min,蒸馏水冲洗5遍后,播种在垫有2层浸湿卫生纸的塑料盒中,置于恒温光照培养箱中发芽。培养箱昼夜温度为30和26 ℃,光照周期14 h/d,相对湿度62%~66%。每天向塑料盒中添加适量蒸馏水,5 d后选取生长健康、长势一致的幼苗,随机均分为4个组(每组35株),分别在1/2 Hoagland营养液中添加不同浓度的NaCl对幼苗进行盐胁迫处理:CK(0 mmol/L NaCl)、T1(50 mmol/L NaCl)、T2(100 mmol/L NaCl)和T3(200 mmol/L NaCl)。处理后移入育苗盘进行水培,间隔2 d更换1次处理液,7 d后分别收集植株根、茎和叶,置于-80 ℃冰箱保存备用。
1. 2. 2 总RNA提取及cDNA合成 参照贾瑞星(2019)改良的CTAB法提取红麻总RNA,用DNase I(RNase-free)去除RNA中残留的少量DNA,然后分别用0.8%琼脂糖凝胶电泳和NanoDrop 2000/2000c紫外分光光度计检验RNA完整性、纯度和浓度。以提取的总RNA为模板,按照HiScript? III RT SuperMix for qPCR(+gDNA wiper)反转录试剂盒说明反转录合成cDNA,于-20 ℃保存备用。然后用红麻跨内含子引物COXⅡ-F/COXⅡ-R(表1)检测逆转录产物cDNA中是否存在总DNA。所有引物均委托深圳华大基因科技有限公司合成。
1. 2. 3 HcGR基因克隆 基于红麻转录组GR基因序列(TRINITY_DN18735_c0_g1_i7_2),利用Primer 5.0设计引物GR-F/GR-R(表1)。采用2×Super Pfx Master Mix进行PCR扩增,阴性对照以ddH2O为模板。反应体系20.0 μL:cDNA模板1.0 μL,10 μmol/L上、下游引物各0.5 μL,Taq Master Mix 2.0 μL,ddH2O补足至20.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 120 s,进行34个循环;72 ℃延伸7 min,4 ℃保存。PCR产物经1.0%琼脂糖凝胶电泳检测后,以FastPure Gel DNA Extraction Mini Kit试剂盒進行回收纯化,将目的片段连接至Trans-blunt载体(pEASY?-Blunt Cloning Kit)上,然后转化Trans5α化学感受态细胞,涂布于含50 mg/L卡那霉素(Kan)的LB琼脂培养基上,37 ℃培养8~10 h。挑取单个菌落,接种于1 mL含50 mg/L Kan的LB液体培养基中,37 ℃下摇床(200 r/min)培养4~6 h,菌液PCR鉴定呈阳性的单克隆送至深圳华大基因科技有限公司进行测序。
1. 2. 4 生物信息学分析 利用NCBI的ORF Finder对克隆获得序列进行开放阅读框(ORF)预测,采用DNAMAN 6.0对最长ORF进行序列分析,并推导其氨基酸序列。利用ExPASy的ProtParam分析编码蛋白的理化性质;应用SOMPA预测其二级结构、SWISS-MODEL预测其三级结构;使用TargetP 1.1 Server和WoLF-PSORT预测蛋白的亚细胞定位情况。将克隆获得的HcGR基因序列提交至NCBI数据库,将其推导氨基酸序列与其他已报道物种GR氨基酸序列进行BLASTp比对,并下载26个具有代表性物种的GR氨基酸序列,利用MEGA 7.0进行序列比对后以邻接法(Neighbour-jaining,NJ)构建系统发育进化树。
1. 2. 5 实时荧光定量PCR检测 根据实时荧光定量PCR引物设计原则设计HcGR基因的荧光定量引物(表1),选取红麻管家基因Histone3为内参基因。反应体系15.0 μL:2×ChamQ Universal SYBR qPCR Master Mix 7.5 ?L,10 μmol/L上、下游引物各0.3 ?L,1.0 ?L cDNA模板,ddH2O(RNase-free)补充至15.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 10 s,60 ℃ 30 s,进行39个循环;72 ℃延伸7 min。在Bio-Rad CFX96荧光定量PCR仪中进行实时荧光定量PCR检测,标准品和样品均设3次重复,以ddH2O替代cDNA模板作为阴性对照。采用2-ΔΔCt法计算基因相对表达量(Li et al.,2015;冯娇等,2018)。
1. 3 统计分析
试验数据采用SPSS 20.0进行单因素方差分析,利用Duncans新复极差法对平均值进行差异性比较分析,并以Excel 2016制图。
2 结果与分析
2. 1 红麻总RNA和cDNA质量检测结果
如图1-A所示,提取红麻总RNA条带清晰,且A260/A280在1.90左右,A260/A230在2.15左右,纯度较高。由图1-B可看出,扩增产物条带单一,表明反转录产物cDNA已不存在总DNA,可用于后续试验。
2. 2 HcGR基因克隆结果
HcGR基因PCR扩增产物经1.0%琼脂糖凝胶电泳检测,结果(图2)显示,PCR扩增产物长度与预期结果(1698 bp)一致,该特异性条带清晰且无拖尾现象。胶回收该条带进行测序,结果发现其与转录组数据中的HcGR基因序列完全一致。
2. 3 HcGR蛋白理化性质及其结构分析结果
应用DNAMAN 6.0推导HcGR基因ORF编码的氨基酸序列(图3),并用ProtParam分析HcGR蛋白理化性质,结果显示其相对分子量为60 kD,由555个氨基酸残基组成,其中酸性氨基酸残基(Asp+Glu)58个,碱性氨基酸残基(Arg+Lys)62个,蛋白理论等电点(pI)为8.46,不稳定指数为36.22,总平均疏水指数为-0.130,故推测该蛋白为亲水性蛋白。
利用SOPMA预测HcGR蛋白二级结构,结果表明该蛋白含丰富的二级结构,以无规则卷曲为主,α-螺旋、延伸链和β-转角为辅,所占比例分别为44.14%、27.75%、22.16%和5.95%。采用SWISS-MODEL预测HcGR蛋白三级结构,结果如图4所示。HcGR蛋白的主要结构元件是无规则卷曲、α-螺旋和延伸链,由这3种结构元件相互盘绕而成。利用TargetP 1.1 Server和WOLF-PROST对HcGR蛋白进行亚细胞定位预测,结果表明,HcGR蛋白定位于叶绿体。
2. 4 HcGR蛋白同源性比对及进化分析结果
为研究HcGR蛋白在不同生物中的进化关系,将HcGR氨基酸序列与海岛棉、长果黄麻、橡胶树和麻疯树等高等植物的GR氨基酸序列进行BLASTp同源比对分析,结果表明,在不同物种间GR蛋白保守,其氨基酸序列相似性为77.82%~88.04%(图5)。基于构建的系统发育进化树(图6)分析不同物种GR蛋白的进化关系,结果显示HcGR蛋白与榴莲GR蛋白的亲缘关系较近。
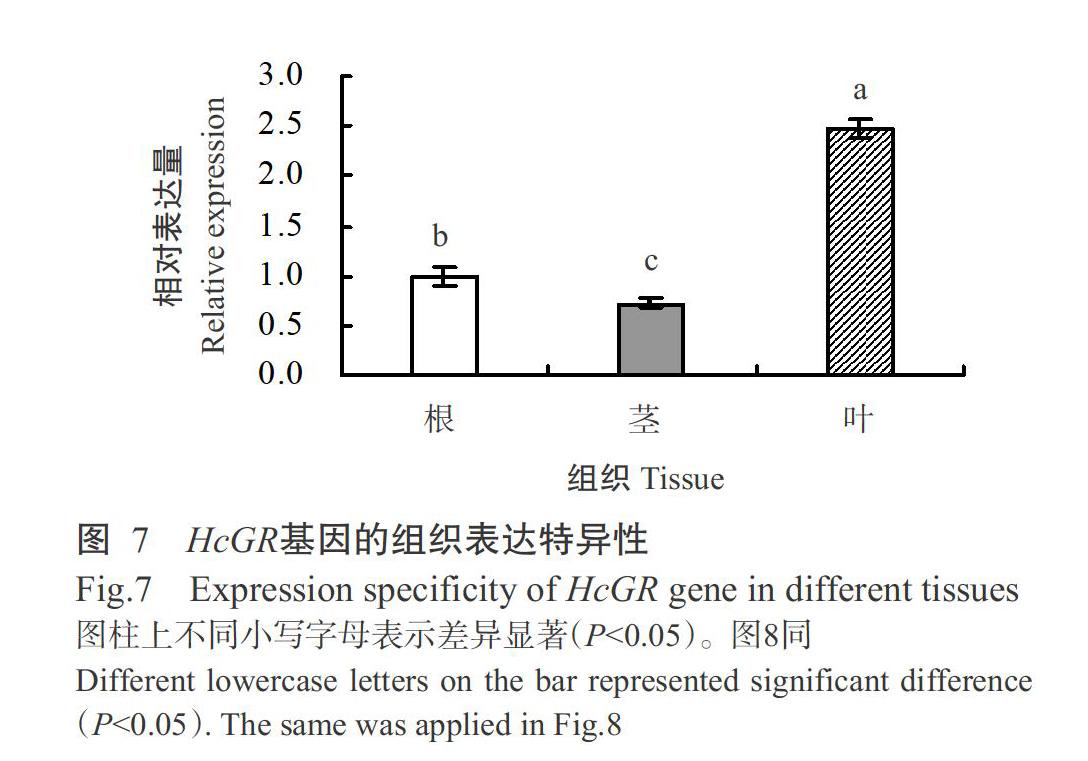
2. 5 HcGR基因组织表达特异性分析结果
以正常生长的幼龄红麻根、茎和叶cDNA为模板,采用实时荧光定量PCR检测HcGR基因在红麻不同组织中的相对表达量,结果(图7)显示,HcGR基因在红麻根、茎和叶中均有表达,且相对表达量存在显著差异(P<0.05,下同),其中,以在叶中的相对表达量最高,其次是根,二者分别是茎中相对表达量的3.40和1.38倍,表明HcGR基因具有明显的组织表达特异性。
2. 6 盐胁迫下HcGR基因表达模式分析结果
以正常生长的红麻植株为对照,采用实时荧光定量PCR检测不同盐胁迫处理下HcGR基因的相对表达量,结果如图8所示。在红麻的根和叶中,HcGR基因的相对表达量随NaCl胁迫浓度增加整体上呈先升高后降低的变化趋势,且均在T1处理下达峰值,显著高于CK、T2和T3处理,但根中HcGR基因的相对表达量在CK、T2和T3处理间无显著差异(P>0.05),叶中HcGR基因的相对表达量在CK、T2和T3处理间也存在显著差异(图8-A和图8-C)。HcGR基因在茎中的相对表达量随NaCl胁迫浓度增加呈波动变化趋势,且T1、T2和T3处理均高于CK,其中T1和T3处理显著高于CK(图8-B)。可见,不同浓度的NaCl均能诱导HcGR基因响应盐胁迫信号并通过上调各组织中的轉录水平以提高抗盐胁迫能力,故推测该基因在红麻抗盐胁迫机制中发挥重要调控作用。
3 讨论
生物和非生物胁迫均会严重影响植物的正常生长发育,导致植物细胞内ROS含量大幅增加(Ramel et al.,2009;岳远征等,2018)。植物体内抗氧化剂含量是影响其抗逆性的重要因素之一,其中,GSH是广泛存在于生物体内的一种重要抗氧化剂,能与许多化合物发生反应,参与细胞内的诸多生理代谢过程,从而对细胞内硫醇的氧化还原状态维持发挥重要作用(朱帆等,2015)。在植物的生长发育和抗逆境胁迫过程中,GR对GSH的再生起关键作用(郭丽红等,2006)。目前,已有部分植物的GR基因被克隆鉴定,并进行转基因功能验证。Chang(1997)将大肠杆菌GR基因导入杂种杨,从而获得具有抗ROS特性的转化体;Rebecca等(2000)将菜豆GR基因导入烟草,结果发现转基因烟草GR活性较非转基因植株提高3~7倍;佘玮(2010)研究表明,转GR基因的苎麻中GR基因过量表达能明显提高植株对氧化胁迫或其他逆境的耐受性。
本研究克隆获得HcGR基因序列,并证实该基因在正常生长的幼龄红麻根、茎和叶中均有表达,且相对表达量存在显著差异,表明HcGR基因具有组织表达特异性,推测其能在不同组织中调控合成中间代谢产物和代谢终产物,但不同组织中的合成量存在差异。朱守晶等(2015)研究显示,苎麻GR基因(BnGR1)在成熟叶中的相对表达量最高,其次分别是幼叶、茎尖和根,在茎中的相对表达量最低。韩瑶(2017)研究发现,在巨尾桉组培苗中以茎中的GR基因相对表达量最高,其次是叶,在根中的相对表达量最低。岳川等(2014)对茶树GR基因(CsGRs)在不同组织中的表达情况进行分析,结果发现,CsGR1基因在花和根中的相对表达量较叶片和茎高;CsGR2基因在叶和茎中的相对表达量较根和花高。可见,GR基因在不同植物不同组织中的表达情况各不相同。
本研究的亚细胞定位结果显示,HcGR蛋白主要分布于叶绿体。叶绿体是植物细胞代谢中重要的细胞器。不同植物中占主导地位的GR基因不同,如镉胁迫处理下,番茄通过上调叶绿体中GR基因表达以响应胁迫信号(Kisa,2017),而白菜通过诱导胞质GR基因转录,促使其GR活性上升,以维持细胞氧化还原平衡(Lou et al.,2017)。此外,GR基因的表达受不同外源物质调控,如茉莉酸和H2O2等可诱导橡树HbGR1基因表达(邓治等,2014)。本研究对盐胁迫下HcGR基因的表达模式进行分析,结果显示,T1(50 mmol/L NaCl)胁迫处理下HcGR基因在红麻根、茎和叶中的相对表达量均较CK(0 mmol/L NaCl)、T2(100 mmol/L NaCl)和T3(200 mmol/L NaCl)处理高,当NaCl胁迫浓度升至200 mmol/L时,在红麻根和叶中HcGR基因表达明显下调,表明HcGR基因在红麻抵抗盐胁迫中可能发挥一定的调控作用,与刘莹(2010)的研究结果相符合。但今后还需进一步研究盐胁迫下内源GSH含量是否发生变化,为施用外源GSH缓解红麻盐胁迫提供理论依据。
4 结论
HcGR基因在红麻根、茎和叶片中的表达具有明显组织特异性,且可被不同浓度的NaCl诱导响应盐胁迫信号,并通过上调各组织中的转录水平以提高抗盐胁迫能力,故推测该基因在红麻抗盐胁迫机制中发挥重要调控作用。
参考文献:
陈涛,王贵美,沈伟伟,李小珍,祁建民,徐建堂,陶爱芬,刘晓倩. 2011. 盐胁迫对红麻幼苗生长及抗氧化酶活性的影响[J]. 植物科学学报,29(4):493-501. [Chen T,Wang G M,Shen W W,Li X Z,Qi J M,Xu J T,Tao A F,Liu X Q. 2011. Effects of salt stress on growth and antioxidant enzyme activity of kenaf seedlings[J]. Plant Science Journal,29(4):493-501.]
邓治,刘辉,王岳坤,李德军. 2014. 橡胶树胞质型谷胱甘肽还原酶基因的克隆与表达分析[J]. 植物生理学报,50(11):1699-1706. [Deng Z,Liu H,Wang Y K,Li D J. 2014. Cloning and expression analysis of cytosolic glutathione reductase gene in rubber tree[J]. Plant Physiology Journal,50(11):1699-1706.]
冯娇,侯旭东,董礼花,陶建敏. 2018. GA3与CPPU对葡萄果锈相关物质合成及基因表达的影响[J]. 江苏农业学报,34(3):642-650. [Feng J,Hou X D,Dong L H,Tao J M. 2018. Effects of GA3 and CPPU on the synthesis of related substances and gene expression of berry russet of grapes[J]. Jiangsu Journal of Agricultural Sciences,34(3):642-650.]
郭丽红,陈善娜,王德斌. 2006. 热激和热胁迫过程中玉米幼苗谷胱甘肽还原酶和同工酶的变化[J]. 云南大学学报(自然科学版),28(3):262-266. [Guo L H,Chen S N,Wang D B. 2006. Changes of glutathione reductase and isozyme in maize seedlings during heat shock and stress[J]. Journal of Yunnan University(Natural Science Edition),28(3):262-266.]
韩瑶. 2017. 巨尾桉谷胱甘肽还原酶的克隆及其在低温胁迫下的表达模式分析[D]. 泉州:华侨大学. [Han Y. 2017. Cloning of glutathione reductase in Eucalyptus grandis×E. ophylla and analysis of expression pattern under low temperature[D]. Quanzhou:Huaqiao University.]
贾瑞星. 2019. 镉胁迫下两个红麻品种形态、生理响应及差异基因发掘[D]. 南宁:广西大学. [Jia R X. 2019. Compara-tive morphological and physiological responses and di-fferential gene discovery in kenaf(Hibiscus cannabinus L.) under cadmium stress[D]. Nanning:Guangxi University.]
康太,武宏豆,逯佰艳,龙晓刚,龚春梅,白娟. 2016. 柠条锦鸡儿抗坏血酸过氧化物酶基因(CkAPX)和谷胱甘肽还原酶基因(CkGR)cDNA片段的克隆及表达分析[J]. 西北林学院学报,31(3):91-97. [Kang T,Wu H D,Lu B Y,Long X G,Gong C M,Bai J. 2016. Cloning and expre-ssion analysis of ascorbate peroxidase(CkAPX) and glutathione reductase(CkGR) partial sequence from Caragana korshinskii[J]. Journal of Northwest Forestry University,31(3):91-97.]
李慧,阚家亮,王影. 2019. 豆梨中谷胱甘肽还原酶基因的分离、表达特点及酶活性分析[J]. 果蔬学报,36(1):11-20. [Li H,Kan J L,Wang Y. 2019. Isolation,expression chara-cteristics and activity analysis of glutathione reductase gene in pear[J]. Journal of Fruits and Vegetables,36(1):11-20.]
劉莹. 2010. 南极衣藻谷胱甘肽还原酶基因的克隆、表达与定量分析[D]. 湛江:广东海洋大学. [Liu Y. 2010. Cloning and expression analysis of glutathione reductase gene in Chlamydomonas sp. ICE-L from Antarctica[D]. Zhanjiang:Guangdong Ocean University.]
佘玮. 2010. 苎麻对重金属吸收和积累特征及镉胁迫响应基因表达研究[D]. 长沙:湖南农业大学. [She W. 2010. The uptake and accumulation characteristics of heavy metals and expression of Cd stress response genes in ramie[Boehmeria nivea(L.) Gaud.][D]. Changsha:Hunan Agricultural University.]
宋贵方,樊伟丽,王俊娟,王德龙,王帅,周凯,叶武威. 2012. 陆地棉干旱胁迫响应基因GhGR的克隆及特征分析[J].中国农业科学,45(8):1644-1652. [Song G F,Fan W L,Wang J J,Wang D L,Wang S,Zhou K,Ye W W. 2012. Cloning and characterization of drought-stress responsive gene GhGR in cotton(Gossypium hirsutum L.)[J]. Scientia Agricultura Sinica,45(8):1644-1652.]
王康君,樊继伟,陈凤,李强,孙中伟,郭明明,张广旭,郑国良. 2018. 植物对盐胁迫的响应及耐盐调控的研究进展[J]. 江西农业学报,30(12):31-40. [Wang K J,Fan J W,Chen F,Li Q,Sun Z W,Guo M M,Zhang G X,Zheng G L. 2018. Research advances in response of plants to salt stress and regulation of salinity tolerance[J]. Acta Agriculturae Jiangxi,30(12):31-40.]
岳川,曹红利,周艳华,王璐,郝心愿,王新超,杨亚军. 2014. 茶树谷胱甘肽还原酶基因CsGRs的克隆与表达分析[J].中国农业科学,47(16):3277-3289. [Yue C,Cao H L,Zhou Y H,Wang L,Hao X Y,Wang X C,Yang Y J. 2014. Cloning and Expression analysis of glutathione reductase genes(CsGRs) in tea plant(Camellia sinensis)[J]. Scientia Agricultura Sinica,47(16):3277-3289.]
岳遠征,李娅,罗雪琪,杨秀莲,施婷婷,王良桂. 2018. 盐胁迫对海州常山幼苗生长及生理特性的影响[J]. 河南农业大学学报,52(1):38-42. [Yue Y Z,Li Y,Luo X Q,Yang X L,Shi T T,Wang L G. 2018. Effects of soil NaCl stress on seedling growth and physiological characteristics of Clerodendrum trichotomum[J]. Journal of Henan Agricultural University,52(1):38-42.]
张腾国,聂亭亭,孙万仓,史中飞,王娟. 2018. 逆境胁迫对油菜谷胱甘肽还原酶基因表达及其酶活性的影响[J]. 应用生态学报,29(1):213-222. [Zhang T G,Nie T T,Sun W C,Shi Z F,Wang J. 2018. Effects of diverse stresses on gene expression and enzyme activity of glutathione reductase in Brassica campestris[J]. Chinese Journal of App-lied Ecology,29(1):213-222.]
赵可夫,范海. 2005. 盐生植物及其对盐渍生境的适应生理[M]. 北京:科学出版社. [Zhao K F,Fan H. 2005. The physiology of halophytes and their adaptation to saline habitats[M]. Beijing:Science Press.]
朱帆,丁燏,鲁义善,简纪常,吴灶和. 2015. 哈氏弧菌谷胱甘肽还原酶基因克隆及原核表达[J]. 生物技术通报,31(6):183-188. [Zhu F,Ding Y,Lu Y S,Jian J C,Wu Z H. 2015. Cloning and prokaryotic expression of glutathione reductase gene in vibrio harborii[J]. Biotechnology Bulletin,31(6):183-188.]
朱守晶,余伟林,石朝燕,揭雨成. 2015. 苎麻谷胱甘肽还原酶基因(BnGR1)的克隆和表达分析[J]. 农业生物技术学报,23(10):1318-1326. [Zhu S J,Yu W L,Shi Z Y,Jie Y C. 2015. Cloning and expression analysis of glutathione reductase gene(BnGR1) in ramie[J]. Journal of Agricultural Biotechnology,23(10):1318-1326.]
Chang X D. 1997. Current status and prospect of forest gene-tic manipulation[J]. Study on World Forest,4:80-112.
Garnik E Y,Belkov V I,Tarasenko V I,Korzun M A,Konstantinov Y M. 2016. Glutathione reductase gene expression depends on chloroplast signals in Arabidopsis thaliana[J]. Biochemistry(Moscow),81(4):364-372.
Gill S S,Anjum N A,Hasanuzzaman M,Gill R,Trivedi D K,Ahmad I,Pereira E,Tuteja N. 2013. Glutathione and glutathione reductase:A boon in disguise for plant abiotic stress defense operations[J]. Plant Physiology and Biochemistry,70(1):204-212.
Iahikawa T,Takahara K,Hirabayashi T,Fujisawa S,Terauchi R,Uchimiya H,Kawai-Yamada M. 2010. Metabolome analysis of response to oxidative stress in rice suspension cells overexpressing cell death suppressor Bax inhibitor-1[J]. Plant and Cell Physiology,51(1):9-20.
Kisa D. 2017. Expressions of glutathione-related genes and activities of their corresponding enzymes in leaves of tomato exposed to heavy metal[J]. Russian Journal of Plant Physiology,64(6):876-882.
Li H,Han J L,Lin J,Yang Q S,Chang Y H. 2015. A γ-glutamyl-cysteine synthetase gene from Pyrus calleryana is respon sive toions and osmotic stresses[J]. Plant Molecular Biology Reporter,33(4):1088-1097.
Lou L L,Kang J Q,Pang H X,Li Q Y,Du X P,Wu W,Chen J X,Lv J Y . 2017. Sulfur protects pakchoi(Brassica chinensis L) seedlings against cadmium stress by regulating ascorbate-glutathione[J]. Metabolism International Journal of Molecular Sciences,18(8):1628.
Noctor G,Mhamdi A,Chaouch S,Han Y,Neukermans J,Marquez-Garcia B,Queval G,Foyer C H. 2012. Glutathione in plants:An integrated overview[J]. Plant Cell and Environment,35(2):454-484.
Ramel F,Sulmon C,Bogard M. 2009. Differential patterns of reactive oxygen species and antioxidative mechanisms during atrazine injury and sucrose induced tolerance in Arabidopsis thaliana plantlets[J]. BMC Plant Biology,9:28.
Rebecca G S,Gary P C,Philip M M. 2000. Characterisation of pea cytosolic glutathione reductase expressed in transgenic tobacco[J]. Planta,211:537-545.
Wu T M,Lin W R,Kao Y T,Hsu Y T,Yeh C H,Hong CY,Kao C H. 2013. Identification and characterization of a novel chloroplast mitochondria co-localized glutathione reductase involved in salt stress response in rice[J]. Plant Molecular Biology,83(5):379-390.
(責任编辑 陈 燕)
