提高产反式-4-羟脯氨酸工程菌产量的发酵策略
2020-01-19王晓姣杨慧敏张震宇孙付保
王晓姣, 杨慧敏, 张震宇, 孙付保, 周 豪
(江南大学 生物工程学院,江苏 无锡214122)
反式-4-羟脯氨酸 (trans-4-hydroxyproline,P4H)简称羟脯氨酸,分子式为C5H9NO3,可以与茚三酮反应生成黄色溶液[1]。 它易溶于水,微溶于乙醇溶液,呈现出独特的甜味。 同时,P4H 是构成胶原蛋白的一种特征性氨基酸,很少存在于普通的蛋白质中。P4H 可用于食品、美容、医疗、化工等多个领域[2-4],P4H 的生产得到众多研究者的关注。
羟脯氨酸是L-脯氨酸通过脯氨酸羟化酶羟化得到的。 研究者通过脯氨酸羟化酶,使得微生物法生产羟脯氨酸成为了一种可能[5]。 但在该生产过程中,L-脯氨酸作为合成羟脯氨酸的底物, 需要外源添加,这使得羟脯氨酸的工业化生产成本增大。 同时,由于发酵液终会残留L-脯氨酸,增加了羟脯氨酸的分离纯化难度。 为了解决这些问题,研究者通过代谢途径改造、菌株重组等方式实现了无外源添加L-脯氨酸生产羟脯氨酸[6-7]。研究前期成功构建了一株重组大肠杆菌E.coliJM109ΔargB/pUC19-BH,该菌株含有表达谷氨酸激酶的突变基因proB2A,突变后的基因解除了L-脯氨酸的反馈抑制作用;同时,该菌株敲出了精氨酸代谢途径中的关键酶(N-乙酰谷氨酸激酶)基因argB,使得精氨酸合成途径受阻,是一株精氨酸缺陷型菌株,见图1。 摇瓶水平下,该菌株在无外源添加L-脯氨酸的情况下,羟脯氨酸的积累量约为920 mg/L。

图1 大肠杆菌中羟脯氨酸生物合成途径Fig. 1 Biosynthetic pathways of P4H in E. coli
利用微生物进行生产发酵的过程中,影响微生物生长及代谢产物合成的因素非常多,培养基的组成以及培养条件如培养温度等均需要考虑[8-10]。研究表明,碳源是微生物必需的能源物质,常见的碳源种类很多,如葡萄糖、麦芽糖、甘油等,不同菌株对于碳源的需求不同。 同时,碳源质量浓度过高或过低,均不利于菌体的生长。 因此,选择合适的碳源以及恰当的碳源质量浓度是利用微生物进行生产的前提。 微生物发酵过程中另一种必不可少的物质是氮源。 氮源质量浓度过高,菌体生长旺盛;氮源质量浓度过低,菌体生长较慢,这均不利于代谢产物的积累与产出。 培养基中的金属离子对于菌株的生长也是极其重要的。脯氨酸羟化酶属于α-酮戊二酸家族,该家族的酶在作用过程中需要亚铁离子的参与[5],亚铁离子的浓度会影响该酶的羟化作用。 接种体积分数、 培养基的pH 以及培养温度等对于菌株的生长以及目的蛋白质的表达均是至关重要的。
重组大肠杆菌的生长状况直接关系到代谢产物生产情况,且工业化生产多采用高密度发酵的方法,溶氧是高密度发酵过程中的一个关键因素。 研究[11]表明,通过引入透明颤菌血红蛋白VHB 基因,可以显著改善重组菌体的生长状况和增强外源蛋白质的表达。 透明颤菌血红蛋白以氧合态参与到有关氧的代谢,在细胞质中,透明颤菌血红蛋白可以把氧传递给呼吸链, 提高代谢中氧化磷酸化的效率,进而改善低溶氧下的代谢途径,促进蛋白质的表达[12]。 Khosravi 等[13]将透明颤菌血红蛋白VHB 基因引入到表达α-淀粉酶的重组大肠杆菌中,与未引入VHB 基因的菌株相比,α-淀粉酶提高了2.3 倍。因此,可以把VHB 基因引入重组大肠杆菌中,以改善重组菌株的生长状况。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒本实验用到的菌株及质粒见表1。 其中E. coliJM109 作为宿主,质粒pUC19 作为基因表达载体。

表1 实验所用菌株和质粒Table 1 Strains and plasmids used in this work
1.1.2 试剂及仪器主要仪器包括PCR 循环仪、立式高压蒸汽灭菌锅、电泳仪、凝胶成像仪、数显鼓风干燥箱、恒温摇床、分光光度计、电转仪、冷冻离心机、发酵罐等,主要试剂见表2。

表2 主要试剂Table 2 Main Reagents
1.1.3 培养基及培养条件LB 培养基:10 g/L 胰蛋白胨,5 g/L 酵母提取物,10 g/L 氯化钠,pH 7.0~7.2。固体培养基另加2.0 g/dL 的琼脂粉。
发酵培养基:10 g/L 葡萄糖,15 g/L 胰蛋白胨,3 g/L 磷酸氢二钾,2 g/L 氯化钠,1 g/L 硫酸镁,0.015 g/L 氯化钙,3 mmol/L 硫酸亚铁。 初始pH 8.0,培养温度30 ℃,转速220 r/min。 氨苄青霉素50 μg/mL。
1.1.4 引物设计本实验所用引物序列见表3,由上海生工合成。
1.2 重组大肠杆菌的单因素及正交优化
1.2.1 发酵培养基组分的单因素优化优化过程中除了优化的因素,培养基中其他成分与初始培养基保持一致不变。 每组做三个平行,结果取平均值。

表3 本实验所用引物Table 3 Primers used in this work
1)碳源种类及质量浓度的优化:分别选择葡萄糖、麦芽糖、蔗糖、淀粉作为碳源,质量浓度为5、10、15、20、25 g/L。
2)氮源种类及质量浓度的优化:分别选择胰蛋白胨、酵母提取物、蛋白胨、大豆蛋白胨、玉米浆作为氮源,质量浓度为5、10、15、20、25 g/L。
3) 离子浓度的优化:Fe2+的优化浓度分别为0、2、4、6、8 mmol/L,K+的优化质量浓度分别为0、1.5、3、4.5、6 g/L,Na+的优化质量浓度分别为0、1、2、3、4 g/L,Mg2+的优化质量浓度分别为0、0.5、1、1.5、2 g/L,Ca2+的优化质量浓度分别为0、0.05、0.01、0.015、0.02 g/L。
1.2.2 发酵培养基组分的正交优化根据单因素的优化结果,选择7 个因素作为正交试验的考察因素,每个因素设3 个水平,使用L18(37)正交表进行实验设计。
每组做三个平行,发酵结果取平均值。 未选中的因素,以其单因素优化后的结果作为固定值保持不变。
1.2.3 发酵培养条件的优化发酵培养基初始pH的优化: 发酵培养基的初始pH 分别调至5.5、6.5、7.5、8.5、9.5,进行发酵优化筛选;培养温度的优化:培养温度分别选择26、28、30、35、37 ℃, 进行发酵优化筛选;接种体积分数的优化:接种体积分数分别为2%、4%、6%、8%和10%,进行发酵优化筛选。
1.3 含透明颤菌血红蛋白基因的重组大肠杆菌的构建
1.3.1 大肠杆菌化转感受态制备方法大肠杆菌化转感受态的制备方法参照文献[14]。
1.3.2 大肠杆菌感受态细胞的转化方法重组大肠杆菌感受态细胞的转化方法采用热击法[15]。
1.3.3 含VHB 基因的重组质粒的构建为了便于基因操作,以透明颤菌血红蛋白基因为模板,利用引物P1、P2 在基因VHB 前后插入酶切位点BamH I 和PstI,进行PCR 扩增。 将扩增得到的VHB 基因连接到重组质粒pUC19-BH (pUC19-proB2Aptrp2-hyp)上,构建重组质粒pUC19-proB2A-ptrp2-hyp-VHB(pUC19-BHV),构建过程见图2。

图2 重组质粒pUC19-BHV 的构建过程Fig. 2 Construction of recombinant plasmid pUC19-BHV
1.3.4 重组菌株的扩大培养本研究重组菌株的扩大培养条件为:采用优化后的培养基,选择4 L 的装液量, 控制发酵过程的pH 为6.5, 设定转速为400 r/min,设定通气量为2 vvm,接种体积分数及发酵温度均以优化结果为准。发酵12 h 后开始补充碳源,补碳方式为匀速补料,速度为24 g/h,碳源依据优化结果而定[14-15]。
1.4 分析方法
1.4.1 生物量的测定取适量的发酵液, 用去离子水稀释相应倍数,并以去离子水为空白对照,使用分光光度计测定600 nm 波长处的吸光度值(OD600)。
1.4.2 L-脯氨酸的含量测定L-脯氨酸的检测采用酸性茚三酮显色法[14]:取适量发酵液进行离心,取1 mL 上清液或上清稀释液于10 mL 试管中; 向每管样品中加入1 mL 冰醋酸,混匀;再加入1 mL 酸性茚三酮试剂,摇匀,沸水浴1 h;取出试管,加入2 mL 冰醋酸;使用分光光度计测定515 nm 波长处的吸光度值(OD515)。
1.4.3 反式-4-羟脯氨酸积累量的测定反式-4-羟脯氨酸的检测采用氯胺T 法[16]:将发酵液离心后,取2.5 mL 上清液或上清稀释液于10 mL 试管中;向每管样品中加入1 mL 氯胺T,摇匀,室温静置20 min;再加入1 mL 显色剂,摇匀;置于60 ℃水浴锅中,20 min 后取出冰水冷却; 使用分光光度计测定560 nm 波长处的吸光度值(OD560)。
1.4.4 脯氨酸羟化酶酶活的测定反式-4-羟化酶全细胞酶活测定方法参照文献[14]。1 个单位酶活被定义为1 min 将1 nmol L-脯氨酸完全转化为羟脯氨酸的酶量,单位为U,全细胞酶活指的是每毫克干菌体的酶活,单位为U/mg。
2 结果与分析
2.1 发酵培养基组分的单因素优化结果
2.1.1 碳源种类及浓度的优化结果发酵培养基中的碳源是菌种生命活动所需能量的来源,且可以作为菌体构成及其代谢产物的物质基础。 根据材料与方法1.2.1, 对碳源的种类及质量浓度进行优化,结果见图3。
从图3 可以看出, 当择麦芽糖作为碳源时,麦芽糖质量浓度为15 g/L 时,羟脯氨酸的产量达到最大值1 019.427 mg/L,高于其他质量浓度的碳源。 当麦芽糖质量浓度低于15 g/L 时,与同质量浓度的葡萄糖相比,羟脯氨酸的产量偏低;但当麦芽糖质量浓度高于15 g/L 时, 羟脯氨酸的产量明显提高,且逐步趋于稳定。
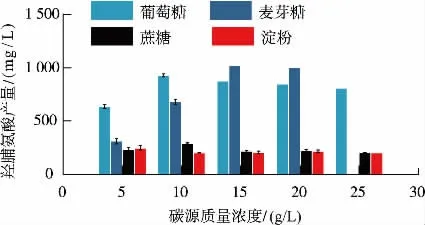
图3 碳源的优化结果Fig. 3 Optimization of different carbon source
研究表明, 培养基中使用甘油作为碳源时,发酵过程中产生的乙酸的量明显低于以葡萄糖为碳源的培养基[17]。根据1.2.1 对麦芽糖及甘油的比例进行优化,结果见图4。

图4 麦芽糖及甘油的比例的优化结果Fig. 4 Optimization of different ratio of carbon sources
从图4 可以看出,当麦芽糖质量浓度与甘油质量浓度比例为2∶1, 即碳源为10 g/L 麦芽糖、5 g/L甘油时,羟脯氨酸的产量达到1 156.177 mg/L,高于仅以麦芽糖为碳源的培养基。 这说明适量添加甘油作为碳源有利于提高羟脯氨酸的积累量。
2.1.2 氮源种类及浓度的优化结果发酵培养基中的氮源主要被用于构成菌体的细胞物质以及代谢产物。 根据1.2.1 对氮源的种类及质量浓度进行优化,结果见图5。
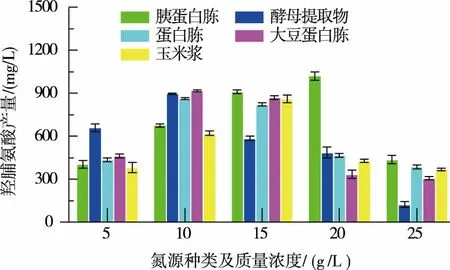
图5 氮源的优化结果Fig. 5 Optimization of different nitrogen sources
从图5 可以看出, 当使用胰蛋白胨作为氮源时,羟脯氨酸的积累量明显高于其他几种氮源。 这是由于胰蛋白胨与其他氮源相比, 成分较为复杂。本研究中的生产菌株为精氨酸缺陷型菌株,胰蛋白胨中含有精氨酸等多种氨基酸,更有益于缺陷型菌株的生长。 当胰蛋白胨的质量浓度达到20 g/L 时,羟脯氨酸的产量达到最大值1 009.633 g/L。 但是,当继续增大胰蛋白胨的质量浓度时,羟脯氨酸的产量却有所下降。 可能是因为高质量浓度的胰蛋白胨中存在较多的色氨酸,这会阻碍色氨酸串联启动子的启动,从而抑制羟化酶基因的表达,进而进一步影响羟脯氨酸的产量。
2.1.3 Fe2+浓度的优化结果在脯氨酸羟基化的过程中,只有与亚铁离子结合,该酶的活性中心才能发挥其羟基化作用。 Fe2+在配制过程中容易被氧化,添加一定比例的VC 可能有助于Fe2+发挥作用。 根据1.2.1 对Fe2+的浓度进行优化,结果见图6。
从图6 可以看出,随着浓度的增加,无论是只添加Fe2+还是添加Fe2+:VC 的培养基, 羟脯氨酸产量均呈现增长的趋势, 这说明Fe2+对羟化酶发挥其羟化活性起到了一定作用。 添加Fe2+:VC 的培养基与未添加VC 的培养基相比, 羟脯氨酸产量总是偏高。 VC 有较强的抗氧化作用,VC 的添加可以有效抑制Fe2+的氧化,增强Fe2+的作用。 当Fe2+:VC 浓度为6 mmol/L 时, 羟脯氨酸的产量达到最大值1 154.603 mg/L。
2.1.4 其他离子的优化结果微量离子的调价对于菌株的生长及产物的代谢至关重要。如K+可以促进L-脯氨酸的摄入量;Na+可用于促进L-脯氨酸代谢过程中proP 蛋白的表达, 利于羟脯氨酸的生产;Mg2+及Ca2+可以有效地促进菌株的生长, 从而影响产物的合成。 根据1.2.1 分别对K+、Na+、Mg2+及Ca2+的质量浓度进行优化,结果见图7。
从图7 可以看出,K+、Na+、Mg2+及Ca2+的最优质量浓度分别为3.0、3.0、1.5、0.005 g/L 时, 羟脯氨酸的产量达到最大值,且优化过程中发现生物量与羟脯氨酸产量呈现一定的正相关关系。

图6 Fe2+的优化结果Fig. 6 Optimization of Fe2+


图7 K+、Na+、Mg2+及Ca2+的优化结果Fig. 7 Optimization of K+,Na+,Mg2+and Ca2+
2.2 发酵培养基组分的正交优化结果
根据单因素的优化结果,选择麦芽糖、甘油、胰蛋 白 胨、K2HPO4、亚 铁 离 子(Fe2+∶VC=1∶1)、镁 离 子(Mg2+)、钠离子(Na+)这七个因素进行正交试验。 采用L18(37)正交表试验,正交因素的水平见表4,正交试验结果见表5。
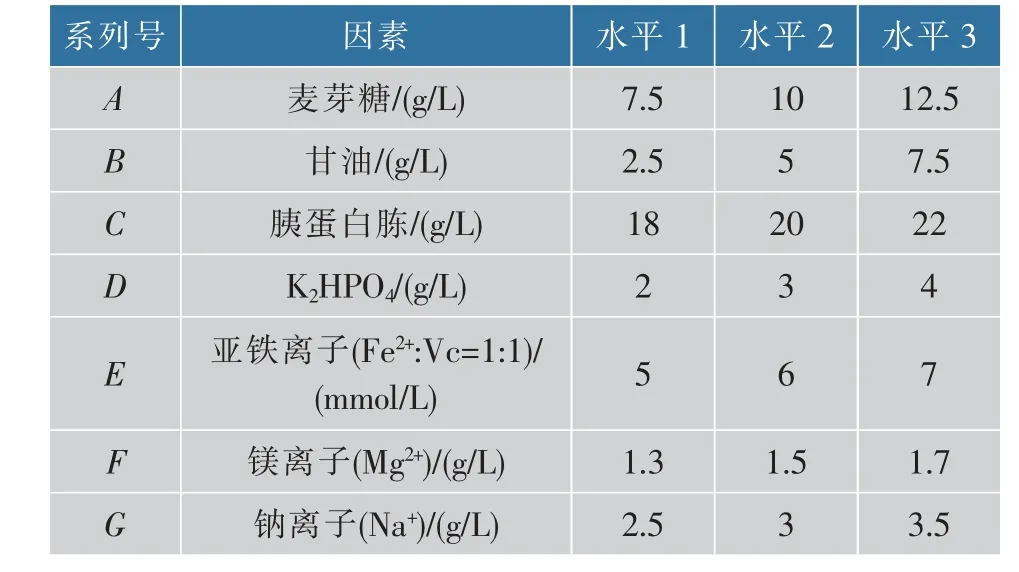
表4 发酵培养基成分正交优化试验因素水平表Table 4 Orthogonal factors of medium optimization
根据正交试验结果,发酵培养基中各组分对羟脯氨酸产量的影响主次顺序为Na+>胰蛋白胨>麦芽糖>K+>Mg2+>亚铁离子>甘油;各因素的最优组合为:G2C3A2D3F3E1B2。正交试验过程中,Ca2+的质量浓度保持0.005 g/L。 因此,优化后的发酵培养基的组成为:10 g/L 麦 芽 糖、5 g/L 甘 油、22 g/L 胰 蛋 白 胨、4 g/L K2HPO4、5 mmol/L 亚铁离子 (Fe2+∶VC=1∶1)、1.7 g/L镁离子(Mg2+)、3 g/L 钠离子(Na+)、0.005 g/L 钙离子(Ca2+), 进行发酵验证, 羟脯氨酸产量为1 435.002 mg/L,与优化前相比提高了35.978%。
2.3 发酵培养条件的优化结果
根据1.2.3 依次对培养基初始pH、培养温度以及接种体积分数进行优化,每优化一个因素,均以优化后的结果为基础进行下一个因素的优化,结果见图8。
初始pH 在5.5~8.5 时, 菌体的浓度OD600值以及羟脯氨酸积累量均随着pH 的增大逐渐升高。 当pH 高于8.5 时,OD600及羟脯氨酸的积累量开始下降;培养温度在30 ℃以下时,随温度升高羟脯氨酸产量逐步提高, 并且30 ℃时羟脯氨酸产量达到最大值。 但是,当温度高于30 ℃时,羟脯氨酸产量急剧下降。 可能由于较高较低温度均不利于脯氨酸羟化酶的表达;当接种体积分数为4%时,羟脯氨酸产量高于其它接种体积分数的发酵结果。 然而,当接种体积分数大于4%时, 虽然OD600的值得到提高,但是羟脯氨酸产量却有所下降。 这可能是由于大量的菌体使得培养基中的营养物质更多地用于菌体的生长,而产物的代谢受到抑制。
最终当培养基的初始pH 为8.5, 培养温度为30 ℃,接种体积分数为4%时,羟脯氨酸的积累量达到1 602.787 mg/L, 与优化前的918.714 mg/L 相比提高了42.68%。
2.4 含VHB 基因的重组质粒的构建
2.4.1 透明颤菌血红蛋白VHB 基因的引入根据1.3.2 构建重组质粒pUC19-BHV。将重组质粒转入大肠杆菌感受态细胞中,挑取生长良好的单菌落进行培养,提取重组质粒,进行单双酶切验证,凝胶电泳的验证结果见图9。
泳道1 和泳道2 分别为质粒pUC19-BH 及pUC19-BHV 使用BamH I 进行单酶切的结果,获得单一条带;泳道3(a)和3(b)分别为质粒pUC19-BHV 和pUC19-BH 使用EcoR I 与PstI 进行双酶切的结果, 显示有差别的条带分别是片段ptrp2-hyp-VHB(1 644 bp)和ptrp2-hyp(1 069 bp),在1 700 bp 和1 000 bp 处看到这两条条带,这些条带的大小均与预期目标片段的大小相符。 单酶切和双酶切验证正确的重组质粒,经DNA 测序正确,表明重组质粒pUC19-BHV 构建成功。

表5 正交优化试验结果Table 5 Result of orthogonal test
2.4.2 重组大肠杆菌JM109ΔargB/pUC19-BHV 的初步发酵将构建好的质粒pUC19-BHV 转入缺陷型 菌 株E.coliJM109ΔargB, 获 得 重 组 菌 株JM109ΔargB/pUC19 -BHV。 以 菌 株JM109ΔargB/pUC19-BH 为对照组, 在优化后的发酵条件下进行初步发酵,发酵结果见表6。
从表6 可以看出,无论是OD600、羟脯氨酸产量还是全细胞酶活, 含有基因VHB 的重组菌株JM109ΔargB/pUC19-BHV 均有提高。 虽然不是很明显,这可能是由于摇瓶发酵过程的缺氧情况并不明显,透明颤菌血红蛋白基因在缺氧的情况下才开始作用。 同时, 也可能由于培养基是针对菌株JM109ΔargB/pUC19 -BH 进 行 优 化 的, 菌 株JM109ΔargB/pUC19-BHV 并不能表现出生长优势。
2.4.3 重组大肠杆菌JM109ΔargB/pUC19-BH 及JM109ΔargB/pUC19-BHV 的扩大培养为了进一步说明基因VHB 的作用, 参照1.3.2 对菌株JM109ΔargB/pUC19 -BH 及 JM109ΔargB/pUC19 -BHV 进行扩大培养,探究7 L 罐中两株重组菌的生长及代谢情况,结果见图10。


图8 初始pH、培养温度以及接种体积分数的优化Fig. 8 Optimization of different pH,different temperature and different inoculation

图9 重组质粒pUC19-BHV 的酶切验证Fig. 9 Digestion verification of recombinant plasmid pUC19-BHV

表6 重组大肠杆菌株羟脯氨酸的产量Table 6 Production of P4H of recombinant E. coli
由图10 可知, 与不含VHB 基因的菌株相比,含有VHB 基因的重组菌株菌体生长更为旺盛,且羟脯氨酸产量也相对较高。 发酵0~12 h 的过程中,两株重组菌的菌体生长速度几乎相同,且羟脯氨酸的积累量非常相近。发酵12~24 h 的过程中,菌体生长速度略有下降,可能是此时发酵培养基中原有的碳源已被耗尽,而用于补料的碳源还不能满足菌体生长及代谢的需求, 此时含有VHB 基因的重组菌株的羟脯氨酸积累量略高。 发酵24 h 后,两株重组菌开始表现出差异, 含有VHB 基因的重组菌株的羟脯氨酸合成速率明显高于另一株重组菌。 发酵44 h 后, 含有VHB 基因的重组菌株进一步展现出它在生长方面的优势。 高密度发酵的过程中,随发酵时间的延长,溶氧开始降低,基因VHB 在低溶氧下显示出优势。 发酵60 h, 重组菌株JM109ΔargB/pUC19-BH 的羟脯氨酸积累量达到15.894 g/L,而菌株JM109ΔargB/pUC19-BHV 在发酵56 h 时羟脯氨酸产量达到18.312 g/L,相比提高了13.2%。

图10 JM109ΔargB/pUC19-BH 与JM109ΔargB/pUC19-BHV 的发酵曲线Fig. 10 Fermentation process curve of recombinant E.coli JM109ΔargB/pUC19 -BH and E. coli JM109ΔargB/pUC19-BHV
3 结 语
在无外源添加L-脯氨酸的条件下,作者通过单因素优化及正交优化,获得了最优的发酵培养基组成及发酵培养条件。 当发酵培养基组分为10 g/L 麦芽糖、5 g/L 甘油、22 g/L 胰蛋白胨、5 mmol/L 亚铁离子(Fe2+∶Vc=1∶1)、4 g/L K2HPO4、3 g/L 钠离子(Na+)、1.7 g/L 镁离子(Mg2+)、0.005 g/L 钙离子(Ca2+),初始pH 为8.5,培养温度为30 ℃,接种体积分数为4%,转速为220 r/min 时, 发酵24 h, 重组大肠杆菌JM109ΔargB/pUC19-BH 反式-4-羟脯氨酸的积累量达到1 602.787 mg/L, 与优化前相比提高了约42.68%。 结果表明,合适的培养基组成以及培养条件更有利于菌株的生长及代谢产物的生成,对于工业化生产来说非常有必要。
在进行发酵培养基成分以及发酵条件优化的过程中, 我们发现重组菌的羟脯氨酸产量与菌浓OD600的值呈现正相关的关系,因此,可以通过增加菌浓OD600的值进一步实现羟脯氨酸产量的提高。透明颤菌血红蛋白可以以氧合态参与到与氧有关的代谢,在细胞质中,该蛋白质可以把氧传递给呼吸链,提高氧化磷酸化的效率,改善低溶氧下的代谢活动,促进蛋白质的表达。 本研究将透明颤菌血红蛋白VHB 基因连接到重组质粒上进行表达,在7 L罐扩大培养时, 含有VHB 基因的重组菌株JM109ΔargB/pUC19 -BHV 羟 脯 氨 酸 产 量 约 为18.312 g/L, 与不含基因VHB 的菌株相比提高了13.2%。 结果表明,基因VHB 的引入可以改善菌体的生长状况和增强外源蛋白质的表达。
本研究构建的重组菌株可以实现无外源L-脯氨酸添加生产反式-4-羟脯氨酸, 且会在菌株高密度发酵过程中表现出优势。 利用该菌株进行羟脯氨酸的生产,羟脯氨酸的得率较高,且后期分离纯化更为简单,这使得微生物法生产羟脯氨酸展现出更多的优势。
