α-PGM 过表达对灵芝多糖发酵的影响
2020-01-19李瑞勤沈梦烨丁重阳顾正华石贵阳
李瑞勤, 王 琼, 沈梦烨, 丁重阳*, 顾正华, 张 梁, 石贵阳
(1. 江南大学 生物工程学院,江苏 无锡214122;2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122)
灵芝(Ganoderma lucidum)是我国一种传统的中药材,其含有多种多样的活性成分,包括糖类( 多糖和低聚糖) 、三萜类、蛋白质类、多肽类、生物碱、微量元素等[1]。 灵芝多糖作为灵芝主要的生物活性成分之一,其显著的药理作用一直备受关注,如抗氧化、抗癌、抗炎和免疫调节活性[2-4]。 由于灵芝多糖的广泛药理作用,其生产技术已成为当前研究的热点。 液体深层发酵技术生产灵芝多糖具有生产周期短、多糖组分和含量相对稳定、主要组分和野生灵芝的基本一致等特点,成为获取灵芝多糖的最有效方法[5]。 然而,传统的发酵优化手段如培养条件的改变、诱导剂的添加等,已很难提高灵芝多糖的产量。随着灵芝基因组序列的公布,利用分子生物手段对灵芝多糖合成途径中的相关基因进行改造,已经成为当前提高多糖产量的有效方法[6-7]。 有研究报道,通过操纵生物合成基因的表达水平可提高胞外多糖产量[8]。
灵芝多糖的生物合成途径涉及核苷酸糖前体的生物合成、重复单糖单元的装配和聚合过程[9]。 在多糖生物合成途径中,磷酸葡萄糖变位酶(PGM)是核苷酸糖前体的生物合成途径中的关键酶。 该酶催化葡萄糖-6-磷酸与葡萄糖-1-磷酸的相互转化,葡萄糖-6-磷酸进入分解代谢过程以产生能量, 而葡萄糖-1-磷酸是糖核苷酸的前体, 其被细胞用于合成各种多糖。 Tang 等人发现灵芝中PGM 的活性与胞外多糖(EPS)的产量呈线性关系[10],然而pgm基因的过表达对多糖生物合成的调节机理仍有待阐明。 作者研究pgm基因的过表达对灵芝胞外多糖产量及胞内多糖质量分数的影响;通过考察多糖合成过程中相关酶基因转录水平的表达量和酶的活性,分析引起多糖产量变化的原因,以期进一步研究多糖生物合成调节机理并构建更有效的灵芝多糖高产菌株,为以后对灵芝多糖合成途径中的其他关键酶的研究提供参考依据。
1 材料与方法
1.1 菌种与试剂
灵芝 (Ganoderma lucidum) 菌株、 大肠杆菌(Escherichia Coli)DH5α 和 农 杆 菌(Agrobacterium tumefaciens)EHA105: 由江南大学粮食发酵与工艺国家工程实验室保藏;质粒pCAMBIA1301:购自北京天恩泽基因科技有限公司。
主要试剂:YNB(无氨基酵母)、MES(2-(N-吗啡啉)乙磺酸)、AS(乙酰丁香酮,用DMSO 溶解)、Primer STAR 高保真酶 (TaKaRa)、SYBR® Premix Ex TaqTM试剂盒 (TaKaRa)、ClonExpressMultiS One Step Cloning Kit(Vazyme Biotech)等。
1.2 培养基
灵芝种子及发酵培养基(1 L):葡萄糖20 g,胰蛋白胨5 g,YNB (无氨基酵母)5 g,KH2PO44.5 g,MgSO4·7H2O 2 g;pH 6.0。
MM 培养基(1 L): 葡萄糖10 mmol/L,KH2PO4和K2HPO4各10 mmol/L,NaCl 2.5 mmol/L,CaCl2·2H2O 0.7 mmol/L,FeSO4·7H2O 9 μmol/L,MgSO4·7H2O 2 mmol/L,NH4SO44 mmol/L。
AIM 培养基(1L):在MM 培养基的基础上添加丙三醇(甘油)5 g,MES(2-(N-吗啡啉)乙磺酸)40 mmol/L,甘露醇0.6 mmol/L,用时添加200 μmol/L 的AS(乙酰丁香酮,用DMSO 溶解)。
1.3 方法
1.3.1 液体发酵培养将于4 ℃保存的PDA 斜面上的灵芝种子于30 ℃恒温箱中活化30 min, 从中挑取4 块0.3 cm×0.3 cm 大小的活化菌种, 加入装有80 mL 种子培养基的250 mL 三角瓶中, 捣碎,150 r/min、30 ℃培养10 d, 将种子液转入含有搅拌转子和玻璃珠的三角瓶中,磁力搅拌20 min。 按菌体湿质量0.5 g 接种量接种到装有150 mL 发酵培养基的500 mL 三角瓶中,150 r/min、30 ℃培养,用于制备灵芝原生质体及灵芝原生质体再生的培养基为CYM 培养基[11]。
1.3.2 质粒 PJW -PGM 的构建以质粒pCAMBIA1301 为骨架,对其酶切位点XhoⅠ、PmlⅠ进行双酶切。 以所提灵芝总DNA(CTAB 法)为模板,PCR 扩 增 各 目 的 基 因, 包 括Pgpd、pgm与MsdhB。其中Pgpd为强启动子,MsdhB 由sdhB 基因定点突变获得,可编码有萎锈灵抗性(cbxr)的蛋白质[12],因此将其作为筛选标记。表1 为各基因片段引物。 将重组质粒转化大肠杆菌DH5α 感受态细胞,筛选正确转化子,大量提取质粒PJW-PGM。
1.3.3 农杆菌介导(ATMT)的DNA 转化灵芝原生质体将构建好的待转化的重组质粒PJW-PGM 转化到农杆菌EHA105 后, 进行灵芝原生质体DNA片段的转化。 灵芝原生质体的制备参考文献[13]的方法进行,按照Yu 等人[14]的方法将重组质粒PJWPGM 转到灵芝原生质体, 将转化子转移到含有2 μg/mL 萎锈灵的新鲜CYM 培养基, 以获得稳定的转化体。
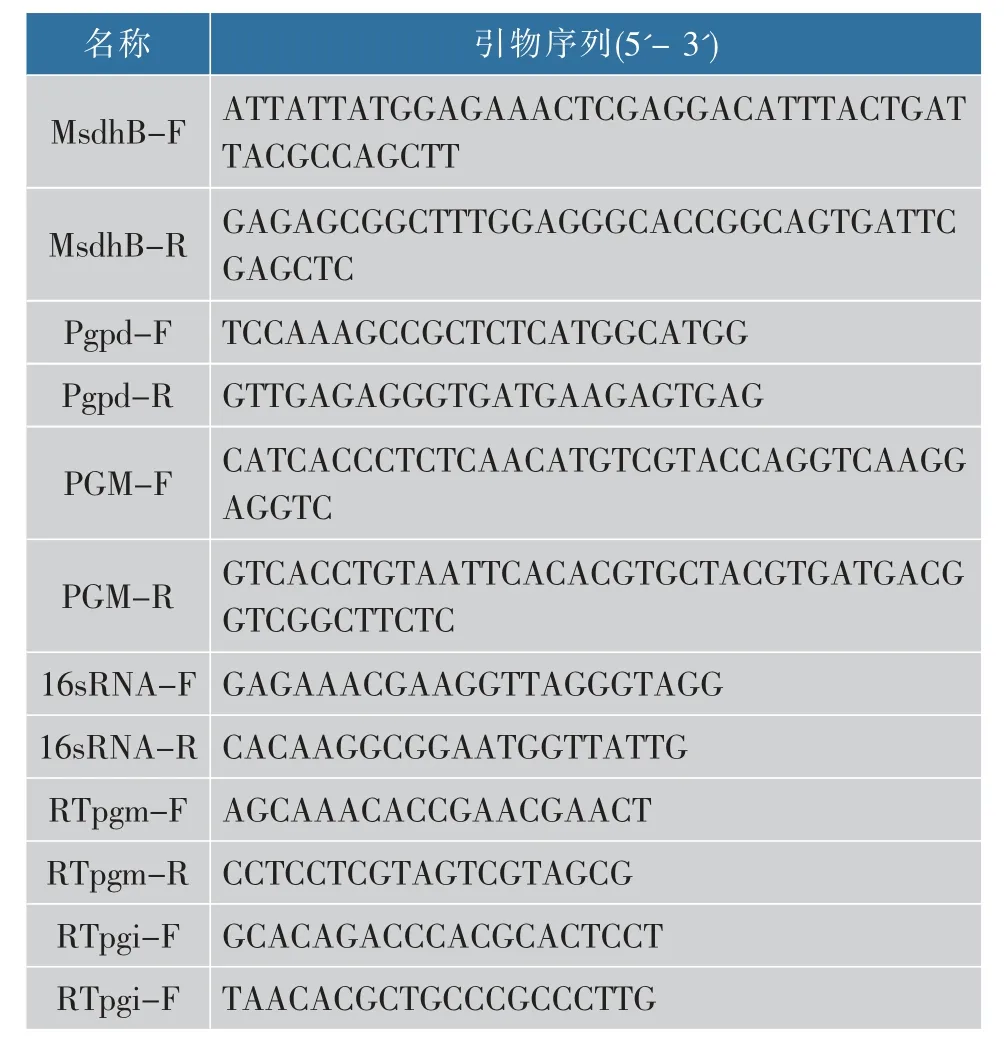
表1 各目的基因正反引物Table 1 Forward/Revere primer of target genes
1.3.4 生物量、 还原糖消耗、EPS 产量、IPS 质量分数的分析取发酵液中菌丝体10 000 r/min 离心10 min,收集菌丝体用蒸馏水洗涤三次,50 ℃干燥至恒质量,干重法测量灵芝生物量。 取发酵上清液,适当稀释后,用DNS 法测定还原糖含量。 取发酵上清液加入4 倍体积95%的乙醇,醇沉过夜,10 000 r/min 离心10 min,弃上清液,自然晾干,沉淀用蒸馏水溶解。 每个样品取三个平行,苯酚硫酸法测定发酵液中的胞外多糖(EPS)产量。 将干燥的菌丝体于1 mol/L NaOH 溶液中沸水浴2 h,10 000 r/min 离心10 min,取上清液,苯酚硫酸法测定灵芝胞内多糖(IPS)的质量分数。
1.3.5 实时测量pgm、pgi 的表达 (qRT-PCR)利用Trizol(TaKaRa,,Japan)提取灵芝总RNA,根据表1 中的引物, 利用SYBR® Premix Ex TaqTM试剂盒(TaKaRa)进行qRT-PCR。 由于16S 小核糖体RNA(rns)在灵芝的代谢过程中可稳定表达,故选为内参基因[15]。在灵芝重组菌株的发酵过程中连续提取不同发酵时间的总RNA,进行qRT-PCR,将野生型的基因表达量作为对照。 每个样品的每个基因做3 个重复,利用2-ΔΔCt法对基因的相对表达量进行分析。
1.3.6 PGM、UGPG、PGI 和PMI 比 酶 活 的 测 定UGPG(UDP-葡萄糖焦磷酸化酶)、PGI(磷酸葡萄糖异构酶)分别是磷酸葡萄糖变位酶在糖核苷酸合成和糖酵解途径的下游关键酶,PMI(磷酸甘露糖异构酶)催化果糖6-P 与甘露糖-6-P 的相互转换,使葡萄糖流入甘露糖走向的分支。 通过对其比酶活的测定,研究pgm基因的过表达对这其自身及相关酶的影响,测定方法按照文献[16]进行。
2 结果与分析
2.1 灵芝转化子的筛选
将三个基因片段Pgpd、MsdhB、pgm 以同源重组方式依次连接质粒pCAMBIA1301, 标记为PJWPGM,见图1。 转化大肠杆菌感受态,挑选转化子菌落PCR 鉴定,琼脂糖凝胶电泳检测,各片段均有清晰条带,见图2。选取转化子摇瓶培养,提取质粒。将上述重组质粒转化至根癌农杆菌EHA105 感受态细胞,经菌落PCR 鉴定,将其转入根癌农杆菌,对灵芝原生质体进行转化, 并涂布含有抗生素萎锈灵(cbx)的CYM 平板,挑取有cbx 抗性的灵芝菌落,结果见图3。

图1 重组质粒结构图Fig. 1 Structure of the vector PJW-PGM

图2 各基因片段PCR 扩增产物Fig. 2 PCR amplification products of each gene fragment
图3 重组灵芝菌株原生质体的再生Fig. 3 Regeneration of transformed G.lucidum protoplasts
2.2 α-PGM 的过表达对灵芝生物量、 还原糖消耗、EPS 产量和IPS 质量分数的影响
目前关于灵芝多糖产量的研究,大多集中于发酵条件的变化对其产量的影响,例如在添加不同碳源的培养条件下,灵芝多糖的产量不同。 从分子水平对其合成途径相关酶的基因进行改造的报道很少。 图4 为以野生型灵芝为对照,重组型菌株PJWPGM 液态发酵过程中菌体生物量与还原糖消耗的变化规律。 结果显示,灵芝重组菌株的菌体生物量与野生型相比有小幅度的提高,且其还原糖消耗呈对应趋势,即重组型菌株对还原糖的利用和消耗速率比野生型菌株更快。 在菌体生长方面,重组菌株PJW-PGM 的生物量达到最高值8.1 g/L, 相比野生型的最高值7.1 g/L 高出14%。 在还原糖消耗方面,灵芝重组菌株相比野生型而言其利用速率更快,表现为还原糖的质量浓度下降速度更快,说明pgm的过表达可促进灵芝对碳源的吸收利用,这与菌株生物量的积累相一致。
在WT 和α-PGM 过表达菌株中测定IPS 质量分数和EPS 产量。 PJW-PGM 灵芝菌株中的IPS 质量分数和EPS 产量都明显高于野生型,见图5。结果显示, 重组型菌株PJW-PGM 的EPS 和IPS 在整个发酵过程中的产量都高于野生型灵芝。 EPS 产量从第3 天开始迅速增加, 与其生物量的积累趋势一致,在第5 天达到最高值0.71 g/L,比WT 的EPS 最高产量0.51 g/L 高出39%。 IPS 质量分数方面,野生型菌株最高达到19.35 mg/hg 菌体, 重组型菌株PJW-PGM 则达到21.01 mg/hg 菌体,相较于野生型菌株增加了9.1%。此结果表明pgm的过表达对EPS产量和IPS 质量分数的提高具有一致性。

图4 发酵过程中WT 与PJW-PGM 灵芝生物量的积累及还原糖的消耗Fig. 4 Kinetic profiles of cell growth and residual sugarin the WT strain and the PJW-PGM strain of G. lucidum
2.3 α-PGM 的过表达对多糖合成途径中相关酶基因表达量的影响
近年来,有一些关于使用RT-PCR 技术研究灵芝三萜类物质合成途径中关键酶基因表达量的报道[17],Xu 团队[18]也有一些关于灵芝多糖合成途径中关键酶基因表达量的报道,这些研究成果有效促进了灵芝及其他大型担子菌的分子遗传研究。 实时荧光定量PCR 是研究基因差异表达的一种快速、敏感、 可靠的技术。 用2-ΔΔCt方法对重组灵芝菌株PJW-PGM 与野生型菌株的α-pgm、pgi基因的表达差异进行分析, 研究α-PGM 的过表达对基因转录水平的影响。 图6(a)为内参基因16rns的溶解曲线。 由图可知,内参基因16rns峰型较好,峰值单一,特异性高。 图6(b)为重组菌株PJW-PGM 不同发酵阶段目的基因的mRNA 表达量,把野生型菌株基因的表达量作为参考,设为1,重组菌株pgm、pmi基因的相对表达量以增加倍数表示。

图5 发酵过程中野生型与PJW-PGM 灵芝的EPS 产量和IPS 质量分数Fig. 5 Kinetic profiles of EPSproduction and IPS contentin the WT strain and the PJW-PGM train of G. Lucidum
结果显示,发酵过程中PJW-PGM 菌株pgm基因的表达量最高为野生型的8.2 倍, 且呈现出先升高后降低的趋势, 推断其与菌体的生长状态相应。由图6 可知,pgm的过表达在整个发酵期间引起mRNA 的明显积累,这与灵芝多糖的积累水平相一致,表明生物合成基因转录水平的增加可以增强灵芝菌株中的多糖生产。 PGI 作为糖酵解途径的关键酶, 需要其大量表达使葡萄糖更多流向糖酵解途径,为菌体生长提供能量。 在发酵过程的前期,即第2~4 天,两种基因转录水平表达量并无较大差异,而发酵中期灵芝菌体处于多糖合成的旺盛期,这一阶段pgm基因的表达量远高于pgi,至发酵后期,由于灵芝菌体的二次生长,pgi基因的转录水平则高于pgm。 此结果表明,pgm基因的过表达不仅使其自身的转录水平高于野生型, 还可刺激其代谢途径中pgi基因表达量的增加, 这一结果与重组型菌株PJW-PGM 生物量较野生型有所提高的结果一致。

图6 PGM 的过表达对pgm、pgi 基因转录水平表达量的影响Fig. 6 Transcriptional levels of pgm、pgi gene in the pgm overexpressed strain
2.4 α-PGM 的过表达对多糖合成途径中相关酶比酶活的影响
多糖的合成需要激活的核苷酸糖供体,葡萄糖是糖合成代谢的中心单糖,在一系列酶的催化作用下,葡萄糖可转化合成多种核苷酸,再通过糖苷键的连接、空间聚合等过程合成多糖,并分泌到胞外[19]。 α-PGM 催化6-磷酸葡萄糖转化为1-磷酸葡萄糖,UDP-葡萄糖焦磷酸化酶(UGPG)催化PGM 的催化产物1-P-葡萄糖转化为UDP-葡萄糖,而UDP-葡萄糖是参与多糖合成的重要核苷酸糖供体。PGI 催化6-磷酸葡萄糖与6-磷酸果糖的相互转换;PMI 负责果糖-6-P 与甘露糖-6-P 的相互转换,使葡萄糖流入甘露糖走向的分支。从分子水平对pgm、pgi的基因表达量进行了分析, 发现其表达水平上调,因此有必要通过对相关酶比酶活的分析,从翻译水平研究pgm基因的过表达对灵芝多糖生物合成的影响。
由表2 可知,pgm过表达灵芝菌株的PGM 比酶活在发酵前期与野生型无明显差异,第5 天其比酶活达到最高并高于野生型菌株11%,之后一直高于野生型。 UGPG 在多糖生物合成途径中直接作用于PGM 的催化产物1-磷酸-葡萄糖,催化糖核苷酸供体的合成,重组菌株中UGPG 的比酶活明显高于野生型菌株。 发酵过程中重组菌株PJW-PGM 中PGI的比酶活一直高于野生型,其在多糖合成途径中的下游酶PMI 的比酶活较野生型也有一定程度提高。这说明发酵过程中α-PGM 的过表达不仅使其自身的比酶活高于野生型,还可刺激多糖生物合成途径中其他相关酶比酶活的增加, 这一结果与之前的qRT-PCR 结果相一致。 有研究发现,灵芝多糖合成途径中相关酶比酶活的提高与其基因转录水平的表达量呈正相关[20],此结论与本实验的结果相一致。此结果表明pgm基因的过表达可影响灵芝多糖合成途径中相关酶基因转录水平的表达量和相关酶的活性,从而提高多糖产量。
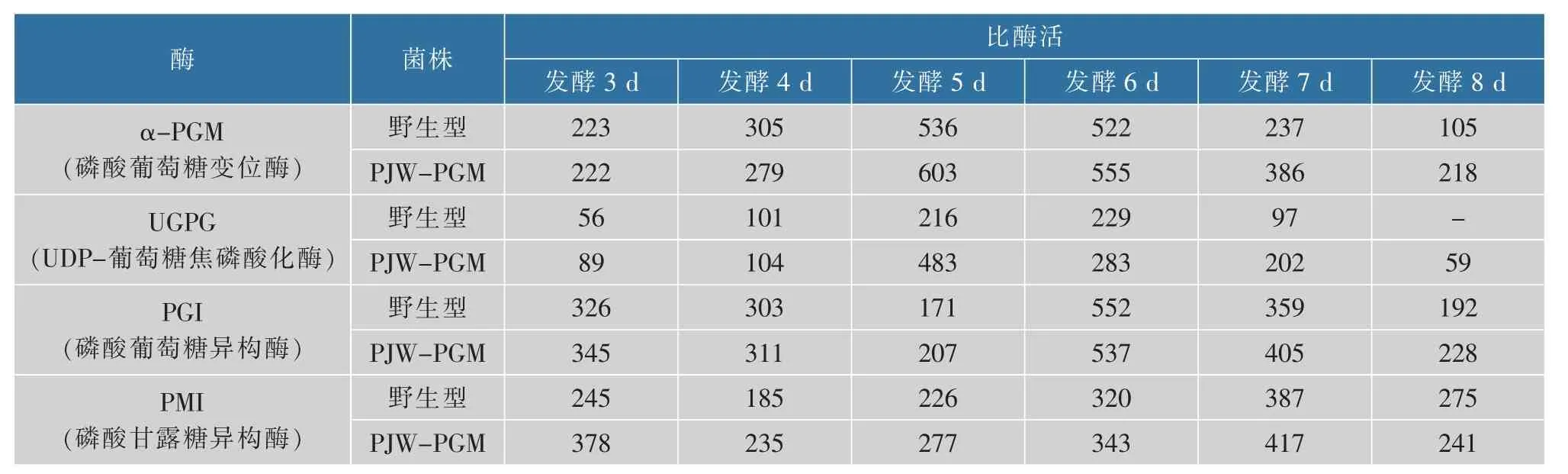
表2 α-PGM 的过表达对合成途径中相关酶比酶活的影响Table 2 Effect of the pgmoverexpressed strain of G. Lucidumon related enzymes activities
3 结 语
近年来,灵芝多糖的研究已得到了国内外相关研究者的普遍关注,并展开了大量的药理学、提取分离和结构鉴定等研究工作,但灵芝多糖的生物合成代谢途径却鲜有报道。 在灵芝多糖产量方面,目前的发酵调控主要以传统的发酵优化和外源物质的调控为主。 由于灵芝多糖的生物合成信息较少,很大程度限制了代谢工程或途径工程手段在灵芝多糖发酵调控中的应用。 作者通过重组构建PGM过表达的灵芝菌株, 研究α-PGM 的过表达对灵芝液体发酵的影响,发现其可促进生物合成途径中相关酶转录水平的表达量及比酶活的提高,从而提高灵芝多糖的产量。 这一结论将为今后研究其他关键合成酶基因提供参考依据。
