鼠曲草简单重复序列间扩增反应体系的建立及优化
2020-01-19江圣圭董志颖赵英魁黄豆豆孙连娜福建中医药大学药学院福建福州50上海中医药大学中药学院上海00海军军医大学附属长征医院药学部上海0000海军军医大学药学院上海00
江圣圭,董志颖,李 卿,赵英魁,黄豆豆,孙连娜,(. 福建中医药大学药学院,福建 福州 50;. 上海中医药大学中药学院,上海 00;. 海军军医大学附属长征医院药学部,上海 0000;. 海军军医大学药学院,上海00)
鼠曲草(Gnaphalium affineD.Don)为菊科(Compositae)鼠曲草属(Gnaphalium)的一年生草本,亦称鼠麴草、佛耳草、清明菜、鼠耳草等,是一种药食同源的植物。我国的鼠曲草主要分布在黄河流域以南,它是我国南方民间传统食物“鼠曲粿”的食材来源;同时,也是一味传统中药,最早记载于《名医别录》,具有止咳化痰、祛风平喘的功效。由于其兼具营养和药用价值,对鼠曲草的研究主要集中在化学成分[1-3]、药理作用[4-6]以及营养价值的开发利用等方面。课题组前期研究[7]表明,不同产地鼠曲草的化学成分含量存在差异,因此,拟采用简单重复序列区间(inter-simple sequence repeat,ISSR)分子标记手段探究其内在原因。
DNA分子标记可以从核苷酸序列水平反映物种遗传变异差异,具有方便、可靠、准确等优势。ISSR技术是在简单重复序列(simple sequence repeat, SSR)的基础上发展而来的,ISSR与SSR相比于其他分子标记手段,具有稳定可靠、操作简单等优点[8]。此外,ISSR相较于SSR,具有多态性高、引物通用、无须测序及设计引物等优势[9]。采用分子标记手段探究居群间的差异具有便捷、干扰小等优点。为了从分子水平阐明不同产地鼠曲草之间的差异,本研究首先对鼠曲草ISSR-PCR反应体系进行优化,其次在最适反应体系的基础上筛选引物及相应的退火温度,最后采用不同产地鼠曲草的基因组DNA进行体系验证,为进一步开发利用鼠曲草提供实验依据。
1 材料与仪器
1.1 样品来源
2017年春,从我国不同省市采集鼠曲草植株(表1),样品由课题组孙连娜副教授鉴定为鼠曲草Gnaphalium affineD.Don,摘下叶片,经液氮预冻后保存于-80 ℃冰箱中,备用。

表1 鼠曲草样品信息表
1.2 仪器与试剂
植物基因组DNA提取试剂盒(北京天根生化科技有限公司);DK-8D三孔电热恒温水槽(上海齐欣科学仪器有限公司);5418R低温高速离心机(德国Eppendorf公司);NanoDrop 2000超微量分光光度计(美国Thermo公司);Mastercycler Pro梯度PCR仪(德国Eppendorf公司);JS-350多功能水平电泳槽、JS-Power 600电泳仪、JS-2000全自动凝胶成像分析仪(上海培清科技有限公司);ISSR通用引物(Genewiz公司);PremixTaqDNA聚合酶、6× Loading Buffer、DL15000 DNA Marker、DL2000 DNA Marker(Takara Bio公司);溴化乙锭(ethidium bromide, EB;上海博光生物科技有限公司)。
2 实验方法
2.1 基因组DNA的提取及检测
采用试剂盒法从鼠曲草叶片中提取基因组DNA,用0.8%琼脂糖凝胶电泳检测其质量,经超微量分光光度计测定其浓度及纯度后,置于-20 ℃冰箱内备用。
2.2 鼠曲草ISSR-PCR反应体系的建立
在反应体系中加入预混酶、DNA模板、引物,并用灭菌水补至20 μl。按照PCR程序完成扩增后,以DL2000 DNA Marker为对照,EB为指示剂,采用1.6%琼脂糖凝胶,在“55 V,90 min”电泳条件下对扩增条带进行分离。
2.3 鼠曲草ISSR-PCR反应体系的优化
首先通过单因素法,以来自福建泉州的鼠曲草样品(S7)作为DNA模板,序列为(CA)8G的818作为引物,分别确定DNA模板量及引物浓度的最优值;然后以单因素实验结果为中心,进行全面考察实验,以“位点清晰、稳定性高、多态性好”为标准,最终确定鼠曲草ISSR-PCR最适反应体系。
2.4 引物筛选及退火温度的确定
根据公式Tm值(解链温度)=4 × (G + C) + 2 ×(A + T)计算出各引物的Tm值,并按Tm值将100条引物进行排序并且分类。选用福建宁德(S1)和湖北恩施(S2)的鼠曲草样品作为考察对象,采用最适反应体系,以Tm值为中心,在(Tm- 2)~(Tm+ 4)范围内设置6个温度,同时进行引物筛选及退火温度筛选,确定各引物的Tc值(中心温度),剔除扩增条带数为0或1的引物,完成初筛。
以来自福建宁德的鼠曲草样品(S1)作为模板,选取Tc-2、Tc、Tc+2这3个温度,采用最适反应体系对通过初筛的引物进行考察,以“位点清晰、稳定性高、多态性好”为标准,完成二次筛选并确定最佳退火温度。
2.5 鼠曲草ISSR-PCR反应体系的验证
采用前述实验确定的最适反应体系、引物及退火温度,对8个居群的鼠曲草DNA模板进行ISSR分子标记以验证体系的稳定性。同时,根据电泳结果以“位点清晰、稳定性高、多态性好”为标准对通过二筛的引物再次进行筛选。
3 结果与分析
3.1 基因组DNA的提取及检测
经试剂盒法提取得到的基因组DNA电泳结果(图1)显示:条带完整,无明显弥散;且经微量分光光度计检测其OD260/OD280均在1.7~1.9之间,表明提取的DNA纯净,无核酸、肽类干扰,可用于后续实验。
3.2 鼠曲草ISSR-PCR反应体系的建立
ISSR-PCR反应体系包含dNTPs、Mg2+、TaqDNA聚合酶、引物、DNA模板。相关研究表明,DNA模板、TaqDNA聚合酶、引物的用量是ISSR-PCR反应体系的主要影响因素[10-12]。并且多项关于dNTPs、Mg2+、Taq酶的优化实验结果表明预混酶体系(表2)可以满足实验需求[12-14]。因此,本实验采用PremixTaqDNA聚合酶,不另加dNTPs和Mg2+,这也在一定程度上简化了实验步骤,并减小了实验误差。

表2 预混酶的组成及浓度
结合相关文献[10-14]确定鼠曲草ISSR-PCR初始反应体系为:10 μl PremixTaq酶、0.8 μmol/L引物、30 ng DNA模板、灭菌水加至20 μl;PCR扩增程序为:①94 ℃预变性5 min;②94 ℃变性30 s,退火温度下复性30 s,72 ℃延伸1 min,共循环38次;③72 ℃延伸10 min。
3.3 鼠曲草ISSR-PCR反应体系的优化
3.3.1 单因素法考察引物浓度和DNA模板量
当DNA模板量不变时,不同引物浓度扩增出的条带情况(图2)显示:引物浓度为0.3 μmol/L时,扩增条带清晰稳定;引物浓度为0.4 μmol/L时,可以检测出模糊的扩增条带。此外,引物浓度<0.3 μmol/L或>0.4 μmol/L时,均无扩增条带。
当引物浓度不变时,不同DNA模板量的扩增情况(图3)显示:DNA模板量为10~40 ng时,均可检测出扩增条带,且模板量为10 ng时扩增出2条条带,其余均为1条;DNA模板量>40 ng时,无扩增条带。
3.3.2 全面实验确定ISSR-PCR最适反应体系
围绕单因素实验结果,分别设置4个引物浓度值及4个DNA模板量,进行16组实验(表3)。全面实验结果(图4)显示:当DNA模板量为10 ng时,不同引物浓度下的扩增条带稳定,且重复性好;当DNA模板量为15 ng时,仅6、7两组扩增出条带;当DNA模板量为20 ng时,虽然各组均扩增出条带,但是条带亮度不稳定;当DNA模板量为25 ng时,仅14未扩增出条带。综上,10 ng DNA模板组(1~4)扩增出的条带最为清晰且稳定性最好,0.30 μmol/L引物浓度组在各DNA模板量下均扩增出条带,呈现出的稳定性强于其余浓度,因此确定最适反应体系包含10 ng DNA模板量和0.3 μmol/L引物,且此结果与单因素实验结果一致。
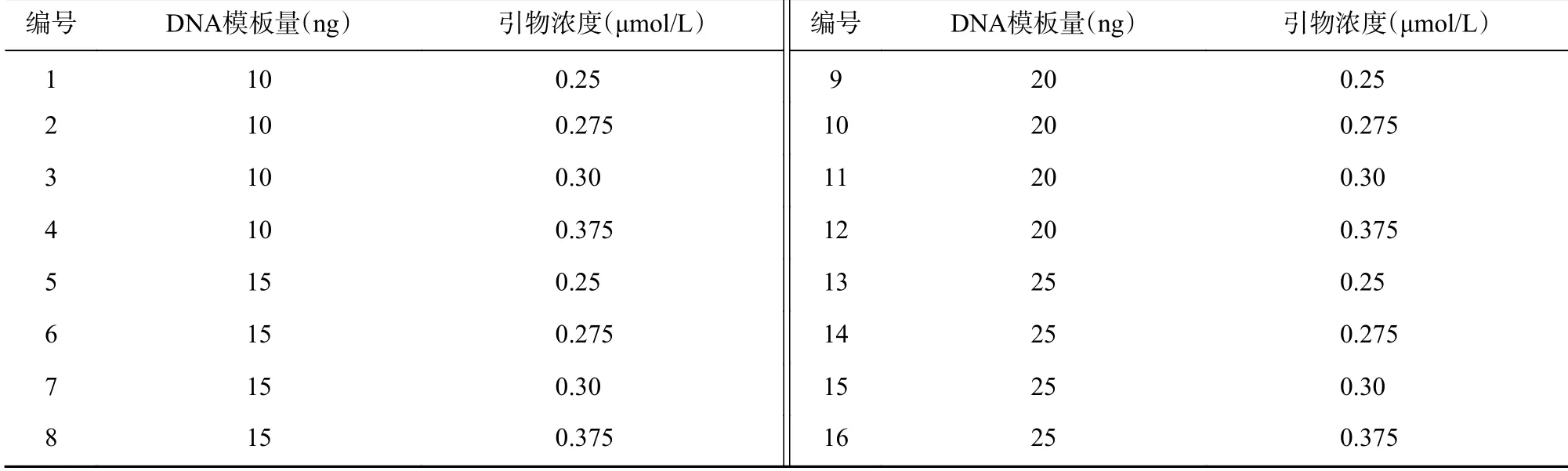
表3 引物和DNA模板的全面实验考察
3.4 引物筛选及退火温度的确定
引物初筛是对比相同引物、不同退火温度下的扩增情况。经初筛剔除58条引物,包含27条Tm值过高(>57 ℃)或Tm值过低(<48 ℃)的引物。此外,通过初筛发现,由于数个退火温度连续值呈现出的扩增情况类似(图5),难以确定最佳退火温度。因此,有必要进行二次筛选。
根据初筛确定中心温度值Tc,即能呈现出最佳扩增状态的温度范围的中间值。设置Tc-2、Tc、Tc+2这3个退火温度,对通过初筛的42条引物进行二次筛选,大部分引物的Tc值和Tm值相同。引物二筛既能横向对比不同引物、相同退火温度下的扩增情况(图6),又能纵向对比相同引物、不同退火温度下的扩增情况,并确定引物的最佳退火温度。
引物经二筛后剔除25条引物,并且确定了余下17条引物的最佳退火温度(表4)。
3.5 鼠曲草ISSR-PCR反应体系的验证
验证结果表明该体系稳定可靠,适合用于进一步遗传多样性分析;此外,最终确定了10条引物,它们分别是810、816、834、846、847、848、857、861、878、891(图7)。
4 讨论
由于分子标记具有稳定性好、操作简单等优点,被广泛用于基因标记、遗传多样性等方面的研究[15]。对于ISSR分子标记技术,反应体系各参数的变化会影响条带的清晰程度甚至有无[16],因此对反应体系进行优化具有必要性。本研究重点对DNA模板量、引物浓度、引物及退火温度进行筛选优化。
体系优化实验结果均仅呈现单一条带,这可能与优化实验选用的DNA模板及引物有关。此外,体系优化实验结果表明引物浓度对条带亮度及清晰度的影响不是按固定规律进行的,还受DNA模板量的影响。当DNA模板量在一定范围内扩增情况相同时,应选择DNA模板量的最小值[13]。在全面实验中,仅模板量为10 ng时,在各引物浓度下扩增稳定,表明在该条件下扩增受引物浓度的影响较小,整个扩增过程稳定性强。推测其原因是较低的DNA模板量能与引物更加充分地结合,随之更加稳定地扩增。

表4 通过二筛引物的序列及最佳退火温度
当进行引物及退火温度筛选时,在保证有效退火的前提下,选择较高的退火温度,以此增加反应的特异性[13]。本研究引入了Tc值,此举不仅对首轮筛选进行查漏补缺,还节约了实验成本,也提高了实验的准确性。此外,通过二次筛选的引物(表3)以CA和GA重复单元为主,这提示我们:鼠曲草基因组DNA中的微卫星序列可能以GT和CT重复单元为主,且菊科植物存在相似重复单元[17]。综上,本实验最终确定了一个稳定性强、重现性好的反应体系,并筛选出了扩增位点清晰、多态性好的适用引物,为鼠曲草后续遗传多样性研究夯实了基础。
