基于SRAP标记的土沉香遗传多样性分析
2020-01-18蒋开彬祝文娟何紫迪朱报著NguyenDuyKien黄少伟
蒋开彬,祝文娟,潘 文,何紫迪,朱报著,Nguyen DuyKien,黄少伟
(1.华南农业大学 a.林学与风景园林学院;b.广东省森林植物种质创新与利用重点实验室,广东 广州 510642;2.广东省林业科学研究院,广东 广州 510520;3.越南社会主义共和国 农业部,河内 100803)
沉香历史悠久,利用价值巨大。根据历史记录,早在公元前300年,我国就有自然胁迫和人诱导沉香形成的记录。沉香在东南亚、中东、印度、中国和日本存在国际贸易,在希腊、罗马、中国、中东和欧洲的文献中记载了沉香的医疗用途,并且沉香在印度教、基督教、佛教和伊斯兰教的重要著作中受到高度尊敬。沉香香气在整个历史上都是流行的,并且在传统熏香和现代香水中仍保持着较高的需 求[1]。沉香作为传统中医的一部分,已有数百年的历史。在东南亚国家、孟加拉国和中国西藏,沉香一直被当作传统药物使用。沉香含有的倍半萜2-2-苯基乙基-4H-色烯-4-酮衍生物(2(-2-phenylethyl)-4H-chromen-4-one derivatives)、粗提物和一些分离的化合物表现出抗过敏、抗炎、抗糖尿病、抗癌、抗氧化、抗缺血、抗微生物、肝保护、泻剂以及对中枢神经系统的影响[2]。
瑞香科Thymelaeceae 沉香属Aquilaria植物有26 个种,分布在15 个国家,中国有3 个种,分别是大叶沉香Aquilaria grandiflora、云南沉香Aquilaria yunnanensis和土沉香Aquilaria sinensis,其中大叶沉香和土沉香能结香,而云南沉香不能结香[3-4]。土沉香是中国特有的物种[5],主要分布于广东、广西、海南、云南、香港及澳门等地[6]。
沉香是热带森林中最有价值的非木材产品之一,主要来源于沉香属植物。沉香属植物作为一种重要的经济树种,过度采伐和栖息地的丧失正威胁着一些能结香的沉香树种群体[7]。由于沉香在社会上的巨大市场需求和低产出的现象让沉香价格不断上升。目前,分布较为集中的土沉香林木已被砍伐殆尽,野生的种群逐渐稀少,现仅有少量的残存植株存在。另外,土沉香的种子有很大的局限性,种子寿命短,非常脆弱,一旦果实裂开,种子暴露后,如果不及时播种,就很难发芽[8],这种特殊的生理特性使其自然繁衍后代非常困难,野生土沉香则越来越稀少。
我国土沉香濒危的主要原因在于长期以来人们对野生大树的掠夺性采伐,导致土沉香母树的不断减少,从而使其种群更新难以顺利地进行,甚至由于非法采伐,我国野生土沉香正面临消失的危险[9]。1999年土沉香被列为国家Ⅱ级濒危保护植物并收载于《中国植物红皮书》。2000年土沉香被世界自然保护联盟(IUCN)列入《世界自然保护联盟受威胁植物红色名录》。2004年土沉香连同产于东南亚等各国用于生产沉香的沉香属植物均被列入《濒危野生动植物物种国际交流公约》(CITES,1973)附录[10]。由于野生的沉香树是极度濒危和脆弱的,因此需要可持续的农业和林业实践来进一步开发和利用。其中,对土沉香种质资源进行研究不仅是可持续开发和利用沉香资源的工作基础,也是了解我国沉香种质资源的重要组成部分,而沉香分子水平的遗传多样性分析是种质资源研究的重要内容。
分子标记是评价植物物种遗传多样性和种群结构的有效方法,是林业研究中应用最广泛的一种遗传标记。使用分子标记来估计物种内部的遗传变异可以帮助育种程序中进行理想的亲本、育种路线和性状的选择[11]。SRAP(Sequence-related amplified polymorphism)是一种基于PCR 的分子标记,用于扩增开放阅读框[12]。SRAP 标记在遗传多样性检测和种群结构分析中比其他方法如AFLP、RAPD、ISSR 和SSR 更好[13-14]。SRAP 工具简单、高效,并且具有很高的生产率。因此,本研究采用SRAP对土沉香的遗传多样性进行分析。
近年来,沉香有许多分子方面的研究报道,如沉香成分D-愈创木酚在大肠杆菌中的表达[15]、利用叶绿体基因组全序列做系统进化研究[16]、利用DNA 条形码识别和鉴定沉香树种[9]、沉香化学成分2-(2-苯乙基)-色酮衍生物治疗炎症的机理[17]和倍半萜衍生物HHX-5 对先天免疫和适应性免疫的抑制作用原理[18]等。但在土沉香分子遗传多样性方面只有少量的报道,如用ISSR 技术分析广西和广东土沉香居群的遗传多样性[19],用ISSR 和AFLP 分子标记分析海南、云南、广东、广西等地沉香属植物的遗传多样性[20]。目前,没有应用SRAP 分析土沉香遗传多样性的报道,也没有较系统地分析我国野生土沉香种质资源的报道。本研究通过应用SRAP 分析我国广西1 个种源、广东6个种源、海南3 个种源、云南1 个种源以及越南2个种源共13 个种源的遗传多样性,为我国土沉香种质资源评价、保护及综合开发利用提供参考。
1 材料与方法
1.1 土沉香材料
在我国广东、海南、广西、云南、福建和越南等地选取树龄10~20 a、生长健壮、树干较通直、间距50 m 以上的单株,嫁接收集在广东省林科院苗圃。本研究收集的沉香材料共148 份,包括来自广东的6 个种源53 份材料、海南的3 个种源30 份材料、广西的1 个种源8 份材料、云南的1 个种源9 份材料和越南的2 个种源48 份材料。
1.2 土沉香DNA 的提取
采用新型植物基因组 DNA 提取试剂盒(北京天根公司)对土沉香的叶片提取DNA。
1.3 SRAP 的扩增
根据SRAP 引物设计并查阅资料[12],筛选出条带清晰、反应稳定的引物组合进行PCR 扩增。25 μL 反应体系包括2.5 μL 的10×PCR Buffer (Mg free),2 μLMg2+(25 mmol/L),1.75 μL dNTPS (2.5 mmol/L),0.2 μL Taq enzyme(5 U·μL-1),0.5 μL F-primer 和R-primer(各20 μmol/L),1μL DNA(40 ng/μL),16.55 μLddH2O。PCR 扩增反应在PTC-200 和BiometraTprofessional PCR 扩增仪上进行。PCR 反应程序为:94 ℃变性5 min 之后进入循环,每个循环94 ℃变性1 min,退火1 min,72 ℃延伸1 min。退火温度从65 ℃开始,每隔2个循环降低1 ℃,直至58 ℃,维持29 个循环,循环结束,72 ℃延伸8 min。
1.4 数据分析
对土沉香群体检测的结果进行分析,统计6%聚丙烯酰胺凝胶电泳扩增产物中清晰明亮、多次重复稳定的条带。在相同迁移位置有条带的记为1,没有条带的记为0。运用POPGEN 32 软件[21]计算土沉香群体遗传多样性,利用Gen Alex 6.4软件[22]对土沉香群体内与群体间不同水平的遗传变异的来源进行AMOVA 分子变异方差分析,利用NTSYS 2.10e 软件[23],采用UPGMA 方法,以Nei’s 无偏遗传距离(1978)对土沉香群体进行聚类分析。
2 结果与分析
2.1 SRAP 的扩增多态性分析
从SRAP 引物组合中共筛选出15 对条带清晰、多态性高的SRAP 引物,采用这15 对SRAP引物对土沉香148 份材料进行SRAP-PCR 扩增,扩增条带大多集中在100~2 000 bp 之间。各引物对扩增的位点数及多态性见表1。由表1 可知,共获得358 个扩增位点,其中多态性位点数有259个,多态性位点率达到73.46%。平均每对引物扩增位点数为23.87,平均每对引物多态性位点数为17.53,其中多态性位点百分率达到100%的引物有两对,分别是Me2 Em12 和Me7 Em23。
2.2 遗传多样性分析
应用POPGEN32 软件对土沉香13 个种源群体的遗传多样性参数进行计算,从表2 中可以看出,土沉香群体的平均等位基因数(Na)为 1.567 4,平均有效等位基因数(Ne)为1.418 3,平均Nei’s 基因多样度指数(H)为0.332 8,平均Shannon 多样性指数(I)为0.337 5。各群体Nei's基因多样度指数(H)的变化范围为0.171 5~0.539 4,Shannon 多样性指数(I)的变化范围为 0.249 1~0.483 7。
土沉香群体水平的平均多态位点(PL)为39,各群体多态位点(PL)的变化范围为29~53。土沉香群体水平的平均多态位点百分比(PPL)为56.74%,各群体多态位点百分比(PPL)的变化范围为42.03%~76.81%。13 个土沉香群体多态位点百分比(PPL)按照由高到低的顺序依次为:越南种源1 >越南种源2 >广东陆河>海南临高、广东深圳、广东东莞>云南种源>广东珠三角、海南屯昌>海南琼山>广东电白、广西陆川>广东萝岗。
2.3 AMOVA 分析
运用GenAlex6.4 软件对土沉香13 个群体内与群体间不同水平的遗传变异来源进行分子方差分析(Analysis of molecular variance,AMOVA),结果见表3。对土沉香群体内和群体间的分子变异组分进行分析,结果显示土沉香群体内和群体间存在显著的遗传变异(P<0.001)。有30%的遗传变异存在于土沉香群体间,而70%的遗传变异存在于土沉香群体内。这表明,土沉香群体的遗传变异表现为:群体内遗传变异>群体间遗传变异。

表1 15 对SRAP 引物在土沉香148 个单株中的多态性检测Table 1 Polymorphism detected by fifteen pairs of SRAP primers in 148 trees of Aquilaria sinensis

续表1Continuation of table 1

表2 13 个土沉香群体遗传多样性指数Table 2 Genetic diversity indices of 13 populations of Aquilaria sinensis

表3 13 个土沉香群体遗传变异的AMOVA 分析Table 3 AMOVA analysis of genetic variation in 13 populations of Aquilaria sinensis
2.4 聚类分析
运用软件NTSYS 2.10e 对群体进行Nei's 无偏遗传距离分析,利用UPGM 方法进行聚类,进而构建13 个土沉香群体的系统聚类图(图1)。从图1中可以看出,广东电白和广东珠三角群体之间遗传距离值最小,最先聚在一起。当阈值为0.17时,13 个土沉香群体可以分为6 类;广东电白、广东珠三角、广东深圳、广东东莞、广东陆河五个种源与越南2 个种源聚为一类;云南省、广东萝岗、广西陆川、海南临高4 个种源分别自成一类;海南屯昌和海南琼山2 个种源聚为一类。
3 结论与讨论
遗传多样性是指一个物种内部的遗传分化程度。它还反映了一个物种适应环境变化的能力及其转化和利用的潜力。因此,对遗传多样性的评价是种质鉴定、采集和育种的重要组成部分[24]。SRAP分子标记已被证明是遗传多样性估计和种群关系分析的有效分析工具[25]。本研究通过SRAP 分子标记,应用POPGEN32 软件计算多态性条带的百分比(PPB)、Nei’s 基因多样性(H)和Shannon’s信息指数(I)等主要遗传多样性参数,分析13 个土沉香种源遗传多样性。PPB 为56.74%,与申彦晶等[26]利用ISSR 分析得到的58.8%相近,表明种群间存在一定程度的遗传变异。土沉香群体的基因多样度(H)、多样性指数(I)和群体多态位点百分比(PPL)均显示各群体多样性维持在中等水平。从其排序来看,来自越南的2 个种源遗传多样性丰富,各个指标均为最高值,而广东萝岗在13 个土沉香群体中遗传多样性水平最低。群体遗传多样性水平与参与实验的种群大小有一定的联系,越南2个种源家系数最多,而萝岗种源家系数最少。在土沉香保护和育种中,遗传多样性指数较高的种群,可加大选择权重,但是对遗传多样性指数较低的种群,也应予以重视[27]。
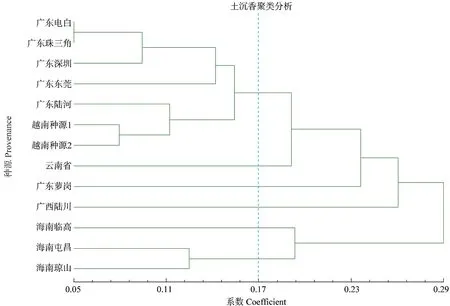
图1 基于SRAP 标记的土沉香种源聚类结果Fig.1 Cluster of Aquilaria sinensis provenances based on SRAP markers
遗传分化系数(Genetic differentiation coefficient,GST)是评价群体间遗传分化最常用的指标之一,可为种群间遗传分化的进化过程提供重要的解释[28]。当0 <GST<0.05 时,表示群体间遗传分化水平较低;当0.05 <GST<0.25 时,群体间有中度的遗传分化;当GST>0.5 时,群体间有高度遗传分化。本研究运用GenAlex6.4 软件对土沉香13 个种源群体内与群体间不同水平的遗传变异来源进行AMOVA 分子变异方差分析,有30%的遗传变异存在于土沉香群体间,即种源群体间的遗传分化系数(GST)为0.30,表明13 个土沉香不同种源群体间存在中度的遗传分化。种源间存在中度的遗传分化,意味不同种源土沉香在资源保护与利用时中应得到重视。
种群遗传结构被定义为一个物种或种群在空间和时间上的遗传变异的非随机分布模式,在很大程度上,它代表一个物种或种群的进化潜力[29]。基于Nei’s 无偏遗传距离,采用UPGM 方法构建13 个土沉香群体的聚类图。当阈值为0.17 时,广东电白、广东珠三角、广东深圳、广东东莞、广东陆河5 种源与越南2 个种源聚为一类,云南省、广东萝岗、广西陆川、海南临高这4 个种源则自成一类,海南屯昌、海南琼山2 个种源聚为一类。这表明,广东电白、珠三角、深圳、东莞、陆河与越南种源亲缘关系比较接近,海南琼山和海南屯昌种源亲缘关系较近。
本研究应用SRAP 分子标记分析土沉香的遗传多样性,结果表明,13 个土沉香种源有中度的遗传多样性和遗传分化。随着野生土沉香被破坏,我国土沉香遗传多样性会越来越低。因此,对我国野生土沉香种质资源进行保护显得非常必要。本研究的结果为土沉香的进一步研究奠定了基础,如种质资源保存、关联分析和分子育种等研究。
