手性农化产品的现状
2020-01-18编译
叶 萱 编译
(上海市农药研究所,上海 200032)
开发药效高、田间用量低、选择性增加、毒性低和环境安全、对使用者友好和经济可行的创新农化产品与开发分子复杂度增加的化合物有关,因为已有优秀产品含有1个或多个不对称中心结构。要实现这些宏伟目标的1个重要策略就是开发具有独特特性的含有手性碳原子分子。许多外消旋化合物中,只有1个对映异构体具有生物活性,或1个对映异构体的活性显著高于另一个。
对列入当前杀虫剂抗性行动委员会(IRAC)、杀菌剂抗性行动委员会(FRAC)和除草剂抗性行动委员会(HRAC)作用机制分类表中的现代农化产品(杀虫剂/杀螨剂/杀线虫剂、杀菌剂和除草剂/安全剂)活性成分(2017年总数为 759个)的调查表明 227个(30%)化合物分子含有不对称中心(图1a)。
商业化手性农化产品中杀虫剂、杀螨剂和杀线虫剂占比最大(40.5%),其次为杀菌剂(34%),再为除草剂和安全剂(25.5%)(图1b)。市场上大多数手性农化产品为外消旋体,其含有的2个对映异构体的量相等。
1 农业化学中的立体化学方法
虽然立体化学被越来越多地用于医药工业中药物的设计,不同的文章和书也已对其市场和研究进行了综述,但主要为过时的综合文章,只有非常少的最近综述对手性农化产品进行过介绍。
1.1 手性农化产品的重要性
在农化产品工业发展的最初阶段,农化产品活性成分主要为无机化合物(1899年铜杀菌剂波尔多混合液)和真溶液(1892年,二硝甲酚即 2-甲基-4,6-二硝基酚)。后来,随着多种类别产品的上市,手性化合物增加,以作用于钠通道(拟除虫菊酯杀虫剂,93%为手性分子)或膜中甾醇生物合成(吡咯和吗啉杀菌剂,77%为手性分子)的产品为例。

图1 HRAC、FRAC和HRAC作用机制分类表中所有商业化农化产品中的手性产品的占比以及手性产品中不同类别的占比
今天,新颖的农化产品具有更复杂的分子结构,有一个或多个立体中心。新手性农化产品的许多先导化合物是在靶标驱动的筛选项目中发现的。此概念已影响了对手性细胞受体或结合蛋白有最佳拟合度的分子的设计。生物化学途径、手性代谢物形成和配体-受体相互作用的知识的不断增加支持着对最佳活性成分的发现。最后,先导化合物也可能在天然产品和动植物中发现,这是设计手性和对映异构体的巨大资源。
1.2 手性农化产品的制备
过去,工业规模选择性制备对映异构体或分离对映异构体一般难度大、效率低、费用高。然而,近年,不对称合成和催化已取得巨大进步,在现代农化产品的制备中已广泛应用立体选择性工艺。今天可用不同方法制备手性农化产品(合成或拆分外消旋物),并以高的分辨率和灵敏度进行分析(图2 )。
图2中方法I~V已用于工业规模高效生产手性农化产品。

图2 制备手性农化产品的不同方法
1.2.1 立体异构体的分离
在手性拆分试剂中以结晶法诱导不对称转换在溴氰菊酯等数个拟除虫菊酯杀虫剂的生产中重要。对手性拆分试剂的主要要求为成本不太高,两种对映异构形式易获得,对映体过量值大。直接结晶在实践中的局限性为在结晶过程中杂质增加。
1.2.2 手性构件的应用
手性池包含相对价低的可购买到的手性天然产品(碳水化合物、帖烯、生物碱、羟基和氨基酸),这些物质以两种对映异构体形式存在且对映体过量百分率高。在最重要的手性构件中,蛋白和非蛋白(S)-氨基酸具有重要的地位,每年可商业得到10~105t。对于精噁唑禾草灵、精吡氟禾草灵和高效氟吡甲禾灵等芳氧苯氧丙酸类(AOPPs),只有(R)-对映异构体具有除草活性。因此,大多数工业策略为使用纯对映异构体(S)-2-氯丙酸(或对外消旋物进行酶拆分和根据IV法进行生物转化)。
1.2.3 催化不对称合成
手性催化转化和增强化学反应中的手性对现代农业化学重要。许多均相手性过度金属催化剂可被用于工业规模生产工艺,如不对称加氢、环氧化反应和双羟化,不对称环丙烷化或异构化(手性烯丙基胺前体到手性烯胺,例如以(R)-BINAP-Rh为催化剂)。重要的例子为在禾本科杂草除草剂(S)-异丙甲草胺(对映体过量百分比约 80%)的制备中把芳亚胺转化为(S)-芳胺前体的均相对映选择性催化加氢工艺(氢,Ir-josiphos催化剂)的开发。这是今天运行的最大催化不对称转化工艺(每年大于1万t)。
1.2.4 酶和微生物转化
许多大规模生物催化工艺已被开发用于生产(S)-氨基酸。在这些工业化应用路线中通过水解氨基酸酯而酶拆分氨基酸的过程重要。许多商业化应用的方法为对外消旋物进行拆分和从手性化合物前体开始的不对称生物催化转化。拆分反应的基本类型为外消旋物的酶拆分和不对称(生物)催化。最近,蛋白系统已被描述用于对映选择性环丙烷化、硅烷化和硼基化(borylation)等化学反应。典型的工业规模酶拆分的例子为酰基转移酶、酰胺酶、乙内酰脲酶和 β-内酰胺水解酶介导生产(S)-缬氨酸、(S)-苯基丙氨酸或(S)-蛋氨酸等(S)-氨基酸。用工程化大肠杆菌的全细胞生物催化很有发展前景,具有大规模和低成本生产的潜力。本文中,外消旋物、乙内酰脲酶和氨甲酰酶即可进行动态生物催化拆分。
1.2.5 天然产物的发酵
一些次级代谢产物农化产品可通过发酵生产。不同16元大环内酯杀虫剂如阿维菌素(阿维菌素B1a和B1b混合物,80∶20)和弥拜菌素B (弥拜菌素A3和 A4混合物,30∶70)可分别通过阿维链霉菌(Streptomyces avermitilis)和吸水链霉菌(Streptomyces hygroscopicus)大规模发酵制取。阿维菌素也是半合成埃维菌素的前体[4′′-表-(甲胺基)-4′′-脱氧埃维菌素B1a],埃维菌素的年生产量大于35 t。大环多杀菌素(是多杀菌素 A 和 D 的混合物)是由刺糖多胞菌(Saccharopolyspora spinosa)等放线菌产生。最近,半合成杀虫剂乙基多杀菌素是对多杀菌素的L-鼠李糖部分进行特异性O-乙基化所得到。
制备手性农化产品的方法I~V的选择取决于手性起始物池或高产率有效发酵产品的适宜菌系的可得性,这最终影响生产成本。
1.3 手性农化产品的监管
具有生物活性的立体异构体混合物的农化产品的风险评估复杂,因为每个立体异构体可能具有不同的理化特性和毒性。与非手性分子相比,外消旋农化产品的开发需要增加相当多的监管内容,因为必须对所有立体异构体进行环境和毒理研究。因为毒性也是酶反应的结果,手性农化产品常对植物、动物或人类呈现对映选择性或立体选择性毒性,如拟除虫菊酯联苯菊酯和苄氯菊酯,或1,2,4-三唑杀菌剂三唑酮。在生物化学转换和毒性中这些选择性概念是手性农化产品的源泉。然而,应用立体选择性合成立体异构体可具有靶标选择性和不希望的毒性。虽然有数种方法来评估手性农化产品的风险,但具体选用哪种方法取决于其区别不同异构体毒性的能力。美国环保局风险评估框架的综述讨论了在对手性农化产品进行风险评估时应该考虑的数个独特问题。
⑴ 清楚地了解手性农化产品在靶标生物体内的立体化学效应(活性和无活性);⑵ 农化产品使用面积的程度是评估农药代谢和吸附中对映选择性的变化性的重要考虑因素;⑶ 建立对映选择性分析方法来解释监测数据和支持手性农化产品的登记,了解对映体互变的可能性;⑷ 手性农化产品的生态毒性测试策略,应该使用能够评估农药活性和无活性异构体毒性的方法;⑸ 对手性农化产品的暴露建模来预测对映特异性环境归属和生态毒性数据。
因此,了解手性农化产品的对映选择性的变化对可靠的风险评估很重要。
1.4 过去10年中手性农化产品
在过去10年(2007-2017年)用作现代作物保护农药的上市新产品(44个商业化产品)中约43%为手性物质(5个除草剂、9个杀菌剂、3个杀虫剂、1个杀螨剂、1个杀线虫剂),其中大多数为对映异构体外消旋混合物(47%),非对映异构体混合物(37%)或纯对映异构体混合物(10.5%)(图3a、b)。
此外,自从2015年以来,已发现手性农化产品(即2个除草剂和3个杀菌剂具有立体中心)的开发强劲增长(图4),其增长趋势将继续。
但是,在近年为什么分子结构很复杂的手性农化产品的数量一直在增加?
本文分析了最近 10年中登陆全球作物保护市场的新一代手性农化产品,详细介绍了一些代表性手性农药,报道了具有立体中心分子对现代农业化学的贡献。也介绍了对映异构体的生物活性和单个立体异构体的合成方法。

图3 已知商业化农化产品(2007-2017)中手性产品的占比情况

图4 在2007-2017年上市的非手性和手性农化产品
2 分 析
不同种类除草剂、杀菌剂、杀虫剂/杀螨剂和杀线虫剂列于表 1。表 1中的每个产品的对映异构体的立体化学组成(纯、纯对映异构体的混合物、对映异构体的外消旋混合物或非对映异构体混合物)和手性中心数量见图3c,为以下分析的基础。
3 手性除草剂
与除草剂抗性行动委员会作用机制分类表中所有商业化手性除草剂的25.5%占比相比,在过去10年此数值稍有增加(+0.5%,为 26%;图 4c)。表 1列出了最新一代手性除草剂的除草剂抗性行动委员会作用机制类别和化学亚类。
在16个上市的除草剂中5个为手性分子,大多数具有一个立体中心(最多为3个),具有已知20多年的作用机制。它们包括作用于乙酰辅酶 A (CoA)羧化酶(ACCase)的代表物质噁唑酰草胺纯的(R)-对映异构体,作用于纤维素生物合成的(1R,2S,3RS)-非对映异构体混合物的茚嗪氟草胺,作用于乙酰羟酸合成酶/乙酰乳酸合成酶和 4-对羟苯基丙酮酸双加氧酶(4-HPPD)的2个非对映异构体的外消旋混合物——玉米除草剂氟吡草酮。在占比为26%的手性除草剂(图3c)中,只有ACCase抑制剂噁唑酰草胺为纯的对映异构体产品,其他所有产品为立体异构体混合物。
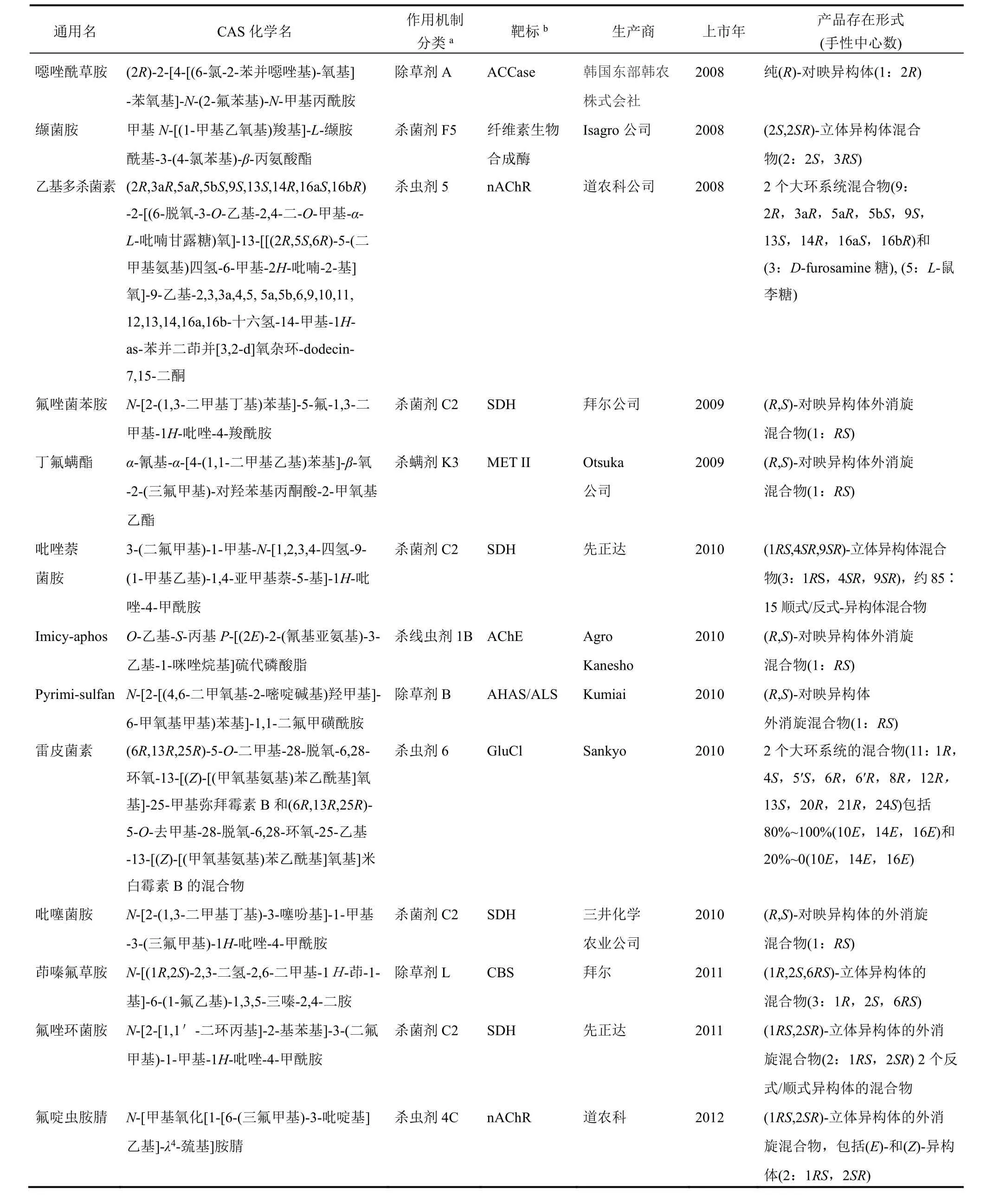
表1 2007-2017年上市的手性农化产品

续表
3.1 乙酰辅酶A羧化酶抑制剂
ACCase催化生物素依赖性酶乙酰辅酶A发生ATP依赖性羧化作用,形成丙二酰辅酶A。这个重要代谢酶对植物体内脂肪酸生物合成具有重要作用,已作为除草剂开发和杂草防除的引人注目的靶标25年多。
不同除草剂和除草剂前体类别例如烯己二酮类(DIMs)、苯基-吡唑啉酮(例如唑啉草酯)或(异质)芳氧苯氧丙酸类(AOPPs)抑制禾本科杂草质体中同质型(homomeric) ACCase的羧基转移酶。自20世纪70年代以来,AOPPs已被很好地介绍过,第一部分成员为外消旋物,例如噁唑禾草灵(fenoxaprop-ethyl)。然而,所有(S)-对映异构体除草活性较弱,由于知识产权问题,一些产品以(R)-对映异构体丰富的活性成分再上市,后来氟吡甲禾灵(haloxyfop-methyl)和禾草灵(diclofop-methyl)以(R)-对映异构体上市。
这些(R)-构型的羧甲基酯除草剂前体在田间被植物叶吸收性增加,在植物活体内形成的羧酸(氟吡甲禾灵和禾草灵)(haloxyfop和 diclofop)为具有除草活性的代谢物。
酵母 ACCase复合体的羧基转移酶与氟吡甲禾灵和禾草灵(haloxyfop和diclofop)(R)-对映异构体结合的晶体结构表明是代谢物结合于转移酶二聚体的表面活性位点。
噁唑酰草胺的(R)-对映异构体为芽后ACCase抑制剂,能有效防除不同一年生敏感杂草,如水稻田中的稗草(Echinochloa crusgalli)。
通过对稗草叶绿体 ACCase的羧基转移酶的活性位点 3D结构建模、分子对接和分子动态模拟研究发现噁唑酰草胺的抑制作用机制好像不同于其他ACCase抑制剂。令人惊讶的是,噁唑酰草胺不需要通过形成羧酸代谢物来激活。推断噁唑酰草胺可能模拟生物素的作用使苯并噁唑环中的氮质子化,形成“噁唑酰草胺-H”,“噁唑酰草胺-H”中的氢结合于羧基转移酶的活性位点而与不同区域相互作用。用1H-NMR已研究了在离体酸性条件下噁唑酰草胺的质子化。
用液相色谱质谱仪(LC-MS)已检测到噁唑酰草胺在稗草体内的主要代谢物N-(2-氟苯基)-2-羟基-N-甲基丙酰胺。这表明分子中N-甲基丙酰胺部分与甲基酯相比具有水解稳定性。
3.2 纤维素生物合成抑制剂
腈类(氯硫酰草胺、敌草腈)、苯酰胺类(异噁酰草胺)、三唑羧基酰胺(氟胺草唑)和烷基三嗪类(三嗪氟草胺、茚嗪氟草胺) 4亚类的6个化合物为纤维素生物合成抑制剂(CBIs)。只有烷基三嗪类含有2个手性化合物。
三嗪氟草胺作为光依赖性光系统 II (PET)抑制剂,它的2个对映异构体几乎具有相等的活性,但作为细胞分裂抑制剂,(R)-对映异构体的活性是(S)-的100倍。
对三嗪氟草胺分子的数个外消旋位点进行优化后,其作为纤维素生物合成抑制剂的除草活性提高了。引入含有第2个手性中心的双环茚满环系统显著增加化合物的除草活性。
把2,6-二甲基氨基茚(2,6-dimethylindanylamino)和含有外消旋 1-氟乙基基团的氨基三嗪结合在一起可产生除草活性高的化合物。为了弄明白手性对除草活性的影响,对所有的8个立体异构体(1R,2R,6R)、(1R,2R,6S)、(1S,2S,6S)、(1S,2S,6R)、(1R,2S,6R)、(1R,2S,6S)、(1S,2R,6S)和(1S,2R,6R)进行分离,并测定它们的除草活性和作用机制。2,3-二氢-2,6-二甲基-1H-茚-1-胺(茚满基)环系统的(1R,2S)-构型对除草活性和从抑制光合系统II转变为抑制纤维素生物合成具有决定性作用。2个相对应的非对映异构体,主要成分(1R,2S,6R)和微量成分(1R,2S,6S)的含量比例为 95∶5,对纤维素生物合成有高的抑制活性,为茚嗪氟草胺的成分。
以(1R,2R)或(1S,2S)-构型茚满环等取代茚嗪氟草胺茚满环的(1R,2S)构型(图 5)可以影响分子和靶标间的相互作用,例如(2R)-甲基团(图 5a)或错误构型的(1S,2S)-茚满环系统(图5b)。、

图5 茚嗪氟草胺的活性(1R,2S,6R)-立体异构体和弱活性立体异构体的叠置
荧光显微镜法证实茚嗪氟草胺处理后抑制植物的纤维素生物合成和引起根和细胞形态反常。茚嗪氟草胺增加了质膜上大纤维素合酶颗粒的密度,降低了粒子速度,抑制聚合反应。
已建立用对映选择性途径合成反式-(1R,2S)-茚满胺,此合成途径包括新颖的动态动力学拆分以及之后的亲核取代反应。
作为最强创新烷基吡啶(alkykazine)除草剂,茚嗪氟草胺能够防治对其他作用机制除草剂有抗性的禾本科和阔叶杂草(剂量约50~75 g/hm2)。其对单子叶杂草的活性增加,是长期防除多个侵入性冬季一年生禾本科杂草的新的替代性策略。到目前为止,还没有发现此产品产生交互抗性。
3.3 乙酰羟酸合成酶/乙酰乳酸合酶抑制剂
支链氨基酸生物合成的第一步是在乙酰羟酸合成酶(AHAS),也称为乙酰乳酸合酶(ALS)催化下进行。
外消旋pyrimisulfan对Exserohilum orzicola等禾本科、莎草和阔叶杂草具有广谱和芽前除草活性,对移植和水植水稻有选择性。此物质含有手性羟基取代中心和含有嘧啶部分的芳基。
用HPLC优化拆分外消旋pyrimisulfan后,分离了(S)-对映异构体。(R)-对映异构体在0.32 g/hm2对稗草的芽前防效最高,其次为外消旋体(70%~80%)、(S)-对映异构体无活性(0%)。
Pyrimisulfan在低剂量(50~75 g/hm2)对日本水稻田中的主要杂草有杰出活性,这些杂草在近年已成为严重问题。开发的pyrimisulfan控制-释放制剂(如含有有效成分6.7 g/hm2的1 kg颗粒剂)以10 kg/hm2用于芽前到3叶期,能有效防除稗草属多年生杂草和抗磺酰脲除草剂的杂草。
水稻田除草剂嗪吡嘧磺隆具有外消旋(5R,5S)-5,6-二氢-5-二氢-5-甲基-1,4,2-二嗪-3-基部分,已被市场化用于防除一年生[例如稗草、狼把草、丁香蓼(Ludwiga prostrate)、鸭舌草]和多年生(例如水莎草、Sagittara trifolia、野荸荠、萤蔺)杂草。
3.4 选择性手性开发候选除草剂
手性除草剂的开发继续,如 4-HPPD作用机制的tolpyralate。
外消旋除草剂前体 tolpyralate防除许多禾本科和阔叶杂草,其对玉米具有优异的选择性。该化合物作为侧链上有1个立体中心的除草剂前体,在植物体内其手性碳酸盐残基裂解而形成非手性活性1H-吡唑除草剂(与1H-吡唑前体相同)。
4 杀菌剂
在最近 10年手性杀菌剂由原来的 34%强劲地增长为47%(图3c)。表1列出了最近开发的手性杀菌剂的作用机制类别。最近10年开发的14个杀菌剂中的9个为手性分子,大多数有1个或多个立体中心。它们主要作用于呼吸链,以琥珀酸脱氢酶(SDH,复合体II)和细胞色素bc1(复合体III)为生化靶标。
4.1 杀菌琥珀酸脱氢酶抑制剂
在过去10年中,作用于SDH复合体II的手性杀菌剂的数量显著增加。市场上有20个抑制SDH的杀菌剂,其中约35%具有1个或多个手性中心。吡唑-4-甲酰胺化学类别中手性化合物约占75%。大多数最近开发的抑制SDH杀菌剂对许多重要谷物作物病原菌有高的防效。它们的酰胺链接剂(amide linker)含有手性疏水性部分,如氟唑菌苯胺、吡唑萘菌胺、吡噻菌胺、氟唑环菌胺和苯并烯氟菌唑(表2)。
酰胺链接剂一般为苯基和噻吩基团(吡噻菌胺),它们被较大支链或双环手性疏水部分在邻位取代。好像酰胺链接剂和苯或噻吩环中手性邻位取代的“疏水部分”间形成的角对 SDH抑制剂型杀菌剂的杀菌谱和活性大小重要。也许,此“脱芳构化”趋向于优化疏水部分。最近,讨论了首次开发手性烟酰胺(含有噁唑啉的啶酰菌胺类似物)来发现新颖SDH抑制剂型杀菌剂。SDH酶(琥珀酸泛醌氧化还原酶)是由4个细胞核编码的亚单元组成的线粒体异四聚体。SDHA和SDHB亚单元暴露于线粒体基质中,具有高度品种变化性的SDHC和SDHD为锚定SDHAB二聚体于线粒体膜的内在膜蛋白。用X-射线晶体学测定了大肠杆菌(细菌)、野猪和鸡的 SDH的三维结构,得到了与羧酰胺杀菌剂的共晶体。在此基础上,对小麦病原菌Zymoseptoria tritici进行同源建模和 SDH抑制剂对接研究。根据羧酰胺在zymoseptoria tritici泛醌-结合口袋里的结合机制,手性疏水取代物主要是与 SDHC(Ala84C, Leu85C,Val88C)和 SDHD(Ala126D)的氨基酸亚单元发生疏水相互作用。这些在暴露于线粒体内膜中脂的蛋白表面形成一个沟。在生物体系中手性重要的情况下,这个SDH靶标表面内陷的疏水沟对手性配体敏感。
商业化的抑制 SDH的吡唑-4-羧酰胺杀菌剂没有1个对映异构体多的形式生产。目前市场上有对映异构体外消旋混合物(氟唑菌苯胺、吡噻菌胺)和具有2个(氟唑环菌胺、苯并烯氟菌唑)或3个手性中心(吡唑萘菌胺)非对映异构体混合物。
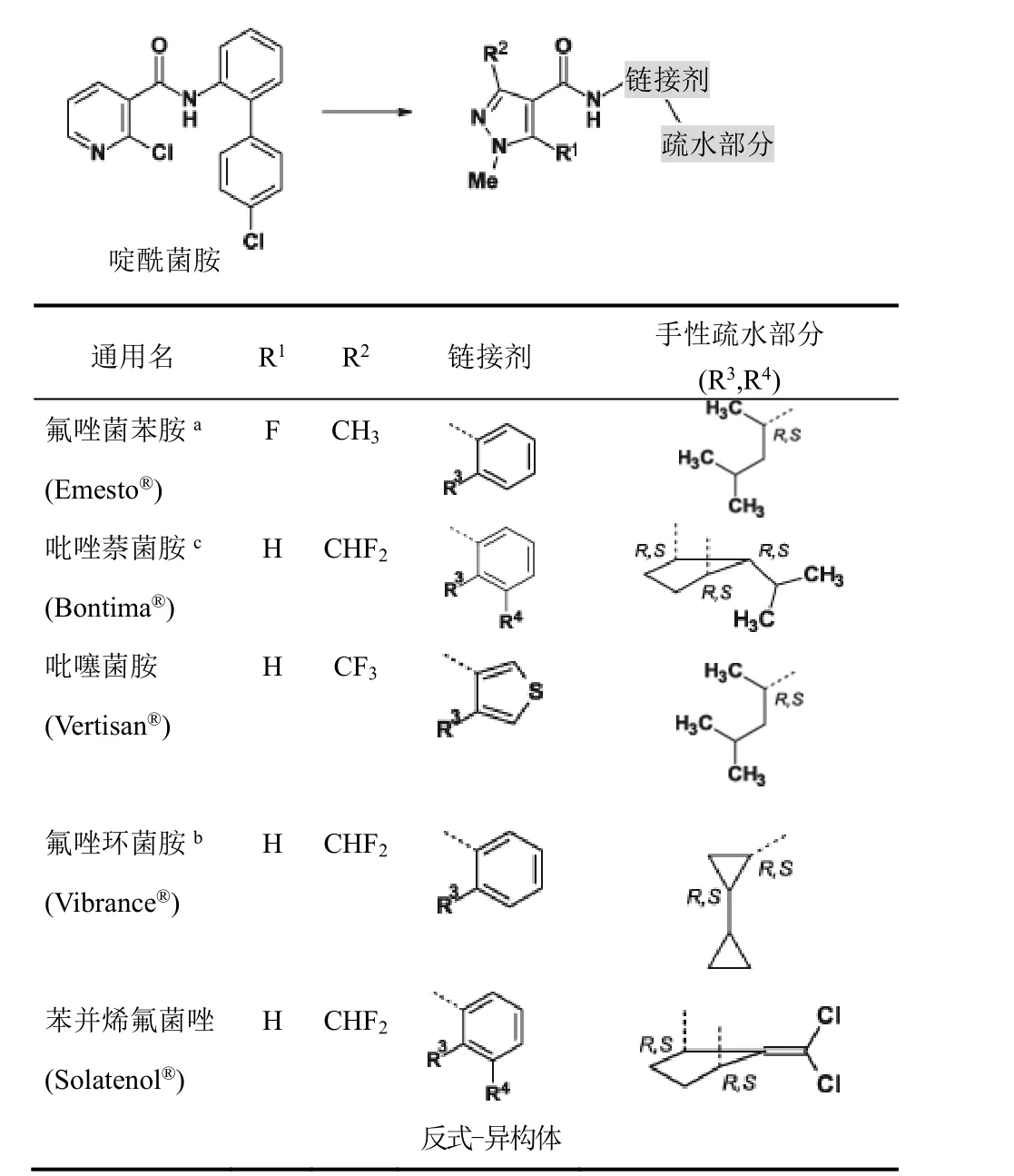
表2 从啶酰菌胺到SDHl杀菌剂的手性吡唑-4-基羧酰胺的结构过程
然而,对于氟唑菌苯胺和吡噻菌胺等,生物数据表明1个对映异构体比另一活性高(表3)。用手性硅胶相进行色谱纯化得到对映体过量百分比为95%~99%的对映异构体。
推断氟唑菌苯胺和吡噻菌胺(S)-对映异构体的较大活性与和 SDH的高度保守的泛醌结合位点的较大结合亲和性有关。SDH抑制剂模拟天然配体泛醌的结合,(S)-对映异构体对真菌病原体中复合体II的偏爱与在手性结合口袋中泛醌键左捻(left-hand twist)有关。
吡唑萘菌胺为顺式-和反式-异构体混合物,已被开发为防治香蕉生产中的叶斑病。
吡噻菌胺对白霉病(Sclerotinia sclerotiorum)、纹枯病(Rhizoctonia solani)和白绢病(Sclerotium rolfsii)等叶面和主要土传病害有活性,对其他病害也有活性。
氟唑环菌胺已被开发为广谱种子处理剂,对大豆、玉米和棉花等大范围作物的种传和土传雪腐明梭孢(Monographella nivalis)、小麦雪腐病菌(Typhula incarnate)和丝核菌属(Rhizoctoniaspp.)等真菌具有好的防治效果。

表3 分离的氟唑菌苯胺和吡噻菌胺的(S)-和(R)-对映异构体的杀菌活性对比
与吡唑萘菌胺相比,羧酰胺苯并烯氟菌唑分子中的立体中心数减少了,此化合物在9-位含有1个二氯亚甲基(=CCl2)。苯并烯氟菌唑是防治叶斑病(Z.tritici)等锈菌病原菌病害的广谱杀菌剂,对大豆锈病(Phakopsora pachyrhizi)有优异的活性。
氟吡菌酰胺(R=H)的构效关系(SAR)表明[-H2C-CH2-]片段可接纳甲基(R=Me)。这可能激励了外消旋氟唑菌酰羟胺的开发,此物质含有[-MeHCCH2-]片段、另一N-甲氧基团和等排的3-二氟甲基-1-甲基吡唑和2,4,6-三氟苯基部分。
氟唑菌酰羟胺的(2S)-对映异构体和制备富含(2S)-异构体的物质的工艺可能申请了专利。
最近,在阿根廷,氟唑菌酰羟胺和苯醚甲环唑混合物被引入防治甜椒白粉病和番茄灰斑病等病害。
4.2 甲氧基丙烯酸酯Qol杀菌剂(醌外部抑制剂)
2个天然杀菌剂oudemansin A(真菌Oudemansiella mucida产生)和myxothiazole A(橙色粘球菌Myxococcus fulvus产生)含有典型的“甲氧基丙烯酸酯药效团”和侧链上有2个或3个立体中心,作用于呼吸链复合体 III/细胞色素 bc1。目前市场上有20个作用于此位点的合成甲氧基丙烯酸酯QoI杀菌剂。只有属于3个不同化学类别的3个物质(15%)分子中有1个立体中心。
它们为外消旋噁唑菌酮(噁唑烷二酮)、(S)-咪唑菌酮(咪唑啉酮)和外消旋 mandestrobine,都具有甲氧基乙酰胺药效团。好像新的(R,S)-2-甲氧基-N-甲基乙酰胺药效团中立体中心的位置受到了 2个唑酮(azolone)类噁唑菌酮和(S)-咪唑菌酮的立体中心的影响。
以适宜的(R,S)-氰醇(乙醛和氰化钠反应)为前体,引入Mandestrobin的药效团(R=2,5-二甲基苯氧基)-甲基)于分子中(图 6)。

图6 以(R,S)-氰胺和(R,S)-2-羟基乙酰胺为前体合成mandestrobin的(R,S)-2-甲氧基-N-甲基乙酰胺药效团
(R,S)-氰醇的腈官能基发生水解形成(R,S)-2-羟基-乙酰胺,之后双甲基化(酰胺和羟基)生成mandestrobin。
4.3 氧化甾醇结合蛋白抑制剂
氟噻唑吡乙酮(oxathiapiprolin)(图7)是对卵菌纲病原菌引起的病害有特别高的活性的新颖类别哌啶基噻唑异噁唑啉类杀菌剂的第一个成员。其抑制氧化甾醇结合蛋白,低剂量对葡萄、马铃薯和蔬菜病害有优异的预防、治疗和残留活性。
在氟噻唑吡乙酮前,发现了(5R,S)-对映异构体的外消旋混合物,合成了不同手性重要分子,并评估了它们的杀菌活性。例如制备了第二先导结构(1R)-N-[(1R)-1-苯乙基]-4-噻唑-甲酰胺,此物质具有1个吡唑乙酰胺部分(第一个先导物含有2-氯-苯基乙酰胺,图7)。
虽然(1R)-对映异构体以10 mg/L对卵菌纲病原菌引起的病害有优异的预防和治疗活性,但对应的(1S)-对映异构体活性低。在研究限制性构象的项目中,开发了手性中心区域附近的环化,例如把α-甲基(a)环化到苯基的羧基氧位置和(b)苯基邻位。
在保持(1R)-构型的情况下,第一次修饰产生非活性分子;第二次修饰产生的(1R)-[1,2,3,4-四氢-1-萘基]酰胺的活性提高25倍多,其(1S)-对映异构体活性显著低。令人惊奇的是,制备的苯甲基酰胺生物电子等排体外消旋(5R,S)-(4,5-二氢-5-苯基-3-异噁唑基)-2-噻唑基化合物在0.4 mg/L对卵菌纲病原菌病害有相似水平的预防和治疗活性。在这种情况下发现,(5R)-对映异构体比相应的(5S)-对映异构体的活性高。4,5-二氢-异噁唑啉的SAR表明5-取代对高 杀菌活性重要,故进行了广泛的取代研究。
进行二次5-取代后得到含有平面外扭曲的苯环的[5,5]-螺类似物,其活性约增加 5倍。也可以在(5R,S)-4,5-二氢-异噁唑啉的 5-位引入 2,6-二取代苯环产生此扭曲结构,生成杀菌活性增加500倍的第二先导结构,产生氟噻唑吡乙酮。
氟噻唑吡乙酮的(5R)-对映异构体比相对应的(5S)-对映异构体的活性高。不过,可以推断上市外消旋产品的决定是基于其优异的活性和较低的生产成本,因为使用非手性起始化合物。
4.4 羧酸酰胺杀菌剂
羧酸酰胺包括非手性肉桂酸酰胺(烯酰吗啉、氟吗啉)、外消旋扁桃酸酰胺(例如双炔酰菌胺)和手性缬氨酸酰胺氨基甲酸酯(benthiavalicarb, iprovalicarb和valifenalate)。
外消旋二肽valifenalate为缬氨酸酰胺氨基甲酸酯类最新成员,对疫霉属、霜霉属和Plamopara sp.等卵菌纲菌有活性。此产品可用于不同蔬菜和葡萄或马铃薯等其他作物。
可通过对(4S)-N-4-(1-甲基乙基)-2,5-二氧-3-噁唑烷羧基-1-甲基乙基酯中间体[从手性构件(S)-缬氨酸得到]的 5-环裂解和外消旋(R,S)-β-氨基-4-氯-苯丙酸甲基酯进行等制备此类杀菌剂。
作用机制研究表明这些杀菌剂通过直接作用于纤维素合酶 3 (CesA3)抑制纤维素的生物合成而作用于磷脂生物合成和细胞壁的沉积(FRAC F5)。
4.5 选择性手性开发候选杀菌剂
不同作用机制的杀菌剂的开发例子说明了手性杀菌剂的开发继续。
例如 UK-2A具有杀菌活性,是从放线菌属(Streptomyces sp. 517-02)分离得到的天然代谢物。在1998年就介绍了UK-2A的合成。此发酵产品被用作前体,其 3-羟基-4-甲氧基-吡啶-2-基部分被 O-烷基化,得到1个新的手性和半合成的防治小麦和香蕉的主要真菌病原菌的吡啶酰胺杀菌剂fenpicoxamid。
Fenpicoxamid具有新颖的生化杀菌作用机制,用于谷物,抑制线粒体电子传递链中的线粒体复合体III,抑制Qi泛醌结合位点细胞色素c还原酶。对抗性酿酒酵母(Saccharomyces cerevisiae)的突变分析和分子对接研究表明UK-2A与antimycin A作用于相同位点。它强烈地抑制引起小麦叶枯病的真菌病原体Zymoseptoria tritici、小麦颖枯病病菌(Leptosphaeria nodorum)和水稻Pleomorphomonas oryzae等子囊菌纲真菌的离体生长(表4)。
杀菌剂前体fenpicoxamid在Zymoseptoria tritici活体内O-3-(异丁氧基)-甲氧基残基裂开转化为天然代谢物UK-2A,活性增加15倍。
Tolprocarb的(S)-对映异构体对水稻稻瘟病菌(Magnaporthe grisea)活性高,好像不同于传统黑色素生物合成抑制剂。其制备基于商业化的手性构件(S)-缬氨酸和进一步的反应步骤能够在立体中心没有外消旋化下进行。

表4 fenpicoxamid和天然产品UK-2A对离体真菌生长的抑制作用
4.5.1 Tolprocarb离体抑制聚酮合酶活性
甾酮生物合成抑制剂特别是 36甾酮-C14-去甲基酶抑制剂是最重要的广谱杀菌剂,约81%含有手性中心。其中没有一个产品以富含1个对映异构体的产品或纯的对映异构体上市,因为每一种立体异构体的作用(杀菌和植物生长调节作用)都是需要的。所有去甲基酶抑制剂抑制特异性细胞色素 P450酶,此酶能够对农业病原菌的甾酮生物合成途径中中间体C24-亚甲基二氢羊毛甾醇进行C14-氧化去甲基化。最近,新外消旋类二苯醚三唑(biphenyl ether-like triazole)杀菌剂mefentrifluconazole的登记在进行。
氟吡菌胺的(S)-对映异构体的活性是其外消旋物的2倍。因此,推断手性开发的候选SDH抑制剂fluindapyr和inpyrfluxam有相似地特点,即(S)-对映异构体结合于真菌病原体复合体II (SDH)。
5 杀虫剂
在过去的10年中,商业化手性杀虫剂、杀螨剂和杀线虫剂(图 1b)的占比从 40.5%下降到 27%(图3e)。表 1列出了最近开发的手性杀虫剂(16%)的类别。3个上市的杀虫剂为手性物质:2个为半合成天然产品乙基多杀菌素和雷皮菌素(lepimectin),1个为抑制昆虫烟碱乙酰胆碱受体(nAChR)的 2个非对映体的外消旋混合物氟啶虫胺腈(sulfoxaflor)。
5.1 烟碱乙酰胆碱受体竞争性调节剂
市场上11个nAChR竞争性调节剂型杀虫剂中约27%为手性分子。
除了外消旋新烟碱类呋虫胺和从烟草属植物分离的生物碱(S)-烟碱外,最近开发的属于新颖亚砜亚胺类杀虫剂氟啶虫胺腈全球上市,其为非对映体混合物。
呋虫胺的(S)-(+)-对映异构体比(R)-(-)-对映异构体的活性高,这显示在它们与海蜗牛(Aplysia californica)的乙酰胆碱结合蛋白(AChBP)的兴奋剂结合口袋的结合位点的相互作用上。相反(S)-(+)对映异构体和外消旋呋虫胺对 nAChR靶标位点几乎有相同的亲和性,杀虫活性也几乎相同。
氟啶虫胺腈含有 2个手性中心(硫原子和与 3-三氟甲基-吡啶环相连的碳原子),由4个立体异构体(1S,2S)、(1S,2R)、(1R,2R)和(1R,2S)组成(图 8)。
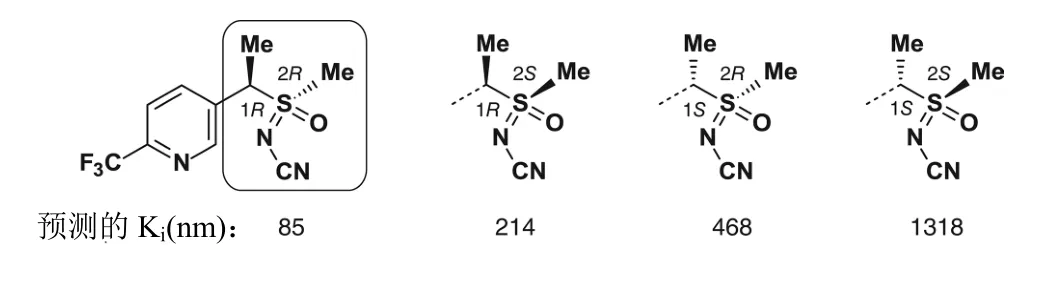
图8 预测的氟啶虫胺腈立体异构体的结合亲和性
虽然氟啶虫胺腈的4个立体异构体可用色谱分离,但单一异构体在溶解状态下迅速转化为非对映异构体对。因此,难以研究每个非对映异构体的结合亲和性。然而,根据预测的结合亲和性(Ki/nM),可以推测 4个异构体对氟啶虫胺腈的活性都有贡献。从野生型 nAChR的定量构效关系(QSAR)模型的立体异构体的结合位置可知,立体异构体间的主要差异来自2个手性中心甲基团的方向。好像1-位的手性中心比硫原子对氟啶虫胺腈的结合亲和性有更重要的影响。然而,因为氟啶虫酰胺的对映异构体能够转化为非对映异构体,所以氟啶虫酰胺以 4种非对映异构体的混合物市场化。
由计算预测到(1R,2R)-立体异构体以很强的作用结合于nAChR的活性位点。(1R,2S)-和(1S,2R)-立体异构体(图8)的Ki与外消旋氟啶虫胺腈的(Ki=265 nM)相差不是很多,而(1S,2S)-立体异构体只有弱的亲合力(Ki=1318 nM)。基于这些结果和较低的结合亲合力,桃蚜(Myzus persicaeR81T) nAChR的R81T突变对氟啶虫胺腈的影响好像远小于对所有新烟碱类杀虫剂的。
5.2 烟碱乙酰胆碱受体变构调节剂
大环多杀菌素类多杀菌素(多杀菌素A和D的混合物)是 nAChR变构调节剂的第一个成员。从放射菌刺糖多孢菌(Saccharopolyspora spinosa)产生的此天然衍生发酵产品对许多鳞翅目昆虫,以及双翅目、蓟马、螨和蚂蚁有杀虫活性。
多杀菌素分子有3个手性结构,聚酮大环内酯四环、D-forosamine糖和三-O-烷基-L-鼠李糖,它们的相互作用对杀虫活性重要。
第 2个成员为半合成杀虫剂乙基多杀菌素(图9),是用在QSAR分析中好像有应用前景的人工神经元网络(ANN)策略在多杀菌素的 L-鼠李糖部分上进行特异性O-乙基化和合成化学衍生而来。
ANN建模预测表明 L-鼠李糖-3′-O-乙基化与 2′或 4′-O-乙基化相比使活性增加,这已通过试验证实。对大环内酯四环修饰(来自于 ANN建模法)(L-鼠李糖-3′-O-乙基化)和 5,6-双键的加氢(来自 QSAR)设计出乙基多杀菌素。为了使乙基多杀菌素的发酵式生产应用于实践,通过高通量筛选项目发现了产生所需的 L-鼠李糖-3′-去甲基多杀菌素 J (和多杀菌素L)的改良的突变菌株(通过基因工程)。
从遗传上来说,这些突变为编码相对应的3′-O-转甲基酶的spnK基因发生的单点突变。最后,对多杀菌素J进行特异性L-鼠李糖-3′-O-乙基化和5,6-双键还原;而对于多杀菌素L由于其大环内酯四环6-位甲基的存在阻止了5,6-双键的加氢,只进行了L-鼠李糖-3′-O-乙基化反应,由此对多杀菌素J (主要成分)和L (微量组分)进行进一步的半合成修饰。
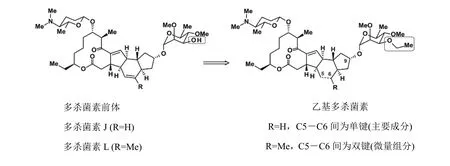
图9 以多杀菌素J和L为前体,进行L-鼠李糖-3′-O-乙基化制备半合成杀虫剂乙基多杀菌素
5.3 谷氨酸门控氯离子通道竞争性调节剂
4个大环内酯类杀虫剂阿维菌素、甲氨基阿维菌素苯甲酸盐、弥拜霉素和雷皮菌素已作为谷氨酸门控氯离子通道(GluCl)竞争性调节剂商业化用于作物保护。发酵的埃维菌素和弥拜霉素家族不仅作为农化产品,而且在动物健康领域重要,以前已被介绍过。
雷皮菌素是S. hygrocopicus发酵物弥拜霉素B(A3和 A4内酯混合物)的半合成衍生物[13-位具有(Z)-[(甲氧基亚氨基)-苯乙酰基]氧残基],因此也是2个大环内酯的混合物(R=6′-乙基的 A4内酯为主要成分,R=6′-甲基的 A3内酯为微量组分)。其具有广谱杀虫活性(双翅目和鳞翅目害虫、叶螨、卷蛾、蓟马和粉虱),可用于柑橘、葡萄、茶和蔬菜。
5.4 选择性手性开发候选杀虫剂
手性杀虫剂的开发继续,例如不同作用机制的3个例子。
非手性鱼尼汀受体(RyR)调节剂例如氯虫苯甲酰胺和溴氰虫酰胺激励着外消旋邻甲酰氨基苯甲酰胺环溴虫酰胺的合成和开发。(R,S)-1-环丙基乙基酰胺取代甲基酰胺基团得到新的专利分子。好像 RyR能与酰胺侧链中的手性中心作用。
Fluxametamide是外消旋异噁唑啉杀虫剂(包含顺式/反式-异构体甲肟基团),对不同鳞翅目、缨尾目和双翅目有高的杀虫活性,也有杀螨活性(叶螨科)。虽然(S)-对映异构体更有效,但由于缺少经济有效的不对称技术,有可能在接下来几年中,只能生产外消旋混合物。结构相关的商业化外消旋异噁唑啉杀体外寄生虫药afoxolaner、fluralaner、lotilaner和 sarolaner也都以外消旋物生产。Fluxametamide是新颖的配体门控氯离子拮抗剂,抑制 γ-氨基丁酸(GABA)门控氯离子通道和GluCls。
双丙环虫酯(afidopyropen)是昆虫香草酸型瞬时受体电位通道的有效的特异性调节剂。其是烟曲霉(Aspergillus fumigatus)产生的天然产物 pyripyropen A的半合成衍生物。发酵产品pyripyropen A在碱性条件下分子中的立体中心不发生外消旋作用而发生O-脱乙酰基。在发生O-酰化作用后,2个羟基与环丙烷羰基氯发生 O-酰化反应,产生 afidopyropen。三-O-酰化副产物(R=环丙基羰基)易被循环用于生产O-脱酰化pyripyropen A。Afidopyropen对豌豆蚜等刺吸式害虫有活性。
6 杀螨剂
以下为一个罕见事例,即外消旋杀螨剂前体在害虫体内转化为有毒性的非手性形式。外消旋β-酮腈丁氟螨酯(图10)是杀螨剂前体,分子中有1个立体中心。混合物在活体内形成非手性丁氟螨酯烯醇代谢物后对叶螨和柑橘全爪螨(Panonychus citri)有高度选择性。
丁氟螨酯在其2-甲氧基乙酯发生水解后,已知立体中心(α碳原子)发生自然(非酶作用)脱羧基,在叶螨体内易转化为非手性杀螨活性的烯醇代谢物。丁氟螨酯在特别低的浓度能抑制复合体II中的线粒体电子传递。

图10 外消旋丁氟螨酯在叶螨体内其2-甲氧基乙酯发生水解,再发生脱羧反应形成非手性烯醇代谢
外消旋丁氟螨酯在田间土壤中的消损具有对映异构体选择性,因为(αR)-(+)-丁氟螨酯对映异构体易于降解[(αR)-(+)-和(αS)-(-)-丁氟螨酯的半衰期为12.2 和 13.6 d]。
7 杀线虫剂
有机磷(OPs)被用于防治植物病害、昆虫、线虫和螨以及防除杂草。91个杀虫乙酰胆碱酯酶(AChE)抑制剂(氨基甲酸酯、有机磷)中,约 26%物质具有手性中心。8%氨基甲酸酯为手性分子,约34%有机磷为手性化合物。已发现对映异构体对家蝇活性有差异,例如乙酰甲胺磷和甲胺磷;在所有的情况下,(R)-对映异构体活性最高。
这些类别的不同成员已被用作非挥发性杀螨剂多年。一些产品例如氨基甲酸酯杀线虫剂涕灭威已退出了市场。AChE活性中心峡谷的功能结构具有一定刚度,对稳定催化三分子重要,具有一定构象柔性能够与高亲和性的AChR配体相互作用。
有机磷被认为是羧酸的类似物,特别是在酶反应中的过度状态,也可能是生理磷的抗代谢物。AChE立体选择性可能是差异化柔度或最优化的催化专一性活性中心的刚性环境变异小所致。
外消旋有机磷imicyafos对AChE有抑制活性,以新的触杀性杀线虫剂上市。此物质对根结线虫、根腐线虫和胞囊线虫有活性,可用于果树、包括马铃薯的蔬菜和其他果园或温室作物。
8 结 论
手性农化产品和开发中的农化产品例表明农药分子中的立体中心有重要的效果。在过去 10年中SDH抑制剂型杀菌剂的不断增加的重要性以及对SDH靶标和配体的优先构型[氟唑菌苯胺和吡噻菌胺(S)-对映异构体活性高]知识的增加已导致含有手性邻-取代“疏水”取代物的许多杀菌剂(5个外消旋产品)上市。Fluindapyr和inpyrfluxam,2个进一步外消旋SDH抑制剂候选物在不久的未来将上市。
尽管发现了以手性(R)-构型先导物结构开始的新的杀菌剂类别,但最后商业化产品氟噻唑吡乙酮为外消旋物。此外,杀虫剂氟啶虫胺腈含有2个不对称中心,已以4个立体异构体的混合物上市,因为单个异构体能快速转化为非对映体。
一些新手性农药前体例如杀螨剂丁氟螨酯和除草剂 tolpyralate在螨体内或寄主植物中进行活体转化,生成生物活性非手性农化产品。例如手性杀螨剂前体丁氟螨酯转化为杀螨的非手性活性烯醇代谢物,此代谢物对叶螨有活性。选择性手性开发的候选物tolpyralate在被植物代谢前,其含有的1个立体中心侧链增加此物质在植物体内的生物利用度。
农化产品工业继续搜寻具有生物活性和易得到的手性天然产品。用半合成方法选择性结构修饰可能开发新的和创新手性农化产品,例如半合成杀虫剂乙基多杀菌素和天然产品pyripyropen A衍生开发的 afidopyropen或开发的用于谷物防治病害的杀菌剂前体fenpicoxamid。
然而,手性分子的开发需要经济有效的不对称方法,故大部分手性农化产品也将主要以外消旋物生产,如选择性手性开发候选物 pyrimisulfan(除草剂)、mefentrifluconazole(杀菌剂)或 fluxametamide(杀虫剂)等。
未来,酶拆分以及不对称(生物)催化等生物催化路径的改进和进一步扩展,将会成为农业化学工业非常重要的问题。
