血清sPDL1水平和外周血NLR在判断晚期胆管癌患者生存预后中的意义
2020-01-17遆振宇高小鹏千东维慕喜喜
遆振宇,高小鹏,千东维,慕喜喜
(1.西安市第三医院a.普外二科;b.手术室,西安 710018;2.西安市中心医院普外二科 西安 710003)
胆管癌包括肝内胆管上皮癌(intrahepatic cholangiocarcinoma,IHCC)、胆囊癌(gallbladder carcinoma,GB ca)、肝外胆管上皮癌(extrahepatic cholangiocarcinoma,EHCC)及肝胰管壶腹癌(ampulla of vater carcinoma,AoV ca),该类患者死亡率高,且预后差[1-4]。目前已证实肿瘤细胞具有免疫逃避功能,可以通过躲避机体免疫细胞的识别和攻击,从而导致肿瘤细胞的增殖与扩散[5-6]。与免疫相关的细胞主要有中性粒细胞、淋巴细胞以及血小板,均发现具有抑制肿瘤细胞生长的能力[7-8]。在肿瘤免疫治疗中许多生物标志物,如干扰素-γ(interferon-γ,IFN-γ)和转化生长因子-β(transforming growth factor-β,TGF-β)等与疾病的发生进展有关[9]。细胞程序性死亡配体1(programmed death-Ligand 1,PDL1)作 为免疫检查点抑制剂,是肿瘤细胞或肿瘤微环境中一个新的潜在生物标志物[10]。有研究报道[11-13],在肾细胞癌、弥漫性大B细胞淋巴瘤和多发性骨髓瘤中,外周血sPDL1过表达能削弱宿主免疫功能,导致较差的预后。因此,本文通过测定晚期胆管癌(biliary tract cancer,BTC)患者血清中sPDL1水平,探究sPDL1与中性粒细胞与淋巴细胞 比 值(neutrophil-to-lymphocyte patro,NLR)在BTC患者中生存预后的意义。
1 材料与方法
1.1 研究对象 选取2017年2月~2019年3月我院收治的、病理诊断为BTC且进行姑息化疗的患者144例,其中,男性90例,女性54例,平均年龄64.3±10.5岁。包括肝内胆管上皮癌(IHCC) 63例、胆囊癌(GB Ca)51例、胆外胆管上皮癌(EHCC)18例及肝胰管壶腹癌(AoV Ca)12例。纳入标准:确诊为BTC且进行姑息性化疗的患者,无心功能不全者。排除标准:排除具有其他慢性炎症疾病者,严重肝肾功能损伤者,免疫系统低下者,主动退出随访者。本研究经得我院伦理委员会批准。
1.2 试剂和仪器 酶标仪购自美国BioTex,自动化生化分析仪Siemens ADVIA2400购自德国西门子公司,自动化血液细胞分析仪BC6800购自迈瑞公司。
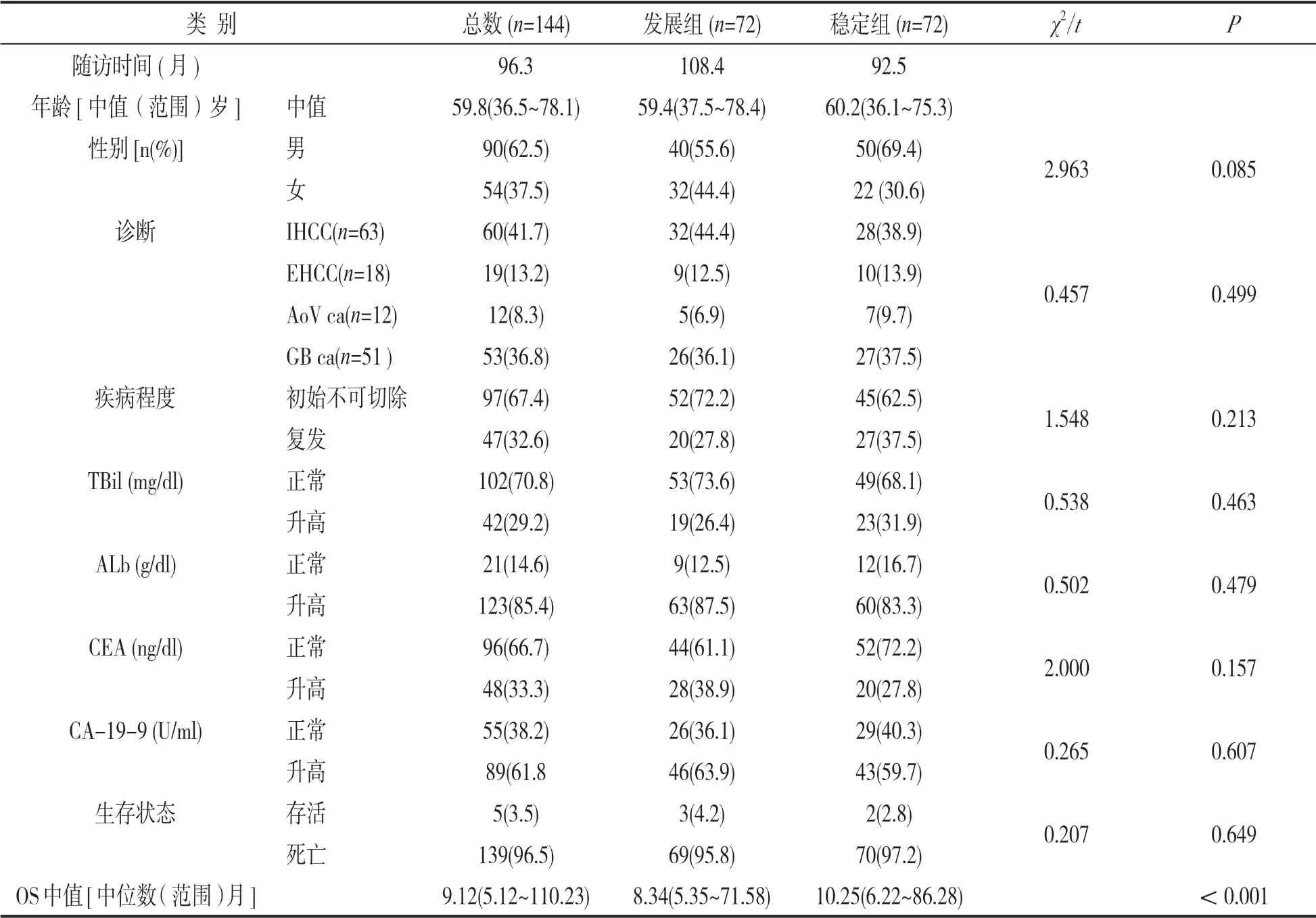
表1 所有患者的基本资料及临床症状分析[n(%)]
1.3 方法 收集患者第一次姑息化疗前的血液标本,采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测患者血清sPDL1含量,每个样本重复测定三次[11]。采用自动化血液细胞分析仪检测总胆红素(total bilirubin,TBil)、清 蛋 白(albumin,ALB)、癌 胚 抗 原(carcinoembryonic antigen,CEA)、糖 链 抗 原19-9(carbohydrate antigen 19-9,CA-19-9)水平和血细胞数目(中性粒细胞、血小板、淋巴细胞)。NLR和PLR由中性粒细胞和血小板及淋巴细胞数目计算所得。全身免疫炎症指数(systemic immune inflammation index,SII)计算方法:中性粒细胞数×血小板数/淋巴细胞数量[14]。
采用随机抽样模式[15]将患者分为两组:发展组和稳定组。总生存时长数(overall survival, OS):化疗的第一天到死亡或者最后一次随访,OS的中值采用K-M模式计算。患者的生存状态是通过国家死亡上报系统进行判定。对于预测患者OS的变量sPDL1,NLR,PLR和SII的分界值确定,本文采用极小P值接近法进行测定[25],生物标志物的分界值测定采用双重交叉效度分析法[26]。
1.4 统计学分析 所得数据均采用SPSS 22.0软件进行统计学分析。计数资料采用百分比表示,计量资料采用中位值及均数(标准差 )表示,利用q检验及t检验进行统计学分析,以P<0.05为差异具有统计学意义。采用单因素及多因素Cox回归模型分析法分析患者的OS,来研究sPDL1,NLR,BTC患者生存预后的关系,以P<0.05为差异具有统计学意义。
2 结果
2.1 患者基本资料及生存时长比较 见表1。两组患者的临床资料(年龄、性别、原始病因、ALB,CEA和CA-19-9等)进行比较,差异均无统计学意义(P>0.05),所有患者持续随访96.3月,OS中值是9.12月。比较两组患者的OS,发现发展组患者OS中值为8.34个月,稳定组为10.25个月,差异具有统计学意义(P<0.05)。
2.2 免疫相关生物标志物分界值的水平比较分析 见表2,表3。发展组与稳定组的sPDL1分界值分别为2.91和1.01 ng/ml。同时,发现患者的sPDL1分界值是可变的。NLR,PLR及SII的中值分别为2.58,141.78及583.95,分界值分别为3.48,88.72和573.56。另外发现IHCC患者sPDL1水平最高,而EHCC患者sPDL1水平最低。

表2 两组患者宿主免疫相关生物标志物水平比较

表3 两组分界值的确定及比较
2.3 生存时长对比分析 患者的sPDL1水平中值 为1.19(0.04~7.31)ng/ml,而 正 常 健 康 人 群SPDLT水平为1.19(0.03~2.32) ng/ml,两者水平相同,故血清中sPDL1水平在健康人群与BTC患者间差异无统计学意义。然而,患者疾病程度不同,其sPDL1及NLR中值不同。sPDL1<0.96 ng/ml的患者OS中值为16.65个月,而sPDL1≥0.96 ng/ml的患者为10.38个月,差异具有统计学意义( P<0.001)。同时,NLR<3.48的患者OS中值为18.52个月,显著长于NLR≥3.48患者的OS中值(13.45个月),差异具有统计学意义(P<0.001)。因此,sPDL1低水平患者表现出较长的OS,表明sPDL1高水平会增加患者死亡风险。NLR值低于分界值的患者表现出更长的OS。
2.4 患者姑息化疗后生存预后因素的分析 见表4。体力状态、诊断、疾病程度(初始不能切除的或复发的)、转移器官数量、低ALB及高CEA或CA-19-9是影响患者预后的因素。sPDL1,NLR和SII是影响患者的OS因素(P<0.05)。多因素分析结果表明,sPDL1和NLR也是影响患者预后的独立因素。

表4 影响患者生存预后的因素分析
3 讨论
肿瘤免疫学是肿瘤治疗领域的一种新方法。特别是在黑色素瘤、非小细胞肺癌和肾细胞癌中免疫检查点抑制剂的成功运用[16-17]。已证实预后较差的BTC患者主要在于其免疫检查点和细胞因子的基因突变[18]。PDL1和程序化死亡受体1(PD1)作为其中的免疫检查点抑制剂,在预后较差患者中水平显著增高[19]。目前如果想评估肿瘤细胞和肿瘤微环境中的PDL1或PD1水平,需要足够量的肿瘤组织。往往肿瘤患者的组织活检是十分困难的,尤其是BTC患者,肿瘤细胞仅仅通过胆管进行扩散,所以获取足够的肿瘤组织是一个挑战性难题。因此,进行液体活检或者液体生物标志物检查将是目前更好地选择。本文对BTC患者血清中sPDL1水平进行测定,分析其与姑息化疗后患者生存预后的关系。采用ELISA测定BTC患者在姑息化疗开始前血清中sPDL1 水平。发现sPDL1 表达水平可以在所有患者中测定,范围为0.04~7.31ng/ml。在复发且具有较低肿瘤转移的患者中,sPDL1 水平显著低于初始不能切除的肿瘤患者,且复发患者的OS较长。另外,在四种不同病因的肿瘤患者中,IHCC患者的sPDL1 水平最高,OS最短(8.28个月)。可能的原因是,PDL1主要在巨噬细胞和树突细胞中表达,能够与活化的T细胞、B细胞及NK细胞上表达的PD1相结合,起到免疫抑制作用[21]。当PDL1与PD1结合后,抑制信号被激活,从而反馈给T细胞,起到负调节作用[22]。同时肿瘤细胞也表达PDL1,激活抑制信号,实现逃脱宿主免疫应答。sPDL1 被证实能与阳性肿瘤细胞或免疫细胞上的PD1结合,起到全身性免疫抑制作用[23-24]。然而,目前sPDL1 的确切功能还不十分清楚。
另一方面,已有研究证实NLR,PLR以及SII在实体瘤预后监测中具有重要价值[20]。本研究发现高水平NLR,PLR以及SII的患者具有较短的OS。确定这些免疫标志物的分界值后,证实NLR水平越高,患者预后越差,OS越短。
我们的研究存在一定局限性。首先本研究属于回顾性的、寡中心的研究,虽然我们尝试去验证这些标记物的分界值,但发现这些应该在本研究设计之前且不同独立患者群中进行验证。而且,关于sPDL1的作用及机制还有待进一步研究。综上所述, sPDL1 在BTC患者血清中的含量是可以测定的,高水平的sPDL1 是BTC患者姑息化疗后生存预后的独立因素。因此,sPDL1 可能是免疫肿瘤药物研究的一种液体生物标记物,具有重要临床意义。
