慢病毒介导的KIAA1199表达下调对肝癌HuH-7细胞增殖和凋亡的影响及机制
2020-01-17王立蓉孙小峰
王立蓉, 戴 峰, 孙小峰
南京市第二医院 1.消化科; 2.肝脏肿瘤科, 江苏 南京 210009; 3.江苏省肿瘤医院内科
肝癌是我国常见的恶性肿瘤,其发病率呈逐年上升的趋势,肝癌恶性程度极高、预后差、进展迅速,已成为威胁人类生命健康的重要原因[1]。研究报道显示,恶性肿瘤的发生与基因的表达改变有关,这些基因异常表达常与肿瘤的恶性进展程度有关,靶向抑制癌基因的表达或重建抑癌基因的表达可能是肿瘤治疗的有效途径[2]。最早人们发现,KIAA1199基因与听力有关,其编码的蛋白在脑组织、肺组织及人类的胚胎组织中表达水平较高,而在骨骼肌、肝脏、骨髓及外周血等组织中表达水平极低,KIAA1199能够通过表观遗传或遗传机制影响细胞增殖、凋亡等生物学行为[3]。现阶段的研究证据显示,KIAA1199是一个与人类肿瘤有关的调控因子,在胰腺癌、肺癌、结直肠癌等肿瘤中已经发现KIAA1199高表达,并且其可以减少肿瘤细胞凋亡,诱导肿瘤细胞恶性增殖[4-6]。研究[7]显示,KIAA1199在肝癌组织中高表达,而对于KIAA1199在肝癌细胞增殖和凋亡中的作用还不明确。本实验以肝癌HuH-7细胞作为体外研究对象,以慢病毒介导KIAA1199表达下调,探讨下调KIAA1199对肝癌细胞增殖和凋亡的影响和机制。
1 材料与方法
1.1 材料肝癌HuH-7细胞购自美国ATCC;C-Caspase-9抗体购自美国Abcam公司;阴性对照LV3-shRNA control慢病毒和LV3-KIAA1199 shRNA慢病毒由南京科佰生物科技有限公司构建;C-Caspase-3抗体、β-catenin抗体购自碧云天生物技术有限公司;C-myc抗体购自美国Santa Cruz Biotechnology。KIAA1199 shRNA序列为:5′-CGAATGAAGATCATCAAGAAT-3′。
1.2 慢病毒感染和细胞分组肝癌HuH-7细胞分成Control组、sh-NC组、sh-KIAA1199组3组,sh-NC、sh-KIAA1199分别为稳定感染阴性对照LV3-shRNA control慢病毒和LV3-KIAA1199 shRNA慢病毒的肝癌细胞,Control为未经慢病毒感染的肝癌细胞。慢病毒感染复数为20,细胞培养72 h,嘌呤霉素筛选2周。
1.3qRT-PCR测定KIAA1199shRNA下调效果提取各组细胞总RNA(TRIzol法),在PCR反应管中合成cDNA,PCR反应管中加入Oligo dT 1 μl、RNAse-Free H2O 11 μl,在65 ℃中反应15 min,继续加入5×Buffer 4 μl、Deoxynucleotide Mix 2 μl、Rnase Inhibitor 0.5 μl、Transcriptor RT 0.5 μl,添加RNAse-Free H2O补足至20 μl,置于PCR仪中,55 ℃孵育30 min。内参设置为GAPDH,采用2-△△Ct法计算KIAA1199表达水平。PCR引物序列为:KIAA1199 F-5′-GGCTGTGGCCTATGCAGTCA-3′,R-5′-TGTGACAAGGTTCCCACTGC-TTAC-3′。GAPDH F-5′-CTAAGTCATAGTCCGCCTAG-AAGCA-3′,R-5′-CTAAGTCATCAGTCCGCCTAGAAGCA-3′。
1.4Westernblotting检测KIAA1199shRNA下调效果收集对数期的Control、sh-NC、sh-KIAA1199细胞,提取细胞总蛋白,配制10%的分离胶和5%的浓缩胶,每个孔中添加50 μg蛋白,浓缩胶中用60 V电压,分离胶中用120 V电压电泳。250 mA电流转膜,转膜时间设置为60 min。将PVDF膜放在质量浓度为50 g/L胎牛血清白蛋白溶液中,在37 ℃孵育结合1 h。将PVDF膜从封闭液中取出,置于一抗稀释液中,在4 ℃中过夜。然后将PVDF膜放在二抗稀释液中,在室温中结合2 h。采用ECL方法显色,Labworks分析数据,根据条带的光密度值分析蛋白水平,内参为GAPDH。KIAA1199抗体以1∶1 000稀释,HRP标记的二抗以1∶2 000稀释。
1.5CCK-8测定KIAA1199shRNA对肝癌细胞增殖影响将Control、sh-NC、sh-KIAA1199细胞配制成浓度为2×104个/ml的悬浮液,每孔铺100 μl,将细胞种植到96孔板,在细胞培养48 h后,每个孔内添加10 μl的CCK-8工作液,继续孵育4 h后,在450 nm时检测吸光度值(Absorbance,A值)。
1.6 流式细胞术测定KIAA1199shRNA对肝癌细胞凋亡影响收集对数期的Control、sh-NC、sh-KIAA1199细胞,用冰预冷的PBS溶液洗涤细胞2次。每组收集约1×106个细胞,添加5 μl的AnnexinV-FITC和PI染液,避光孵育15 min。流式细胞仪检测细胞凋亡。
1.7Westernblotting检测细胞中C-Caspase-3、C-Caspase-9、β-catenin、C-myc蛋白表达收集对数期的Control、sh-NC、sh-KIAA1199细胞,按照1.4中Western blotting方法测定C-Caspase-3、C-Caspase-9、β-catenin、C-myc蛋白水平,内参为GAPDH。
1.8Wnt/β-catenin信号通路激活剂LiCl对下调KIAA1199的肝癌细胞增殖和凋亡影响收集稳定感染LV3-KIAA1199 shRNA慢病毒的肝癌细胞,用含有20 mmol/L的Wnt/β-catenin信号通路激活剂LiCl培养液培养,记为sh-KIAA1199+LiCl。按照上述1.5中CCK-8、1.6中流式细胞术和1.7中Western blotting方法测定细胞培养48 h后增殖、凋亡和C-Caspase-3、C-Caspase-9、β-catenin、C-myc蛋白表达情况。

2 结果
2.1KIAA1199shRNA慢病毒下调肝癌细胞中KIAA1199表达水平感染KIAA1199 shRNA慢病毒的肝癌细胞中KIAA1199 mRNA和蛋白水平均下降(见图1、表1),KIAA1199 shRNA降低肝癌细胞中KIAA1199表达水平。
2.2 下调KIAA1199抑制肝癌细胞增殖并诱导细胞凋亡感染KIAA1199 shRNA慢病毒的肝癌细胞A值降低,细胞凋亡率升高,细胞中C-Caspase-3、C-Caspase-9蛋白水平升高(见图2、表2),下调KIAA1199抑制肝癌细胞增殖并诱导细胞凋亡。
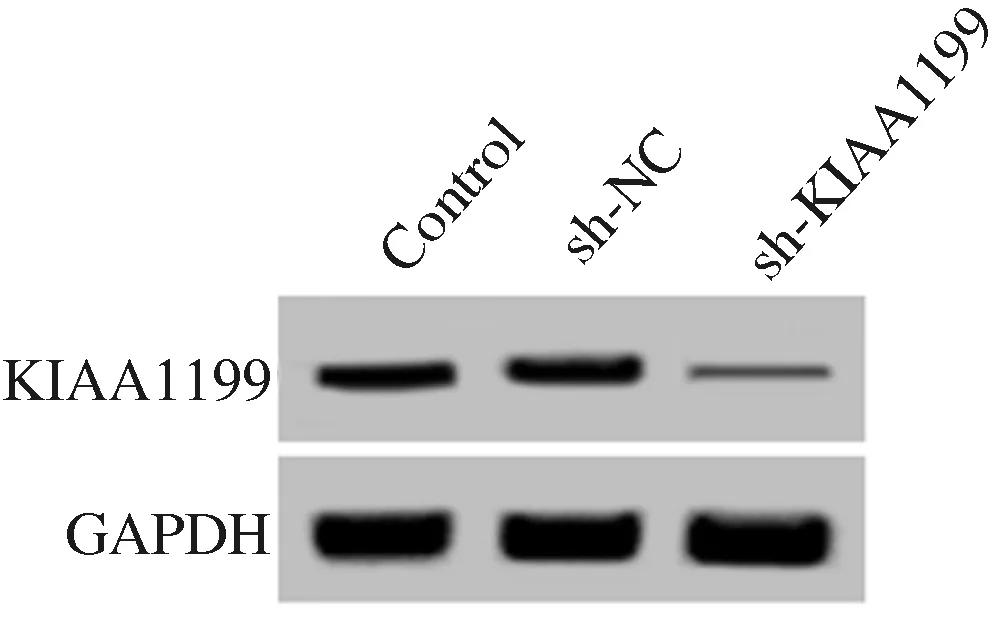
图1Westernblotting检测KIAA1199shRNA慢病毒感染后肝癌细胞中KIAA1199蛋白表达情况
Fig1TheexpressionofKIAA1199proteininlivercancercellsinfectedwithKIAA1199shRNAlentivirusdetectedbyWesternblotting
表1 KIAA1199 shRNA慢病毒感染后肝癌细胞中KIAA1199 mRNA及蛋白水平
注:与sh-NC组比较,*P<0.05。
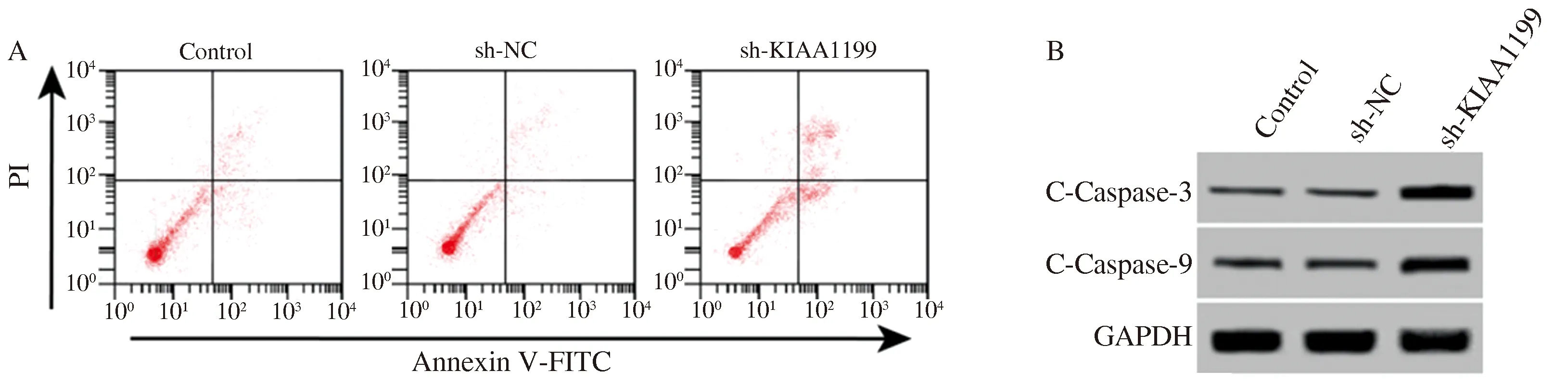
图2KIAA1199shRNA慢病毒感染后肝癌细胞凋亡和C-Caspase-3、C-Caspase-9表达情况A:流式细胞术测定KIAA1199 shRNA慢病毒感染后肝癌细胞凋亡变化;B:Western blotting检测KIAA1199 shRNA慢病毒感染后肝癌细胞中C-Caspase-3、C-Caspase-9蛋白表达情况
Fig2ApoptosisandexpressionsofC-Caspase-3andC-Caspase-9inlivercancercellsinfectedwithKIAA1199shRNAlentivirusA: the apoptosis of liver cancer cells infected with KIAA1199 shRNA lentivirus detected by flow cytometry; B: the expressions of C-Caspase-3 and C-Caspase-9 in liver cancer cells infected with KIAA1199 shRNA lentivirus detected by Western blotting
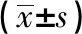

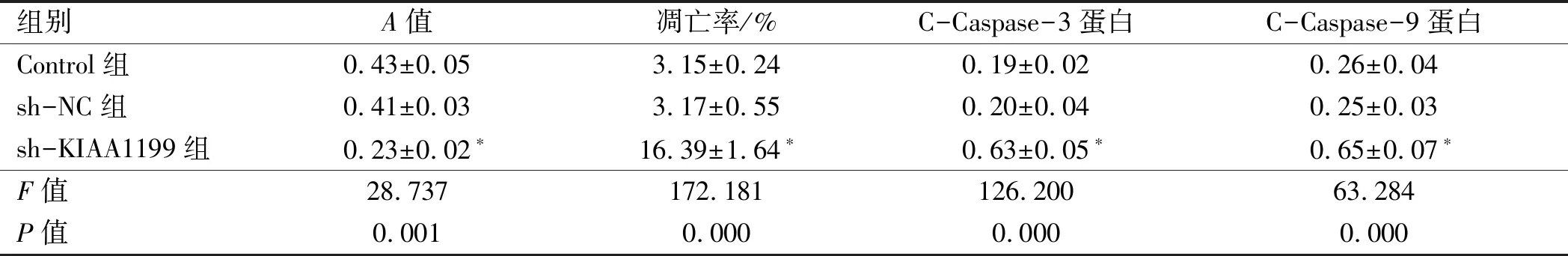
组别A值凋亡率/%C-Caspase-3蛋白C-Caspase-9蛋白Control组0.43±0.053.15±0.240.19±0.020.26±0.04sh-NC组0.41±0.033.17±0.550.20±0.040.25±0.03sh-KIAA1199组0.23±0.02∗16.39±1.64∗0.63±0.05∗0.65±0.07∗F值28.737172.181126.20063.284P值0.0010.0000.0000.000
注:与sh-NC组比较,*P<0.05。
2.3 下调KIAA1199抑制肝癌细胞中Wnt/β-catenin信号通路激活感染KIAA1199 shRNA慢病毒的肝癌细胞中β-catenin、C-myc蛋白水平降低(见图3、表3),下调KIAA1199抑制肝癌细胞中Wnt/β-catenin信号激活。
2.4Wnt/β-catenin信号通路激活剂LiCl促进下调KIAA1199的肝癌细胞中Wnt/β-catenin信号激活Wnt信号通路激活剂LiCl处理感染KIAA1199 shRNA慢病毒的肝癌细胞,细胞中β-catenin、C-myc蛋白水平升高(见图4、表4),Wnt信号通路激活剂LiCl促进下调KIAA1199的肝癌细胞中Wnt/β-catenin信号激活。
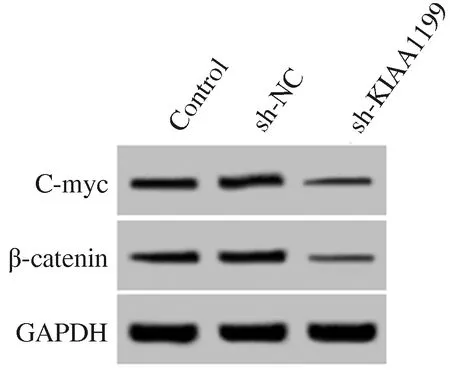
图3 Western blotting检测KIAA1199 shRNA慢病毒感染后肝癌细胞中Wnt/β-catenin信号通路蛋白β-catenin、C-myc表达情况
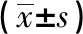
表3 KIAA1199 shRNA慢病毒感染后肝癌细胞β-catenin、C-myc蛋白水平
注:与sh-NC相比较,*P<0.05。

图4 Western blotting检测Wnt/β-catenin信号激活剂LiCl对KIAA1199 shRNA慢病毒感染后肝癌细胞中β-catenin、C-myc表达影响
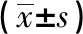
表4 Wnt/β-catenin信号激活剂LiCl处理的KIAA1199 shRNA慢病毒感染后肝癌细胞中β-catenin、C-myc蛋白水平
2.5Wnt/β-catenin信号通路激活剂LiCl逆转下调KIAA1199对肝癌细胞增殖和凋亡作用Wnt/β-catenin信号通路激活剂LiCl处理感染KIAA1199 shRNA慢病毒的肝癌细胞,细胞A值升高,凋亡率降低,细胞中C-Caspase-3、C-Caspase-9蛋白表达水平下降(见图5、表5),Wnt/β-catenin信号通路激活剂LiCl逆转下调KIAA1199对肝癌细胞增殖和凋亡影响。
3 讨论
KIAA1199是人类新识别的编码大分子蛋白质基因数据库中的成员,其基因定位在人类15q25.1染色体上,编码的蛋白质含有7个结构域,具有水解多聚糖、细胞外配体结合等作用[8]。近些年来的研究显示,KIAA1199与肿瘤密切相关,其在结直肠癌等肿瘤组织中过度表达。KIAA1199可以促进肿瘤细胞的恶性生长,减少细胞凋亡发生,而敲除KIAA1199可以抑制胃癌细胞的生长,诱导胃癌细胞凋亡[9-10]。研究报道,肝癌组织中KIAA1199高表达与肝癌患者的TNM分期等临床病理特征及预后有关,高表达KIAA1199增加肝癌患者死亡风险,抑制KIAA1199可以降低肝癌转移能力[7,11]。本实验结果显示,下调KIAA1199后的肝癌细胞增殖能力降低,提示下调KIAA1199抑制肝癌细胞恶性增殖,KIAA1199可能是肝癌治疗的有效靶点。

图5Wnt/β-catenin信号激活剂LiCl对KIAA1199shRNA慢病毒感染后肝癌细胞凋亡和细胞中C-Caspase-3、C-Caspase-9蛋白表达影响A:流式细胞术检测Wnt/β-catenin信号激活剂LiCl对KIAA1199 shRNA慢病毒感染后肝癌细胞凋亡影响;B:Western blotting检测Wnt/β-catenin信号激活剂LiCl对KIAA1199 shRNA慢病毒感染后肝癌细胞中C-Caspase-3、C-Caspase-9表达影响
Fig5EffectofWnt/β-cateninsignalactivatorLiClonapoptosisandexpressionsofC-Caspase-3,C-Caspase-9proteinsinlivercancercellsinfectedwithKIAA1199shRNAlentivirusA: the effect of Wnt/β-catenin signal activator LiCl on apoptosis of liver cancer cells infected with KIAA1199 shRNA lentivirus detected by flow cytometry; B: the effect of Wnt/β-catenin signal activator LiCl on the expressions of C-Caspase-3 and C-Caspase-9 in liver cancer cells infected with KIAA1199 shRNA lentivirus detected by Western blotting
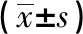
表5 Wnt/β-catenin信号激活剂LiCl处理的KIAA1199 shRNA慢病毒感染后肝癌细胞A值、凋亡率和C-Caspase-3、C-Caspase-9蛋白水平
肿瘤细胞凋亡减少是肿瘤发生的重要特征之一[12]。众所周知,细胞凋亡的发生是细胞主动过程,与细胞内多种调节因子的表达调控有关[13]。Caspase蛋白家族含有多个成员,分别在细胞凋亡过程中发挥不同作用,Caspase-3是位于Caspase凋亡反应下游的执行因子,其在正常情况下以无活性的酶原形式存在,只有被激活后形成C-Caspase-3才可以不可逆地诱导细胞凋亡发生[14]。Caspase-9是Caspase凋亡反应上游的起始因子,其活化后形成C-Caspase-9可以激活下游Caspase蛋白成员,从而诱导Caspase凋亡反应发生[15]。我们的实验表明,下调KIAA1199后的肝癌细胞凋亡水平增加,同时细胞中C-Caspase-3、C-Caspase-9蛋白表达水平升高,提示下调KIAA1199可以诱导肝癌细胞凋亡。
Wnt/β-catenin是一个在生物进化过程中极为保守的信号通路,在果蝇等低等生物到人类等高等哺乳动物中具有高度同源性,其可以调控β-catenin的表达并且依赖于β-catenin表达调控[16]。Wnt/β-catenin信号通路参与人体正常生理功能发挥,与细胞的生长、能量代谢、胚胎发育等有关[17]。最近的研究显示,Wnt/β-catenin还与人类疾病如心血管系统疾病、神经损伤有关[18]。Wnt/β-catenin参与肿瘤进展引起人们广泛关注,Wnt/β-catenin在肿瘤组织中过度激活,β-catenin过度表达可以诱导肿瘤细胞恶性生长,而靶向抑制Wnt/β-catenin信号可以阻碍肿瘤进展[19-20]。C-myc是Wnt/β-catenin信号的下游基因,其表达受到Wnt/β-catenin信号的正调控[21]。本研究表明,下调KIAA1199后的肝癌细胞中β-catenin、C-myc蛋白水平降低,提示下调KIAA1199抗肝癌细胞恶性表型可能与Wnt/β-catenin信号有关。以前的研究显示,KIAA1199可以反馈调控Wnt/β-catenin信号,敲除KIAA1199可以抑制肠癌细胞中Wnt/β-catenin信号激活[22]。本实验表明,Wnt/β-catenin信号激活剂可以逆转下调KIAA1199对肝癌细胞增殖抑制和凋亡促进作用,说明下调KIAA1199抗肝癌作用机制与抑制Wnt/β-catenin信号有关。
总之,KIAA1199可能是肝癌基因靶向治疗的有效靶点,下调KIAA1199可以抑制肝癌细胞增殖和诱导细胞凋亡,其作用机制与下调Wnt/β-catenin信号激活水平有关。本实验结果为研究KIAA1199在肿瘤进展中的作用机制提供了参考,为研究肝癌分子发生机制提供了资料。目前对于KIAA1199在肝癌细胞增殖、凋亡中的具体靶向调控结合位点尚不明确,在以后实验中会进一步阐明和验证。
