碳纤维微电极负载金纳米粒子用于芦荟多糖的在体动态监测
2020-01-16王婷婷杨莉莉鲍昌昊
王婷婷, 李 元, 杨莉莉, 鲍昌昊, 程 寒,2
(1. 中南民族大学药学院, 2. 民族药学国家级实验教学示范中心, 武汉 430074)
中国芦荟又称作斑纹芦荟, 其作为药用植物被载入中国药典[1~4]. 芦荟有500多个品种, 可药用的达50余种[5]. 其味苦性寒, 归肝经、 心经、 胃经、 大肠经, 可以治疗肝火头疼、 目赤肿痛、 热解便秘、 烫伤、 咳嗽, 也可美容, 临床应用于五官科、 内科, 外科及肿瘤科等[6~8]. 研究证明芦荟多糖是芦荟的主要有效成分之一[9], 具有杀菌消炎[10]、 抗病毒[11]、 抗胃溃疡[12]、 抗肿瘤[13]和免疫调节等作用[14], 因此芦荟多糖成为芦荟产品研发关注的重点. 近年来, 芦荟在医药、 美容和日用品等方面应用广泛, 但针对芦荟多糖合成水平的监测技术相对薄弱[15], 因此, 有必要建立操作简便的芦荟多糖测定方法, 便于检测芦荟的生长状况及考查芦荟原料的质量. Lin等[16]采用苯酚-硫酸显色反应法和电化学差示脉冲伏安法测定了芦荟不同部位的多糖含量; 佘晓雷等[17]采用精制芦荟多糖测得芦荟多糖对葡萄糖的换算因子, 样品经前处理除杂质, 用苯酚-硫酸法测定芦荟中多糖的含量; 程万清等[18]采用分光光度法测定芦荟样品中芦荟多糖的含量, 但上述方法均无法实现对在体芦荟植株中芦荟多糖的动态监测.
碳纤维具有质量轻、 尺寸小、 比表面积大、 吸附性好及电化学性能稳定等优点, 是优良的电极材料[19,20]. 在生物分析领域, 碳纤维微电极(CFME)可以实现细胞胞内及胞间生物因子的无损分析, 为在体实时动态监测芦荟多糖因子水平提供了更加高效、 准确的技术方法和手段. 纳米材料修饰电极具有更高的灵敏度, 同时能更好地消除共存组分的干扰, 提高检测选择性[21,22].
使用活体检测技术对生物体内组分进行快速检测, 能够更准确地反映活体生物体内目标分析物的真实水平[23]. 与通常的离体分析过程相比, 活体检测技术将采样与检测过程集成为一步, 显著提高了活体生物分析的效率. 在活体分析领域, 基于相关电化学检测动力学理论的发展和新型活体检测电极的研制, 电化学检测技术正逐步用于不同动植物体系中多种成分的分析[24,25]. 低损伤的电化学分析方法非常适合活体分析, 它能实现反复对同一生物体进行采样, 而不造成严重的侵入式伤害.
迄今, 关于实时、 动态地在体监测芦荟多糖水平随环境应激变化波动情况的研究鲜见报道. 本文采用金纳米粒子修饰的碳纤维微电极提高检测灵敏度, 将修饰电极嵌入活体植株凝胶中, 实现了对不同光照条件下生长的芦荟植株中芦荟多糖水平的动态监测.
1 实验部分
1.1 试剂、 材料与仪器
氯金酸(HAuCl4·4H2O)、 乙醇(分析纯)和葡萄糖(分析纯)购于国药集团化学试剂有限公司; 芦荟(6周龄, 中华芦荟, 零零壹芦荟农业科技有限公司); 碳粉导电胶(自制); 实验用水为超纯水.
XD-RFL型倒置显微镜(宁波舜宇仪器有限公司); CHI660D型电化学工作站(上海辰华仪器公司); AR224CN型分析天平(上海奥豪斯仪器有限公司); KQ-500E型超声波清洗器(昆山市超声仪器有限公司). 电化学实验采用双电极系统: 碳纤维电极为工作电极, Ag/AgCl为参比电极.
1.2 实验过程
1.2.1 纳米金分散液的制备 将1 g AuCl3·HCl·4H2O溶解于100 mL二次蒸馏水中配制10 g/L HAuCl4溶液; 将1 g柠檬酸三钠溶解于100 mL二次蒸馏水中配制10 g/L C6H5Na3O7·2H2O溶液; 将0.345 g碳酸钾溶解于100 mL二次蒸馏水中配制成10 g/L K2CO3溶液; 将1 g单宁酸溶解于100 mL二次蒸馏水中配制成10 g/L C76H52046溶液. 室温下在烧杯中依次加入20 mL蒸馏水、 0.560 mL 10 g/L的柠檬酸三钠溶液、 0.3 mL 10 g/L的单宁酸和碳酸钾溶液, 搅拌直至溶液呈酒红色, 即得粒径为(6±2) nm的纳米金粒子分散液.
1.2.2 纳米金修饰碳纤维微电极的制备 取10 mL纳米金分散液置于50 mL小烧杯中, 将碳纤维电极和 Ag/AgCl参比电极放入其中, 恒定电流模式下于2.0 V电沉积30 min, 即在碳纤维微电极(CFME)表面构建了纳米金修饰层, 取出用水冲洗, 晾干, 即得纳米金修饰碳纤维微电极(AuNPs/CFME).
2 结果与讨论
2.1 碳纤维微电极在芦荟凝胶层中的电化学响应及检测稳定性
将CFME置于纳米金溶胶中, 球形纳米金粒径为15 nm[图1(A)], 图1(B)中517 nm处的峰是粒径为15 nm的纳米金的紫外特征吸收峰[26], 于1.5 V下电沉积30 min制得AuNPs/CFME. 由AuNPs/CFME的SEM照片可见, 未修饰的CFME表面光滑平整[图2(A)], 修饰后电极表面被一层纳米金包裹, 电极直径略有增加, 表面积增大[图2(B)].

Fig.1 TEM image(A) and UV-Vis absorption spectrum(B) of AuNPs

Fig.2 SEM images of CFME(A) and AuNPs/CFME(B)
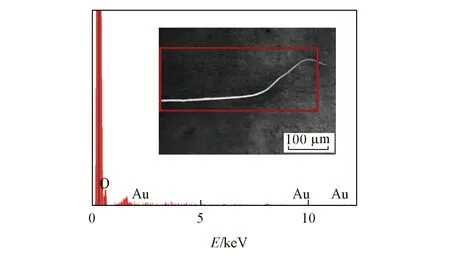
Fig.3 EDS image of AuNPs/CFME Inset: the red box in the SEM image of AuNPs/CFME is the detection window of EDS.
图3为AuNPs/CFME的EDS谱图, AuNPs/CFME的Au含量为0.117%, 表明金纳米粒子已修饰在CFME表面.
用消毒刀片在芦荟叶片表面剖开一个5 mm×5 mm的检测窗口(图4插图), 使芦荟植株的储水凝胶组织暴露, 分别插入碳纤维微电极与Ag/AgCl 参比电极进行差分脉冲扫描, 电极直径6 μm(φtip<6 μm), 插入深度1 mm, 扫描范围0.5~-0.2 V. 由图4可见, 在0.2~0.3 V电位处出现1个氧化峰, 在检测窗口处滴加100 μL 10-2mol/L的葡萄糖溶液后, 该氧化峰电流明显增加, 且峰电位偏移小于0.1 V, 与文献[16,27]报道的峰电位一致, 推测该峰为芦荟多糖的氧化峰.
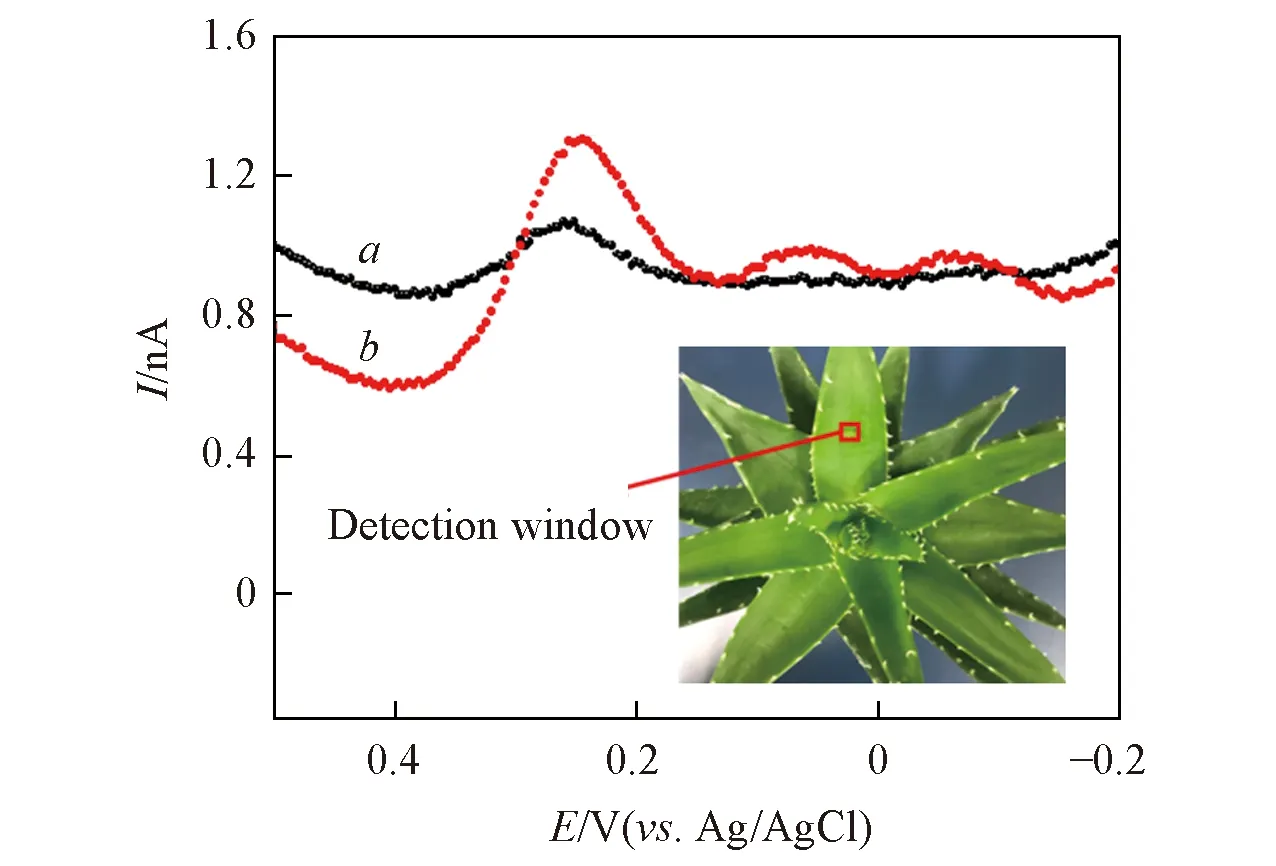
Fig.4 DPVs of aloe polysaccharide in water storage tissue gel layer of aloe leaves for AuNPs/CFME before(a) and after(b) adding 100 μL 10-2 mol/L glucose solution
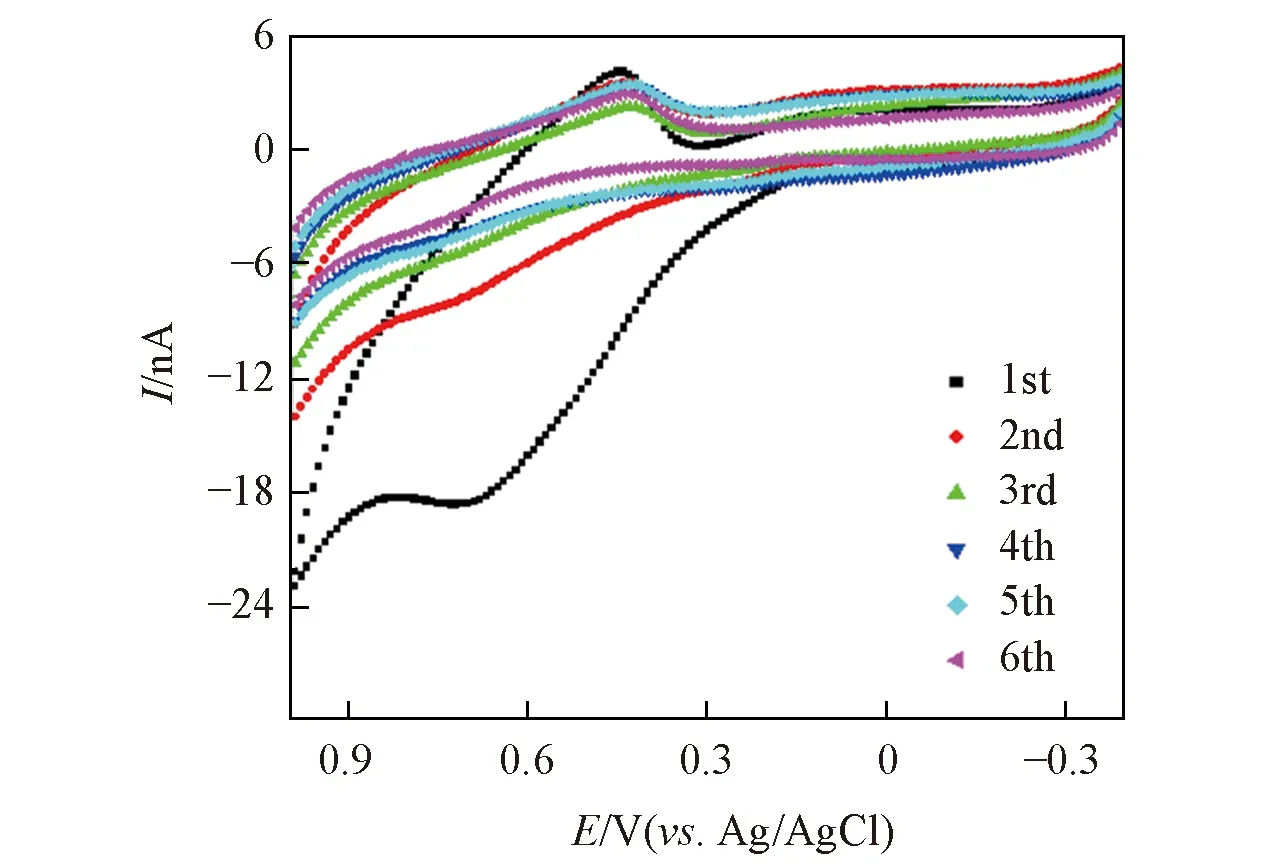
Fig.5 Repetitive CV curves of aloe polysaccharide in water storage tissue gel layer of aloe leaves with scanning speed of 0.1 V/s for CFME

Fig.6 CV curves of 1 mg/mL aloe polysaccharide in PBS(pH=7.0) with scanning speed of 0.1 V/s for AuNPs/CFME
将一根洁净的CFME置于储水凝胶组织中连续进行循环伏安扫描6次, 扫描速率100 mV/s, 扫描范围1.0~-0.4 V. 结果如图5所示, 电流强度随扫描次数的增加而递减, 表明CFME在芦荟储水凝胶组织中检测芦荟多糖的稳定性较差. 这是由于在芦荟储水凝胶组织中, 叶酸含有对氨基苯甲酸的苯环结构从而在电化学检测过程中表现出强吸附作用[28]; 另外, 蛋白酶等物质会在传感界面产生非特异性吸附[29], 对电极产生明显的钝化作用, 使CFME对芦荟多糖的检测灵敏度明显降低, 对电化学动态监测芦荟叶储水凝胶组织中的芦荟多糖水平有严重的干扰.
2.2 AuNPs/CFME在体检测芦荟多糖
将CFME和Ag/AgCl参比电极置于纳米金溶胶中, 恒定电压下电沉积适当时间. 经AuNPs修饰后的CFME在pH=7.0的PBS缓冲溶液中, 芦荟多糖的循环伏安曲线的氧化峰电流值明显增大(见图6).
将AuNPs/CFME电极应用于芦荟植株在体检测, 由图7可见, CFME经纳米金修饰后在芦荟储水凝胶组织中检测芦荟多糖的电化学稳定性明显增强, 通过比较6次循环伏安扫描曲线中氧化峰和还原峰电流的变化得出其相对标准偏差(RSD)值<10%. 这说明CFME经纳米金修饰后, 降低了电化学动态监测芦荟多糖水平的干扰.
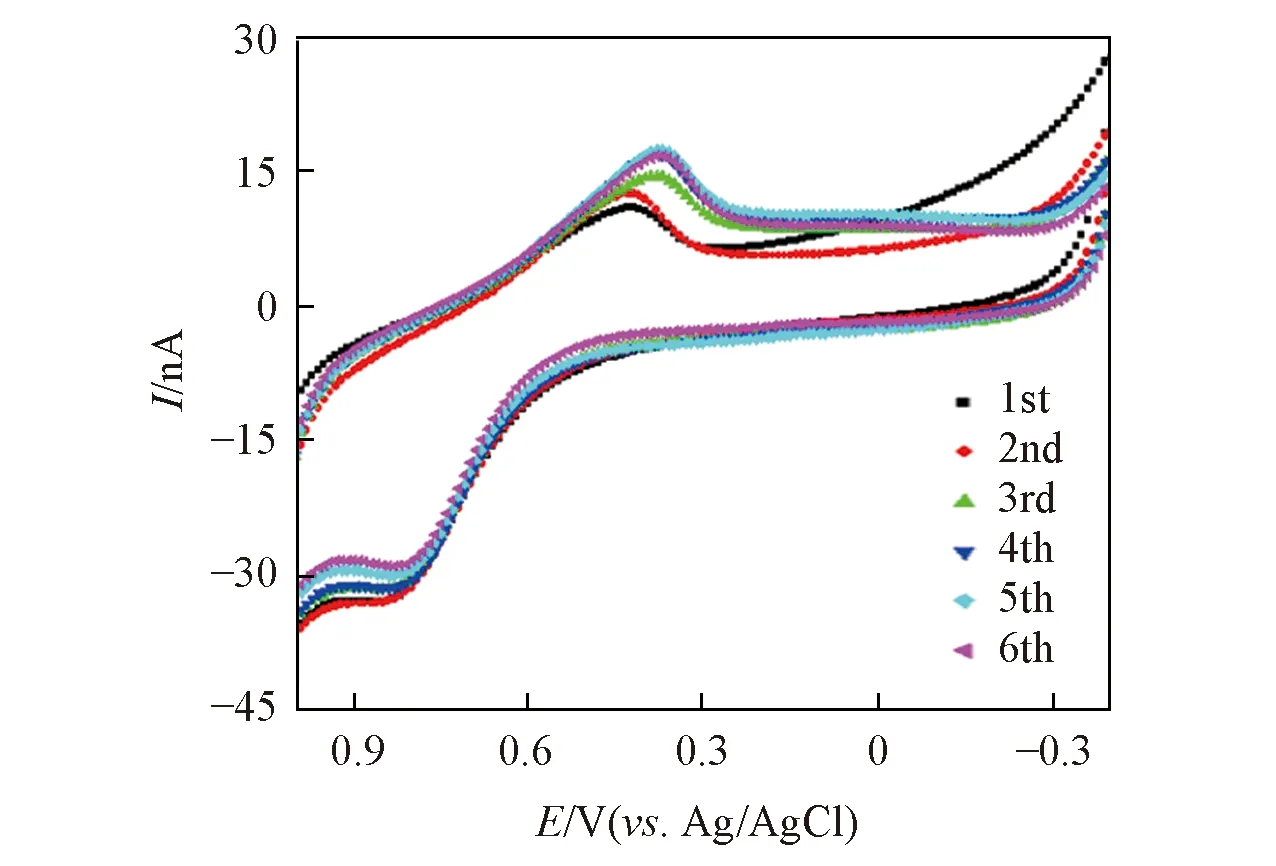
Fig.7 Repetitive CV curves of aloe polysaccharide in water storage tissue gel layer of aloe leave with scanning speed of 0.1 V/s for AuNPs/CFME

Fig.8 CV curves of aloe polysaccharide in aloe leaves water storage tissue gel layer for different electrodes
从纳米金修饰前后CFME监测芦荟多糖的循环伏安叠加图(图8)可见, 纳米金修饰后电极对芦荟多糖的电化学响应显著增加, 而且氧化峰电流的位置无明显偏移, 说明修饰后的电极对芦荟多糖有良好的电催化效果.
2.3 AuNPs/CFME的电化学阻抗谱及电化学活性面积分析
采用电化学阻抗谱(EIS)对修饰过程中电极的阻抗值变化进行了考察. 在EIS谱测定过程中, 以[Fe(CN)6]3-/[Fe(CN)6]4-作氧化还原探针, 阻抗谱半圆直径等于电子转移电阻Ret. 结果如图9(A) 所示, 谱线a和b分别为CFME和AuNPs/CFME的EIS谱线, 频率范围0.05 Hz~100 kHz. 裸CFME的Ret值非常大, 约为5.913×105Ω, 而AuNPs/CFME 的Ret值明显减小, 约为10-3Ω. 这是由于纳米金粒子的表面效应[30]及表面原子的空位效应使纳米金粒子具有高活性, 修饰电极表面被一层纳米金粒子覆盖, 降低了电极的界面阻抗值. 电极的电活性区域是评估电极性能的重要参数, 以多巴胺为氧化还原探针通过循环伏安法测定了修饰电极的有效表面积. 对于可逆过程, 采用Randles-Sevcik方程计算电极的电活性面积:
Ip=2.69×105An3/2D1/2v1/2c
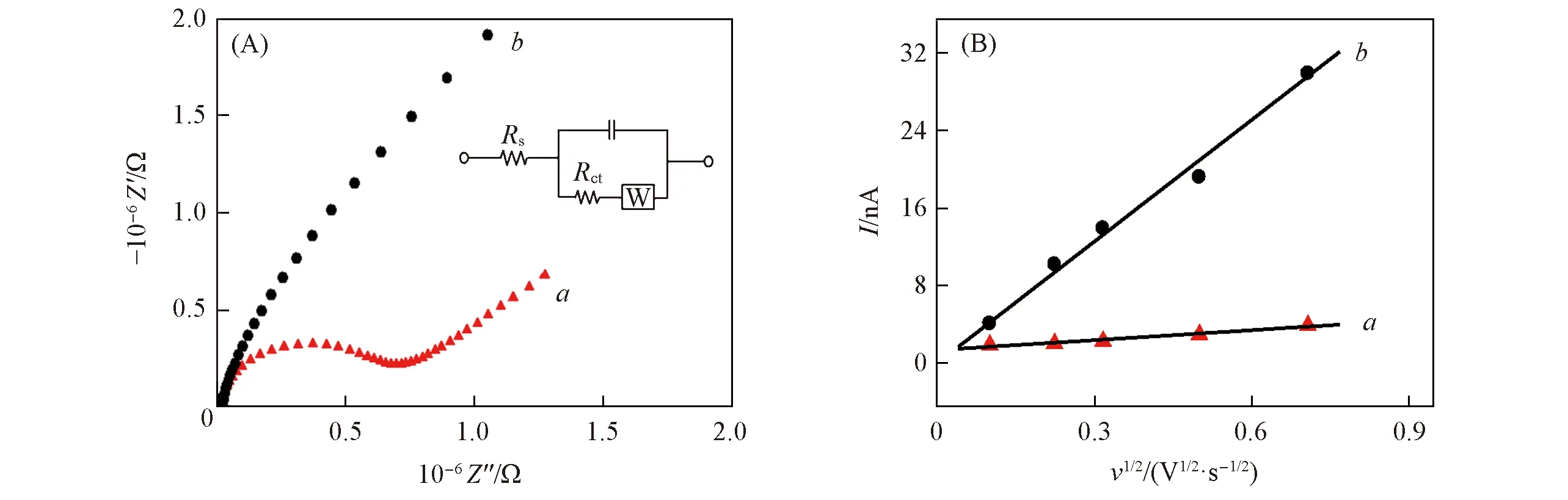
Fig.9 EIS curves of bare CFME(a), AuNPs/CFME(b) in 0.1 mol/L of KCl solution containing 5 mmol/L of [Fe(CN)6]3-/4-(A) and linear relationship between peak current and the square root of scanning rate for CFME(a) and AuNPs/CFME(b)(B) Inset of (A): Randles equivalence circuit model was used to fit the data.
式中:A(cm2)为工作电极的有效电活性表面积;n为反应中的电子转移, 该值等于2;D为在确定的溶液中指探针分子的扩散系数, 约为9.145×10-7cm2/s;υ(V/s)表示扫描速率,c(mol/L)对应于氧化还原探针的浓度, 在该反应中检测到的分子浓度为10 μmol/L;Ip(nA)代表氧化还原电流峰值. 由Ip对v1/2线性方程[图9(B)]的斜率计算得出CFME和AuNPs/CFME的表面积分别为4.123×10-7和5.498×10-6cm2, AuNPs/CFME的微观电活性面积是裸CFME的13.334倍. 上述结果表明, 与CFME相比, AuNPs/CFME具有更大的比表面积, 从而可提供更多的电化学活性位点. 综上, AuNPs/CFME电化学性能提高是修饰电极大的比表面积、 优良电导率以及AuNPs 粒子的催化活性共同作用的结果.
2.4 CFME修饰条件的优化
采用循环伏安法考察了修饰电极电沉积时间对芦荟多糖电化学响应的影响. 如图10所示, 设定初始恒定电压为1.5 V, 随着电沉积时间的延长, 芦荟储水组织中芦荟多糖电化学的响应也随之增强, 当沉积时间达30 min时, 芦荟多糖的氧化峰电流达到最大值, 继续增加电沉积时间, 芦荟多糖的氧化峰电流下降, 故选择最佳电沉积时间为30 min.
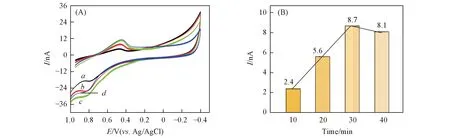
Fig.10 CV curves of aloe polysaccharide in water storage tissue gel layer of aloe leaves for AuNPs/CFME with different electrodeposition time(A) and effects of electrodeposition time on the oxidation peak current of aloe polysaccharide in water storage tissue gel layer of aloe leaves by CV measurements(B) Electrodeposition time/min: a. 10; b. 20; c. 30; d. 40.
2.5 不同光照条件下芦荟多糖的含量变化
分别设置对照组和实验组, 对照组为正常光照环境下的芦荟植株, 实验组为在黑暗环境下放置2 d的芦荟植株(与对照组所用植株相同). 将纳米金修饰后的CFME与参比电极插入芦荟叶片的储水凝胶组织中, 进行电化学检测, 在不同叶片位置平行检测20次, 表1列出了测定结果. 图11为对照组和实验组分别进行20次电化学响应实验的柱状图, 可以看出对照组的电化学响应均明显高于实验组(P<0.01), 对照组和实验组的氧化峰电流值具有统计学差异, 说明无光条件下芦荟多糖的含量比正常光照环境下明显降低, 可用于衡量芦荟植株光合作用程度.

Table 1 Electrochemical response of control group and experimental group(n=20)*
*I: the average value of three times measure on each identical detection window.

Fig.11 Histogram of 20 electrochemical responses of test group and control group in Table 1
3 结 论
建立了一种动态监测不同生长环境下活体芦荟植株中芦荟多糖浓度水平的电化学方法, 通过在基底电极界面修饰纳米金粒子增强其对芦荟多糖的电化学响应, 可更灵敏地监测芦荟多糖的浓度变化. 结果表明, 不同光照环境下生长的芦荟植株中芦荟多糖的变化具有显著的统计学差异, 可作为衡量芦荟光合作用强度的指标之一, 为进一步研究芦荟植株应对不同外界环境体内各种激素水平变化提供了论据.
