交联化海藻酸钠-羟乙基纤维素复合膜 吸附水中Cu(II)的性能研究
2020-01-16蒋海燕汪爱河
蒋海燕,段 毅,汪爱河
(1. 湖南城市学院 市政与测绘工程学院,湖南 益阳 413000;2. 湖南大学 土木工程学院,长沙 410082)
含铜废水是一种比较常见的重金属污染,在工业生产过程中会大量产生,铜离子常以Cu(II)的形式存在.人体摄入过量的铜会导致严重的疾病[1-2].目前含铜废水的主要处理方法有沉淀法、溶液萃取法、氧化还原法、生物法、胶束增强超滤法和吸附法等[3].吸附膜是一种高分子薄膜吸附剂,不仅具有普通颗粒吸附剂拥有的优点(操作简单、污泥量少、可回收重金属),且相比于普通颗粒吸附剂,它可以使金属离子快速扩散到其表面及内部位点且分离简单,因而备受关注[4-6].近年来,人们越来越关注天然可用的低成本生物材料,它们不仅环境友好,而且可以去除废水中的重金属离子[7-9].其中,羟乙基纤维素(HEC)是一种纤维素衍生物,良好的水溶性使其本身不能作为吸附剂材料,但其分子中含有大量的羟基使其易于进行化学修饰改性以及与重金属离子发生反应[10-12].海藻酸钠(SA)是天然存在的多糖类生物材料[13],具有良好的稳定性和成膜性,含有丰富的羧基和醇基等活性基团,引起了研究者的广泛关注.已有研究表明海藻酸钠对酶[14]、细菌[15-16]及一些可溶性的高分子材料[5-6,13]具有很好的固定化效果,且对重金属离子也具有吸附作用.
研究采用戊二醛(GA)交联SA 固定HEC,制备得到具有丰富的羧基、醇基和羟基功能基团的GHS 复合膜,并以Cu(II)为目标污染物,考察GHS对Cu(II)的吸附性能,为GHS吸附剂处理含Cu(II)的废水提供实验基础和理论依据.
1 实验部分
1.1 材料与试剂
海藻酸钠(化学纯,天津市远航化学品有限公司);50%戊二醛(分析纯,天津市光复精细化工研究所);羟乙基纤维素(化学纯,天津市光复精细化工研究所);铜粉(高纯99.99%,天津市光复精细化工研究所);聚乙二醇(分子量6 000)(分析纯,天津市科密欧化学试剂有限公司).
1.2 GHS 吸附剂制备
1)过滤.先将2 g 海藻酸钠溶于100 mL 去离子水中,搅拌溶解,采用真空抽滤,去除不溶解物.2)混合.再将0.6 g 羟乙基纤维素加入海藻酸钠滤液中,然后向溶液中加入0.4 g 聚乙二醇,继续搅拌使之溶解.3)成膜.再将混合液流延到10 cm×10 cm 玻璃平板上,置入干燥箱,在50 ℃条件下烘180 min.4)交联.将烘干膜浸入2.5%戊二醛稀盐酸溶液中240 min 后,再将膜放入去离子水中浸泡24 h.5)烘干.最后将膜放入干燥箱中,在50 ℃条件下烘120 min,干燥后,剪成1 cm×1 cm 大小的膜,厚度大约0.1 mm,备用.
1.3 吸附实验
在不同投加量、溶液pH 值、接触时间、Cu(II)初始浓度下进行一系列静态吸附试验.先在250 mL 锥形瓶中加入吸附剂,倒入100 mL 的Cu(II)溶液,调节溶液pH 值,在恒定的温度下振荡吸附;当达到吸附平衡后,过滤,采用原子吸收分光光度法测定滤液中Cu(II)的剩余浓度,根据公式(1)计算Cu(II)的吸附量.
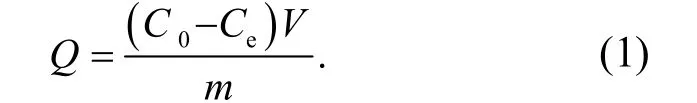
其中,Q为吸附剂对Cu(II)吸附量,mmol/g;C0和Ce分别为溶液的初始浓度和吸附后浓度,mmol/L;V为溶液体积,L;m为吸附剂的质量,g.
2 结果与讨论
2.1 投加量影响
Cu(II)初始浓度为30 mg/L、接触时间60 min、pH=6 和温度为35 ℃条件下,10~150 mg 范围内调节吸附剂的量,考察投加量对吸附效果的影响如图1 所示.
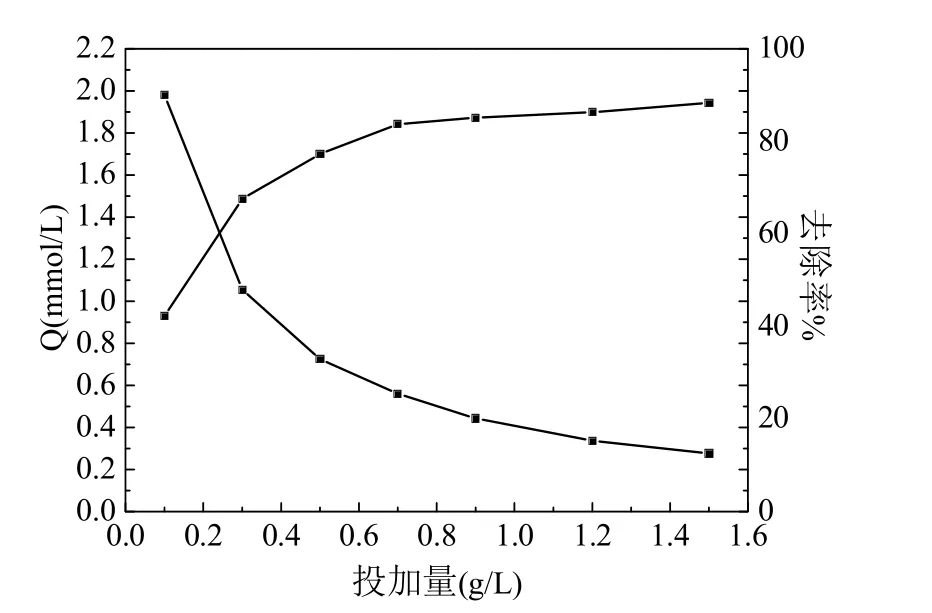
图1 投加量对吸附的影响
由图1 可知,随着投加量的增加,Cu(II)的去除率逐渐增加;当增加到0.7 g/L 后,去除率增加减缓.这是由于GHS 投加量达到0.7 g/L 时,大部分Cu(II)已经被吸附,溶液中剩余Cu(II)浓度比较低,与GHS 未被占据的吸附位点接触机会大大降低,所以去除率增加缓慢.与此同时,GHS 的吸附量随着投加量增加而减少,这是由于投加量一直增加而去除率增加缓慢,导致吸附剂活性位点利用效率低.综合考虑Cu(II)的去除率和GHS的吸附量,0.5 g/L 的投加量被认为是最佳的.
2.2 pH 值影响
吸附剂投加量为0.5 g/L、吸附时间为60 min、Cu(II)初始浓度为30 mg/L、温度为35 ℃和溶液pH 值为2~6 条件下,实验结果如图2 所示.
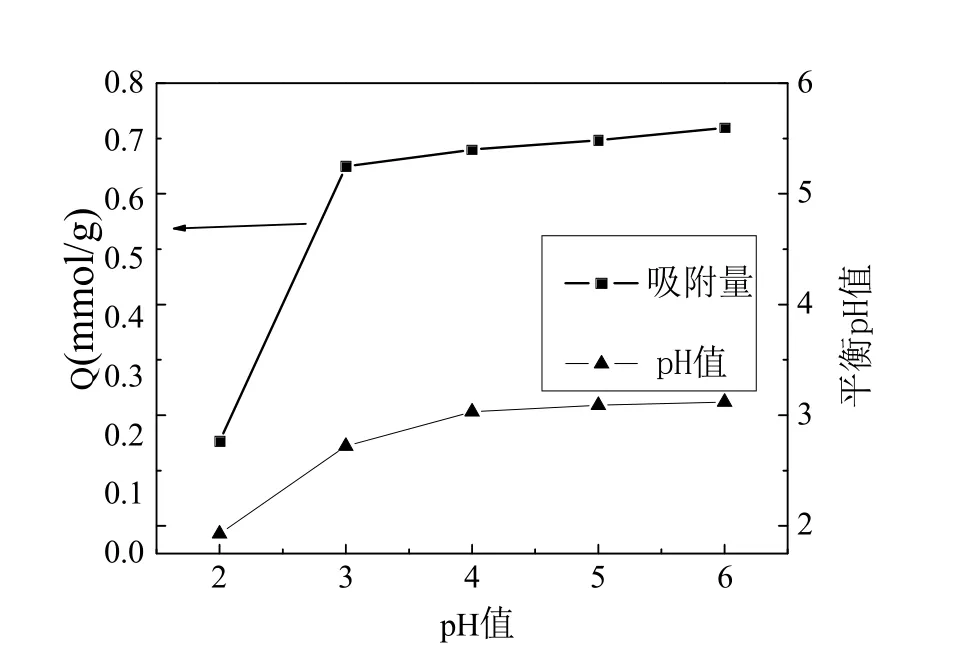
图2 pH 值对吸附的影响
由图2 可知,当pH<3 时,吸附量随pH 值增加而快速增加;pH>3 时,吸附量随pH 值增加而缓慢增加.这是由于GHS 表面含有大量羧基,它在水溶液中存在着一种电离平衡RCOOH+H2O →H3O++RCOO-(R 表示基体),随着pH 值升高,越来越多H3O+释放到了水溶液中,GHS 表面负电荷也越来越多,增强了GHS 对Cu2+的吸附能力.从图2 还可以看出,吸附后溶液pH 值逐渐下降,这表明H+参与Cu(II)的吸附过程.铜离子在pH>6.5 时发生水解并产生沉淀[3,13],因此选定GHS 去除Cu(II)的最佳pH 值为6.
2.3 吸附等温线
吸附剂投加量为0.5 g/L、接触时间60 min、pH=6、温度为35 ℃和Cu(II)初始浓度为10~90 mg/L 条件下,为进一步探究GHS 对Cu(II)的吸附特点,采用Langmuir、Freundlich 和Dubinin- Radushkevich(D-R)等温吸附模型来模拟其吸附等温线.Langmuir 方程线性表达式为
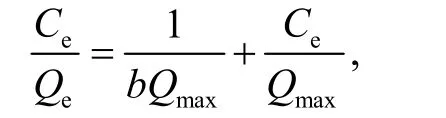
Freundlich 方程线性表达式为
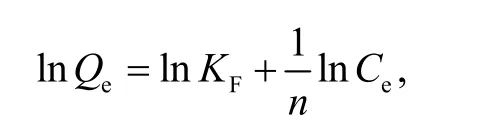
D-R 方程线性表达式为
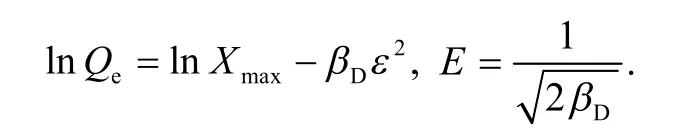
其中,Ce为吸附平衡时溶液中的金属离子浓度,mmol/L;b为Langmuir 常数,L/mmol;Qmax为饱和吸附量,mmol/g;Qe为吸附平衡时的吸附量,mmol/g;KF为Freundlich 等温吸附模型中与吸附容量有关的常数;n为Freundlich 常数;Xmax为D-R方程计算出的最大吸附容量,mmol/g;βD为D-R等温吸附常数.等温吸附模型参数如表1 所示.
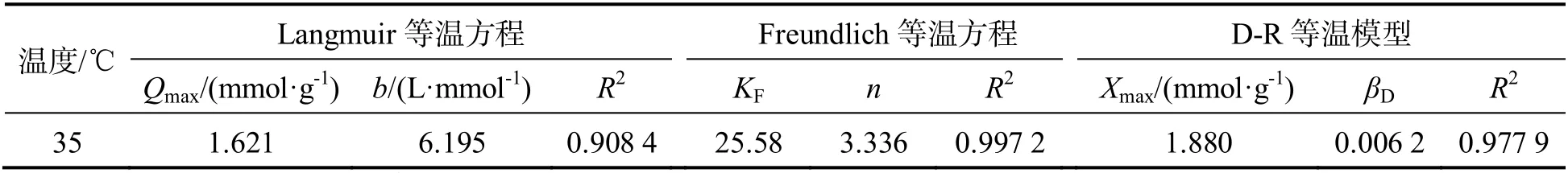
表1 等温吸附模型参数
从表1 中相关系数R2可看出,Freundlich 等温线拟合较好,说明GHS 对Cu(II)的吸附可能是一个非均相吸附的过程;当温度为35 ℃时,GHS对Cu(II)的最大吸附容量为1.621 mmol/g;D-R等温吸附模型中的E在一定程度可以反应其吸附机理,当8 KJ/mol≤E<16 KJ/mol 时,吸附机理为离子交换[3,6],表1 中的数据通过D-R 方程计算出的Cu(II)吸附机理可能是离子交换[3],这与pH值对吸附效果的影响分析一致.
2.4 吸附动力学
在温度为35 ℃、吸附剂的投加量为0.5 g/L、pH=6 和Cu(II)初始浓度为30 mg/L 条件下,调节溶液的接触时间分别为2,5,10,20,30,45,60,90 和120 min,试验结果如图3 所示.

图3 接触时间对吸附过程的影响
图3 表明,GHS 对Cu(II)的吸附量随着接触时间的增加而逐渐增大,在60 min 时吸附达到平衡,因此60 min 被选作吸附的最佳时间.
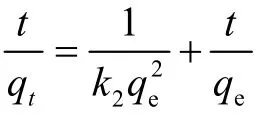
实验拟合结果分别如图4~图5 所示,数据拟合所得的动力学参数如表2 所示.

图4 GHS 吸附Cu(II)的准一级反应动力学

图5 GHS 吸附Cu(II)的准二级反应动力学

表2 准一级、准二级反应动力学模型参数
从表2 中相关系数R2可以看出,GHS对Cu(II)的吸附更适合准二级动力学模型.
3 结论
1)GHS 对Cu(II)具有较好的吸附效果.在温度为35 ℃、pH 值为6.0 和吸附剂投加量为0.5 g/L条件下,GHS 对Cu(II)的最大吸附容量为1.621 mmol/g.
2)GHS 对Cu(II)的吸附在60 min 达到平衡,吸附动力学符合准二级动力学模型.
3)Langmuir、Freundlich 和D-R 等温吸附模型对数据的拟合均较好,其中Freundlich 等温吸附模型的拟合最好,表明GHS 对Cu(II)的吸附可能是一个非均相吸附的过程.
